Avanços dos anestésicos locais nanoestruturados de liberação estendida
Resumo
Os anestésicos locais de liberação prolongada (ALs) têm chamado a atenção cada vez mais com seu papel promissor em melhorar a analgesia e reduzir os eventos adversos dos ALs. Os transportadores nanoestruturados, como lipossomas e polimerssomas, atendem de forma otimizada às demandas de / para liberação prolongada e têm sido utilizados na distribuição de drogas ao longo de décadas e mostraram resultados satisfatórios com liberação prolongada. Com base na tecnologia madura de lipossomas, EXPAREL, o primeiro LA lipossomal aprovado carregado com bupivacaína, viu seu sucesso em uma forma de liberação prolongada. Ao mesmo tempo, os polimerssomas avançam sobre os lipossomas com perfis complementares, o que inspira o surgimento de carreadores híbridos. Este artigo resumiu os recentes sucessos de pesquisa sobre LAs de liberação prolongada nanoestruturados, dos quais lipossomais e poliméricos são os sistemas principais. Além disso, com otimização contínua, os sistemas de entrega de medicamentos carregam propriedades além do simples transporte, como especificidade e capacidade de resposta. Em um futuro próximo, poderemos alcançar propriedades direcionadas de entrega e liberação controlada para satisfazer vários requisitos de analgésicos.
Introdução
A dor é considerada “o quinto sinal vital” desde 1996 devido à sua importância na saúde física e mental [1]. Para lidar com a crise de opióides que ocorre durante o tratamento tradicional da dor, é apresentado o conceito de analgesia multimodal. Os anestésicos locais (ALs) são um dos analgésicos mais usados e seguros em regimes multimodais [2, 3]. No entanto, a duração limitada (menos de 24 horas) e a toxicidade potencial (disfunção cardíaca e nervosa central) restringem sua aplicação e aumentam a urgência de contrabalançar os efeitos colaterais e a analgesia prolongada [4,5,6]. Embora cateteres descartáveis com bombas sejam usados para prolongar a duração dos ALs, os riscos de deslocamento do cateter, infecção e trauma durante o procedimento existem. Além disso, a colocação do cateter é trabalhosa e demorada [5]. LAs de liberação estendida compensam as desvantagens mencionadas. Eles são capazes de liberar continuamente uma dose segura com administração única (geralmente injeção sem anestesia geral, exigindo técnicas invasivas mínimas e ferramentas especiais) para garantir toxicidade sistêmica mínima. Enquanto isso, a duração prolongada do bloqueio nociceptivo pode ser alcançada.
Comparado aos sistemas de entrega de drogas em escala macro (DDSs), o DDS em escala nano é mais compatível com o ambiente biológico nanoestruturado, o que facilita sua penetração celular, melhor biodisponibilidade e maior tempo de retenção [4]. Com os avanços das técnicas de fabricação, o DDS em escala nano alcançou sucesso proeminente na liberação estendida, que mostra eficiência de carregamento aprimorada, melhor biocompatibilidade (inflamação local aceitável, como miotoxicidade e neurotoxicidade) e biodegradabilidade (taxa de degradação semelhante com depleção de compostos carregados e garantindo o desgaste total) [7,8,9]. Além disso, o perfil de liberação ajustável e diferenciado (duração flexível, intensidade analgésica modulada e liberação controlada controlada por modificações específicas) é projetado para atender a diferentes demandas [7, 8]. Além disso, a diversidade de materiais está disponível para escolha hoje em dia, diminuindo enormemente o custo e expandindo a aplicação de DDS em nanoescala [7].
No entanto, o DDS em nanoescala ainda enfrenta desvantagens, como liberação de explosão devido à alta proporção de superfície-volume, baixa estabilidade dos lipossomas na prateleira e resposta de corpo estranho inelegível de polímeros sintéticos [4], todos os quais atraem esforços crescentes para otimizar ainda mais o DDS em nanoescala. Aqui, resumimos várias formulações de última geração de LAs de liberação prolongada nanoestruturados. A morfologia mais comumente usada é a nanopartícula, enquanto gel nanoestruturado, niossoma, filme e bastão também são acessíveis [8, 10, 11]. Aqui, técnicas de síntese, perfis de liberação, efeitos analgésicos e qualidade de segurança são fornecidos e comparados para ajudar no design e desenvolvimento futuro.
Como funcionam os anestésicos locais?
Mecanismo analgésico e propriedades físico-químicas
Os nervos periféricos são as primeiras paradas para perceber os estímulos de dor durante a transmissão da dor [12]. É razoável considerar a inibição da dor desde o início, interrompendo as reações a jusante e as alterações desadaptativas da neuroplasticidade que são mais difíceis de controlar [13]. Portanto, os LAs se tornam a escolha perfeita. LAs atuam nos nervos periféricos através da ligação ao domínio intracelular do canal de Na dependente de voltagem, inibindo o influxo de Na + , resultando no bloqueio da despolarização [14] (Fig. 1a, b).
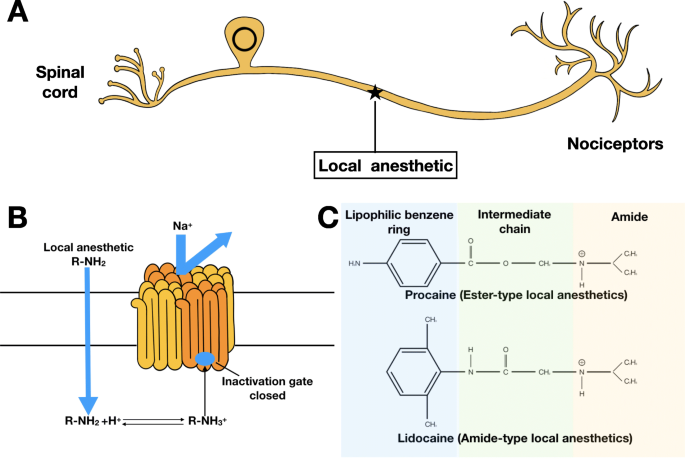
Propriedades Funcionais e Estruturais dos ALs. a , b Demonstração de como os ALs interagem com o canal de sódio controlado por voltagem no neurônio. c Estruturas típicas de LAs de éster e amida
LAs são constituídos por três grupos químicos:um grupo amino hidrofílico (principalmente aminas terciárias), um anel de benzeno lipofílico e um ligante que pode ser uma amida ou um éster, determinando a classificação dos LAs (Fig. 1c). LAs do tipo amida são os mais comumente usados, incluindo bupivacaína, ropivacaína, lidocaína e mepivacaína. LAs do tipo éster envolvem cloroprocaína, procaína e tetracaína [14, 15]. A farmacocinética, como velocidade de início, potência e duração, são amplamente determinadas por suas propriedades físico-químicas. A permeabilidade através da membrana neuronal é um fator decisivo para o início, que é influenciado pelo equilíbrio entre os LAs carregados e não carregados. Com o pKa mais próximo do pH extracelular, uma quantidade maior de LAs não carregados é formada e difundida nos neurônios para ter efeito. A potência dos ALs, também chamada de eficácia analgésica, é decorrente da lipofilicidade, que pode ser quantificada pelo coeficiente de partição. A duração é um representante da afinidade de ligação às proteínas, que também cria um reservatório à medida que os LAs livres são metabolizados. No geral, LAs do tipo éster mostram início relativamente rápido devido ao seu pK a fisiologicamente semelhante , mas de curta duração devido à hidrólise mais fácil e menor afinidade protéica in vivo, enquanto a bupivacaína é o LA com a maior duração de efeito devido à sua longa cadeia alquílica [14, 16] (Tabela 1).
Toxicidade Sistêmica
Os efeitos determinantes das propriedades também estão relacionados com a toxicidade sistêmica. Apesar da barreira hematoencefálica (BBB), os ALs entram no sistema nervoso central (SNC) prontamente com peso molecular adequado, pKa e boa lipofilicidade. LAs com baixo peso molecular, alta lipossolubilidade e pKa apropriado, como lidocaína e procaína, mostram rápida mudança paralela de concentração no líquido cefalorraquidiano para a concentração plasmática da droga [19]. Porque LA-Na v a ligação do canal não é exclusiva, quando os LAs vazam para o sistema cardiovascular acidentalmente, os órgãos com perfusão sanguínea profusa e alta atividade do canal controlado por voltagem (Na, K, Ca), como o coração e o cérebro, serão atacados preferencialmente pelos LAs que lideram ao mau funcionamento de órgãos [20, 21]. Além da inibição da condução da excitação de órgãos vulneráveis, a depleção de energia devido à disfunção mitocondrial e apoptose também contribuem [15, 22].
Portanto, a toxicidade geral é resultado da concentração extracelular da droga, permeabilidade da membrana celular e reações tóxicas induzidas, o que pode explicar a toxicidade mais grave do SNC do derivado quaternário QX-314 em comparação com a lidocaína, embora QX-314 penetre BBB e membrana celular mais lentamente [ 23]. Em contraste com as apresentações do sistema nervoso central (convulsão e apreensão), que são mais comuns, mas relativamente mais fáceis de controlar, o mau funcionamento cardíaco, como distúrbio de condução, arritmia e disfunção contrátil, pode causar resultados fatais [6, 15]. A fim de prolongar o efeito analgésico dos ALs enquanto evita eventos adversos, muitos esforços foram colocados no desenvolvimento de ALs de liberação prolongada.
Formulação lipossomal de LAs de liberação estendida
Idéias gerais sobre lipossomas
O lipossoma é uma vesícula lipídica de escala nanométrica, que é baseada em fosfolipídios [10]. As técnicas lipossomais têm sido utilizadas há muito tempo na distribuição de drogas para o tratamento de doenças como câncer, infecção e doenças oculares. O lipídio tem uma cabeça hidrofílica e uma cauda hidrofóbica que estão ligadas por uma ligação éster ou éter [24]. Os lipossomas são produzidos pela agregação de unidades lipídicas em uma forma de bicamada, criando uma bainha aquosa e um núcleo com cabeças hidrofílicas, protegendo as caudas hidrofóbicas dentro das camadas. Da sonicação simples à técnica de espionagem seca mais sofisticada, abordagens inovadoras crescentes foram desenvolvidas com base em diversas combinações de sonicação, emulsão, pulverização a seco e foco de fluxo para produzir lipossomas com propriedades melhoradas (Fig. 2) [24,25, 26,27,28]. A hidratação de filme fino é uma das técnicas de produção mais comumente usadas, enquanto a técnica microfluídica é promissora para aumentar a escala [29]. Os medicamentos podem ser aprisionados de diferentes maneiras, incluindo carregamento passivo, carregamento ativo, carregamento antes do uso pelo paciente e emulsão dupla (Fig. 3). Finalmente, os medicamentos são transportados no núcleo aquoso ou entre as camadas de lipídios, dependendo da hidrofilicidade dos medicamentos (Fig. 4a). Esta compatibilidade generosa permite que os lipossomas sejam competentes na distribuição de vários medicamentos [24].
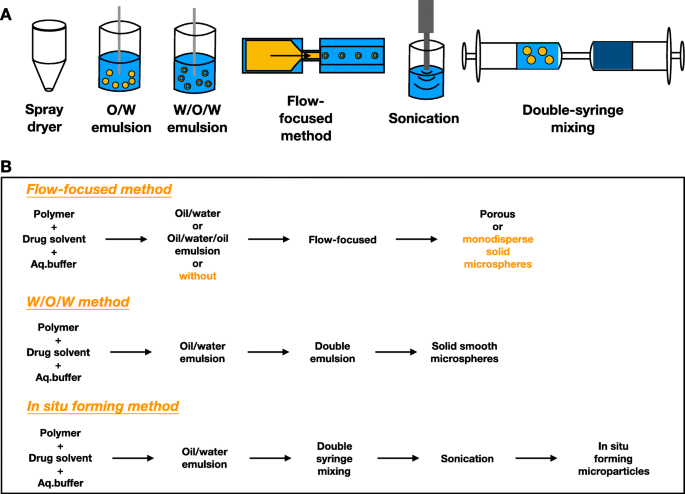
Técnicas clássicas de produção de lipossomas. a Técnicas básicas de produção de lipossomas. b Demonstrações de fluxo de trabalho de produção
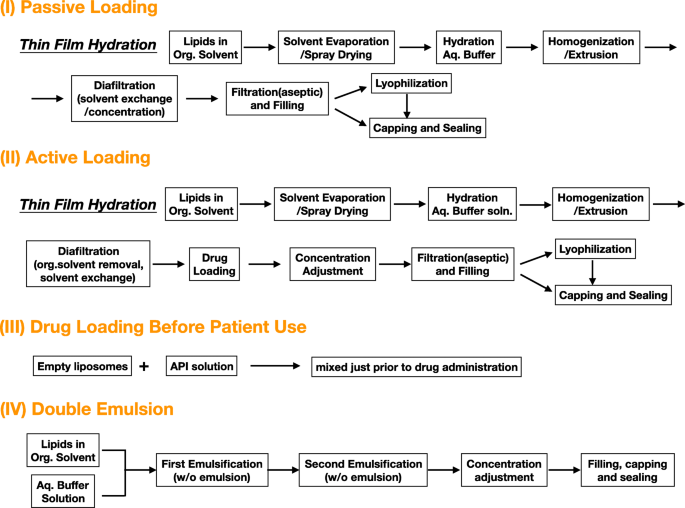
Várias vias de carregamento de drogas
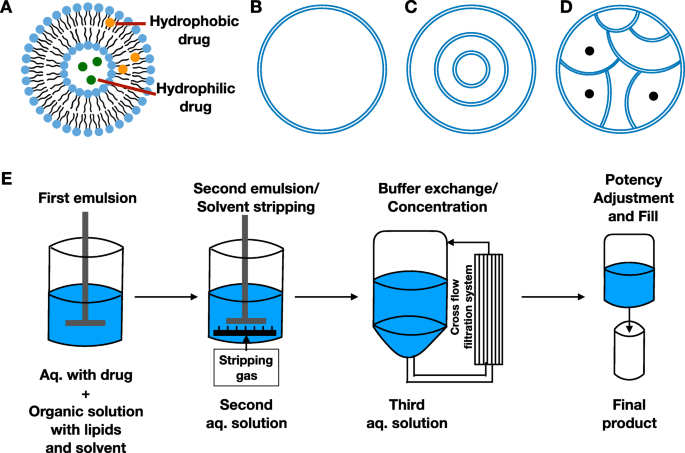
Características estruturais de diferentes lipossomas. a Distribuição de drogas em lipossomas. b Lipossoma unilamelar. c Lipossoma multilamelar. d Lipossoma multivesicular. e Demonstração da técnica DepoFoam
Vários fatores devem ser considerados ao construir um sistema de liberação controlada estável e eficaz. A composição lipídica é o fator básico e fundamental para a concepção de lipossomas. Em primeiro lugar, um sistema de suspensão estável deve ser garantido, o que significa que não ocorre agregação e fusão. A composição é o primeiro atributo. A carga superficial e a força eletrostática podem ajudar os lipossomas a se repelirem uns contra os outros para evitar a agregação [30]. No entanto, o ambiente de suspensão pode neutralizar a carga superficial para induzir a agregação. 1,2-Dipalmitoil-sn-glicero-3-fosfato (DPPA) e 1,2-distearoil-sn-glicero-3-fosfo- (1′-rac-glicerol) (DSPG) são dois lipídeos carregados negativamente pertencentes a fosfatidilserinas , que tendem a se agregar ao encontrar cátions de cálcio e magnésio [31]. Portanto, os lipossomas contendo maior proporção de lipídios carregados negativamente têm uma tendência maior de se agregar após a adição de cátions divalentes, o que pode ajudar a determinar a proporção de lipídios e a concentração de cátions na suspensão lipossomal. Com determinados componentes, o tamanho das partículas é outro atributo da agregação. Partículas maiores têm maior probabilidade de se agregar, apesar da carga líquida [30]. Além dos componentes iônicos, outro fator ambiental é a temperatura. A baixa temperatura colocará os lipossomas mais próximos, induzindo a agregação. Temperatura ligeiramente acima da temperatura de transição é recomendada para armazenamento [30, 32]. Outra estratégia para evitar a agregação é proteger os lipossomas da interação uns com os outros, sendo revestidos com polietilenoglicol (PEG). Essa molécula hidrofílica pode funcionar como uma bainha, não apenas para prevenir a agregação, mas também para ampliar as opções de modificação de superfície [33]. Com base nessa ideia, melhorias foram feitas para otimizar a proteção, como a adição de insulina e dextrana e bolaanfifila PEGuilada [34, 35]. A fusão precisa de mais força de atração, o que é menos comum de acontecer em comparação com a agregação, porque a força de repulsão de hidratação existe quando a força eletrostática está ausente [31]. E esta forma de força repulsiva pode ser fortalecida aumentando a proporção de fosfatidilcolina [30, 31].
Quanto à liberação controlada, a proporção diminuída de caudas de lipídios insaturados, mais lipídios de cadeia longa e ligantes de éter podem promover a estabilidade dos lipossomas e retardar a liberação. A inserção de colesterol e a decoração com moléculas como o PEG também podem estabilizar os lipossomas que podem ser classificados como híbridos, conforme descrito posteriormente na revisão. Essas modificações diminuem a fluidez e a biodegradação do lipossoma. A carga superficial e o tamanho das partículas são outras duas considerações. Os lipossomas de carga neutra e tamanho menor são depurados mais lentamente [24, 36]. O coeficiente de partição octanol / tampão é uma característica dos ativos que indicam a distribuição dos fármacos quando os lipossomas entram no ambiente fisiológico, o que também determina o padrão de liberação. Drogas como a bupivacaína com alto coeficiente de partição octanol / tampão podem ser facilmente liberadas [16, 36].
Os componentes não apenas influenciam as propriedades físico-químicas dos lipossomas, mas também influenciam as propriedades fisiológicas, como a especificidade dos tecidos. Quando os lipossomas entram na circulação sanguínea, a fagocitose por macrófagos é a principal via de eliminação. No entanto, diferentes reconhecimentos por macrófagos em sistemas reticuloendoteliais (RES) acontecem devido a diferentes processos de opsonização, dos quais composição lipídica, tamanho de partícula e carga superficial são determinantes vitais [37, 38]. Por exemplo, a ativação do sistema complemento determinada principalmente pelo colesterol é reconhecida pelas células de Kupffer ao redor da área portal no fígado, enquanto os fosfolipídios saturados aumentam o reconhecimento por macrófagos no baço e na medula óssea [39]. Partículas de diâmetro maior (~ 100 nm) são eliminadas preferencialmente por células de Kupffer [37, 38]. Além disso, o lipossoma carregado negativamente é reconhecido seletivamente pelo receptor necrófago na célula de Kupffer, enquanto os lipossomas neutros são mais indolentes [38]. A fagocitose ocorre rapidamente, enquanto o processo intracelular é lento, variando de horas a meses, o que resulta em retenção prolongada em RES [37, 38]. Essa retenção pode ajudar a direcionar o FER, ao mesmo tempo que dificulta a distribuição sistêmica. Várias estratégias foram desenvolvidas. A morfologia da filamicela pode limitar a acessibilidade dos locais de ligação entre os lipossomas e os receptores. Os lipossomas moles são menos preferidos pelos macrófagos. A estratégia furtiva por PEGylation e modificação de CD47 também pode passivar lipossomas [40]. A saturação de macrófagos (bloqueio de RES) por lipossomas extras é uma alternativa para estender a circulação de lipossomas carregados de drogas [41]. De uma forma mais agressiva, a depleção transitória de macrófagos pode ser realizada pelo clodronato.
Após escapar da depuração por macrófagos, os lipossomas apresentam boa biocompatibilidade e biodistribuição. Para tecidos com vasculatura elevada, perfusão sanguínea profunda e poros vasculares grandes, os lipossomas têm grande tendência para entrar. Os tecidos tumorais exibem todas as propriedades mencionadas acima. Com formação vascular aberrante e drenagem linfática, os lipossomas podem facilmente entrar e permanecer mais tempo nos tecidos tumorais, o que é chamado de permeabilidade e retenção aumentadas (EPR) [42, 43]. Além disso, os lipossomas com tamanho maior e carga positiva podem superar a alta pressão do fluido intersticial no centro do tumor e penetrá-lo completamente [42]. Além do direcionamento passivo por transporte de sangue e vantagens estruturais, o direcionamento ativo por modificação de superfície também é amplamente utilizado para otimizar a seletividade, como ligante do receptor do fator de crescimento epidérmico (EGFR) e ligante do fator de crescimento endotelial vascular (VEGF) para direcionamento do tumor, e ligante de transferrina e esfingomielina para penetração BBB [42, 44, 45].
Lipossoma multivesicular
Embalagens diferentes de vesículas lipídicas também podem ajudar a prolongar a liberação do medicamento. Normalmente, os lipossomas são concêntricos, onde as membranas lipídicas são empacotadas de forma multilamelar ou unilamelar (Fig. 4b, c) [16]. Portanto, o colapso da membrana lipídica interna levará ao acúmulo do fármaco e à rápida liberação após o rompimento da camada externa [46]. Nesta circunstância, a liberação sustentada não pode ser alcançada. Os lipossomas multivesiculares são não concêntricos, onde as vesículas estão compactadas umas às outras de fora (Fig. 4d). A emulsão dupla, também chamada de tecnologia DepoFoam, é usada na produção de lipossomas multivesiculares (Fig. 4e). Em relação à estrutura multivesicular, deve-se escolher pelo menos um lipídeo neutro (triglicerídeo) e um lipídeo anfipático (fosfolipídeo). A porcentagem de triglicerídeos está relacionada com a eficiência de carregamento da droga dentro de uma certa faixa [46, 47]. Ele atinge uma liberação mais longa por meio da degradação gradual das vesículas mais externas. A estrutura multivesicular permanece durante o rearranjo das vesículas internas, que é isolada por vesículas externas do ambiente externo para evitar a liberação de explosão [46, 48]. Os lipossomas multivesiculares mostram grande domínio na duração da liberação, que pode liberar o fármaco ao longo de vários dias a semanas por meio da administração não vascular em comparação com horas a dias por lipossomas unilamelares e multilamelares por via intravascular [46, 49].
Vantagem adicional
Em comparação com outros transportadores encapsulantes, os lipossomas podem possuir vantagens adicionais quando entregam LAs. Como é sabido por todos, a terapia de emulsão lipídica demonstrou sua eficácia em lidar com a toxicidade sistêmica de LAs e foi adicionada à diretriz de ressuscitação da toxicidade de LAs [50]. Os mecanismos potenciais incluem a liberação de LAs de Na v canais nas células do miocárdio, particionando e redistribuindo LAs para armazenamento (ácido graxo), desintoxicação (fígado) e órgãos de excreção (rim), fornecendo energia extra e aumentando os canais de Ca para fortalecer o débito cardíaco [51, 52]. Embora se presuma que os lipossomas liberem bupivacaína por meio de erosão e degradação, ocorre difusão simultânea através da membrana lipídica, o que pode manter a integridade dos lipossomas [16, 53, 54]. Há uma pesquisa descobrindo que uma grande fração de lipossomas pode reter sua estrutura multivesicular mesmo após a droga ser liberada quase completamente in vitro, indicando que a difusão pode dominar [46, 55]. Além disso, a formação de poros induzida por ultrassom pode ajudar a manter o tamanho e a estrutura dos lipossomas inalterados [56]. Portanto, pode-se supor que a bupivacaína possivelmente apresenta toxicidade diminuída na forma de lipossomas com proteção de lipídeos. Mais pesquisas e projetos de fabricação são necessários para confirmar e maximizar esse benefício.
Os lipossomas têm sido usados na distribuição de drogas dirigida ao cérebro devido à boa biocompatibilidade e lipofilicidade [57, 58]. Existem vários mecanismos de mediação da penetração através do BBB. A transcitose mediada por receptor ou absorção é a principal via de cruzamento da BBB [45]. A absorção é amplamente determinada pela atração eletrostática entre os lipossomas e a membrana celular carregada negativamente [45]. Quando os lipossomas são suficientemente pequenos, como os lipossomas unilamelares que abrangem as drogas lipofílicas, pode ocorrer a difusão passiva. As modificações também são projetadas para fortalecer a ligação ligante-receptor para facilitar a administração de drogas dirigida ao cérebro [57]. Portanto, designs reversos, como carga líquida negativa e falta de ligante específico de BBB, podem ajudar a prevenir a penetração no cérebro e aumentar a segurança.
EXPAREL-First Lipossomal LA aprovado
EXPAREL (Pacira Pharmaceuticals, Parsippany, New Jersey, EUA) é o único LA lipossomal de liberação prolongada aprovado pela American Food and Drug Administration (FDA). A suspensão de lipossomas é produzida pela tecnologia DepoFoam com tricaprilina que pertence a lípidos neutros e lípidos anfipáticos, incluindo 1,2-dipalmitoil-sn-glicero-3-fosfo-rac- (1-glicerol), 1,2-dierucoilfosfatidilcolina, e colesterol [47, 49]. É permitido legalmente em situações clínicas limitadas, incluindo infiltração de ferida que foi aprovada em 2011, e bloqueio do plexo braquial interescalênico em 2018. Pode atingir liberação prolongada e eficácia analgésica por até 72 h [5].
Comparado ao regime analgésico convencional, como injeção de AL livre, bomba de dor, analgesia epidural e analgesia controlada pelo paciente (PCA), o EAPAREL demonstrou sua potência analgésica não inferior quando usado por meio de infiltração na ferida. Além das indicações on-label, EXPAREL também tem mostrado papel promissor em outras vias analgésicas, como bloqueio do nervo intercostal, bloqueio do plano transverso do abdome (TAP) e bloqueio do gânglio satélite (Tabela 2). No entanto, existem pesquisas que mostram resultados negativos na potência analgésica do EXPAREL em relação à infiltração de feridas. Essas pesquisas são diferentes em cirurgias de distintas intensidades de dor, também nos momentos de avaliação da dor, que são relativamente anteriores, como 12 h. As cirurgias ortopédicas geralmente causam dor intensa no paciente, portanto, a infiltração de EXPAREL em um único ferimento pode ser insuficiente para controlar a dor. Comparado à bupivacaína pura, EXPAREL pode não liberar bupivacaína adequada no momento inicial e não pode ser coadministrado com ALs livres adicionalmente para obter melhor analgesia (Tabela 3). Portanto, o efeito analgésico de EXPAREL pode depender do tipo de cirurgia, da intensidade da dor e do início analgésico esperado.
Apesar da controvérsia na analgesia, a via de administração de EXPAREL é mais simples e segura em comparação com a inserção do cateter, bloqueio do nervo e analgesia peridural [62, 75, 76]. Em modelos animais, EXPAREL não induz neurotoxicidade (redução da concentração neuronal ou desmielinização) após injeção peri / intraneural ou subaracnóide [77,78,79]. Mas a inflamação regional induzida por EXPAREL no local da injeção é maior em comparação com a bupivacaína HCl convencional, mas semelhante à solução salina [78]. No geral, EXPAREL mostra toxicidade semelhante com bupivacaína livre [80,81,82,83]. O custo médico com EXPAREL diminui ainda mais em comparação com analgesia peridural [63, 84] e bomba contínua [60], mas o custo é maior do que a injeção simples de ALs [85,86,87,88]. Portanto, a utilização de EXPAREL precisa de considerações abrangentes, incluindo diferentes requisitos de analgesia esperada em diferentes cirurgias e relação custo-benefício.
Atenções
EXPAREL tem uma restrição óbvia de aplicação devido à fluidez e rearranjo das camadas lipídicas. A liberação rápida de bupivacaína com o uso adicional de ALs livres, especialmente em 20 minutos, ocorrerá devido à reposição de bupivacaína nos lipossomas [89]. Nessa circunstância, a incidência de toxicidade sistêmica da anestesia local (LAST) aumentará dramaticamente. A lidocaína mostra especialmente uma afinidade mais forte com o DepoFoam, induzindo uma maior exposição sistêmica da lidocaína e da bupivacaína quando coadministrada com EXPAREL em 20 min. No entanto, o risco de liberação rápida não se deve apenas à substituição, mas também aos efeitos vasculares dos ALs e vasoconstritores usados e aos efeitos de diluição / mistura. Portanto, o tempo além de 20 minutos garante um nível seguro de EXPAREL e LAs livres [90]. Quanto à bupivacaína HCl, uma mistura com EXPAREL é permitida em uma proporção inferior a 1:2 para garantir a liberação segura e sustentada [5, 49]. Uma vez que a analgesia é uma cooperação multidisciplinar, deve-se prestar muita atenção ao administrar EXPAREL. Além disso, todos os produtos lipossomais têm um problema de armazenamento que é descrito como instável "na prateleira". Os lipídios serão degradados em metabólitos prejudiciais durante um longo período de armazenamento. O excesso de lisolipídeos e outros resíduos lipídicos se ligam aos glóbulos vermelhos, resultando em hemólise mortal. Ser revestido com quitosana ou alginato pode superar esse problema ao estabilizar o lipossoma e estender a conservação por até 2 anos [24, 36].
Mais inspirações
Esforços de outros pontos também são feitos para melhorar a eficácia analgésica da bupivacaína lipossomal. Christopher Weldon et al. aumento da interação célula-bupivacaína lipossomal por meio da redução do tamanho específico para dez vezes menor, prolongando sua retenção regional, que alcançou anestesia mais longa e qualidade de segurança semelhante em comparação com a bupivacaína lipossomal regular em bloqueio de Bier [91]. Changyou Zhan e seus colegas combinaram nanobastões de ouro e lipossomas para obter anestesia fototrigeada. Este sistema foto-reativo minimiza a dose única necessária de luz infravermelha próxima e exibe segurança satisfatória. Mais importante, atinge anestesia regional sob demanda e repetida, o que tornará o controle da dor mais individualizado e preciso [92]. Alternativamente, fortalecer a interação de LAs e lipídios com evidências de que LAs tem afinidade diferente com diferentes lipídios [93] e encapsular lipossomas com alginato para aumentar a reação antiinflamatória de células estromais mesenquimais [94], pode melhorar ainda mais a liberação controlada e atender a diferentes demandas clínicas.
Formulação polimérica de LAs de liberação estendida
Conhecimento básico em DDS polimérico
Polímeros são macromoléculas que consistem em milhares de unidades repetidas (monômeros). Ao contrário dos lipossomas, onde a força de Van der Waals e as ligações de hidrogênio desempenham papéis importantes, os polímeros são formados por ligações covalentes, que fornecem melhor estabilidade não apenas na prateleira, mas também quando coadministrados com LAs livres. Grande grupo de polímeros biocompatíveis e biodegradáveis tem sido usado na fabricação de material de liberação prolongada, não apenas natural, mas também sintético. Considerando as diferentes propriedades químicas dos LAs de amida e éster, os métodos de carregamento corresponsivo podem ser usados para otimizar a eficiência do carregamento (interação eletrostática, conjugação covalente e encapsulamento) [8]. Além disso, morfologias flexíveis como nanopartículas, nanocápsulas, nanogéis, nanofilmes e nanofibras expandem a aplicação de DDS polimérico na prática quando a injeção, curativo ou filme é necessário [7, 8]. Além disso, as modificações estruturais capacitam o perfil de liberação ajustável de DDS polimérico, como dias para dor perioperatória, semanas para dor crônica e co-entrega com uma segunda droga para aumentar a eficácia dos LAs [7].
Entre os polímeros sintéticos mais usados estão os poliésteres. Esta categoria inclui poli (l-lactídeo), poli (ácido glicólico), poli (ácido lático-co-glicólico) e poli (e-caprolactona) [95]. Os metabolitos são geralmente moléculas pequenas, como dióxido de carbono e água, que podem ser reciclados ou excretados com segurança [96]. Por outro lado, as técnicas de produção evoluíram muito a partir das tradicionais, como emulsão dupla / única, precipitação e secagem por pulverização, para a plataforma microfluídica, extrusão e replicação de partículas em molde não úmido (PRINT) (Fig. 5a-g). Novas técnicas, como eletrofiação, também são desenvolvidas para permitir flexibilidade na formulação e entrega (Fig. 5h) [95, 96].
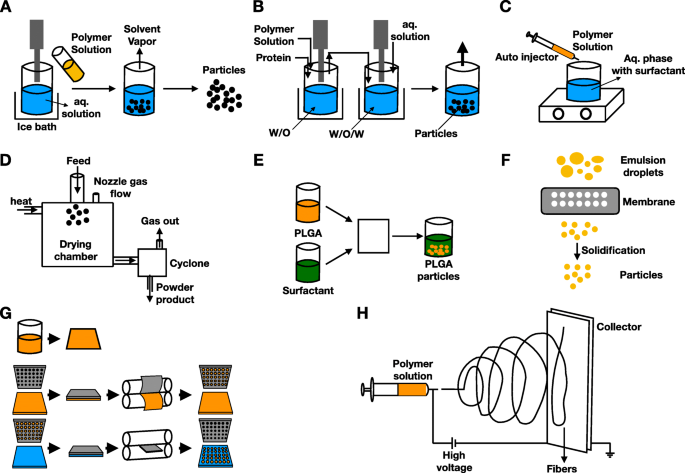
Técnicas clássicas de polymersomes. a Emulsão única. b Emulsão dupla. c Nanoprecipitação. d Secagem por pulverização. e Microfluídica. f Emulsificação por extrusão. g Replicação de partículas em molde não úmido (PRINT). h Electrospinning
Existe outro método de produção, a automontagem, que não tem sido amplamente utilizado na distribuição de medicamentos, mas pode iluminar o caminho futuro do DDS. A automontagem difere de outros procedimentos de produção por montagem espontânea em micelas de copolímeros de agente polimérico anfifílico em ambiente aquoso. Portanto, ele exibe simplicidade, alta eficiência e boa dispersibilidade em água [97, 98]. Os copolímeros podem ser formados por meio de uma variedade de reações, como reação multicomponente em um único recipiente (reação mannish entre amida secundária e composto de hidrogênio ativo que são ligados por formaldeído) [97, 99], reação supramolecular (interação hospedeiro-hóspede, como ciclodextrina e adamantina) [100, 101], esterificação e reação de anel aberto [102,103,104], reação de clique com tiol-ino [105] e pós-modificação de copolímeros [106]. Embora esta técnica seja usada principalmente em partículas poliméricas fluorescentes recentemente para ajudar a proteger da extinção de fluorescência e atingir a emissão induzida por agregação, diversas reações e interações tornam possível que diferentes drogas hidrofóbicas possam encontrar polímeros responsivos (especialmente polímeros orgânicos) para se automontar em micelas [107, 108]. Por exemplo, a amida secundária em LAs de amida pode ser usada como porção ativa que reage com polímeros por reação humana. Alternativamente, as drogas podem ser absorvidas em copolímeros para obter imagens e tratamento simultâneos [101]. Uma vez que as drogas hidrofóbicas são encapsuladas no núcleo das micelas, isso pode fornecer um ambiente interno adequado para a eficácia da droga, como um ambiente alcalino para LAs. Enquanto isso, o comportamento de grande captação celular pode aumentar as drogas que têm como alvo os domínios intracelulares, como os LAs [97, 100, 105]. Além disso, as reações são geralmente isentas de catalisador / simples (como micro-ondas e ultrassom) [109, 110], econômicas com solvente, moderadas em condições experimentais e que economizam tempo, o que possibilita sua produção em massa no futuro [97, 105 ]
O DDS polimérico libera agentes ativos por várias vias. Quando a água flui em polímeros no início, a convecção cria uma força osmótica bombeando drogas para fora. No entanto, a difusão através dos poros formados em meio aquoso é o caminho principal. Ajuda as drogas hidrofílicas, como os LAs ionizados, a vazar. Ao contrário, as drogas hidrofóbicas podem se difundir diretamente. No estágio final de um perfil de liberação trifásico típico, a erosão do polímero domina [111, 112].
Como os lipossomas, os polimerssomas também enfrentam o desafio da depuração de RES. Morphology modification, stealth strategy, RES blockade, and macrophage depletion can be applied as well [40, 113,114,115]. Furthermore, the EPR effect facilitate tumor-target while auxiliary surface modification can help tissue specificity [43, 116]. Polymersomes do not induce significant systemic inflammation while some of natural polymers such as hyaluronan and laminin, and synthetic polymers such as negatively charged poly(lactic-co-glycolic acid) and polyurethane can reduce systemic inflammatory reaction [117,118,119]. Moreover, N -(2-hydroxypropyl) methacrylamide and polystyrene are reported to reduce neurotoxicity [120, 121].
Diverse Morphology and Applications
Particle is a common form of polymeric DDS. Polymeric particles are generally divided into two categories:nanosphere and nanocapsule. Nanosphere is an evenly disperse system, while nanocapsule is an embedding drug in polymeric cavity [95]. The earliest researches built nanoparticles with poor entrapment efficiency (< 60%) and release duration (< 30 h) [122, 123]. With finesses of technology, the drug entrapment efficiency reaches nearly 90% [124,125,126], the highest result is 93.3% [127]. In-vitro release can reach a maximal duration of 35 days [128]. There is another available form termed nanofiber, which is produced by electrospinning. Electrospinning technique has been widely applied in drug delivery, but limited usage in LAs. There is one research only using electrospinning technique to fabricate bupivacaine-loaded suture. It gained satisfactory results on extended release (over 12 days), while significant analgesia appeared from day 1 to day 9 in rat skin wound model [129]. Mostly in polymersomes, drugs are entrapped physically; in polymer-drug conjugate, drug is bonded to polymer covalently to enhance drug loading capacity and prolong release furthermore [130]. Apart from solid forms, amorphous forms such as gel show more versatility and malleability. A 60-day release was seen in the work of Daryl Sivakumaran and his colleagues (Table 4) [134]. Rapid burst release over 60% of LAs was observed in the work of Haibo Qu and his colleagues (Table 4) [135].
In order to make the release intelligent, responsive materials are used in situations where structural changes, volume-phase transitions, or sol-gel transitions are needed [137]. Inflammatory reaction is a major and initial process when trauma happens. Along with it is the changes of pH and temperature. Thus, pH and temperature are stimuli used commonly in LAs delivery. In the work of Todd Hoare and his colleagues, thermal aggregation can help control regional accumulation of thermal-responsive nanogel. However, larger precipitates after aggregation induced more severe local inflammation (Table 5) [139]. Teresa Alejo and his colleagues used sequential heat pulse to trigger the collapse of nanoparticle, fastening profound release in a spatiotemporal way (Table 5) [138]. A pH-responsive polymer (methacrylicacid–ethyl acrylate) was used by Jeremy P.K. Tan to achieve decreased release of procaine chloride with decrease of pH (Table 5) [140].
Despite the advantages of being responsive to stimuli, pH and temperature-responsive polymers do not act precisely enough to localize therapeutic agents. Moreover, acidic environment and high temperature may bring harm. Therefore, stimuli which are able to modulate therapeutic agents precisely without harm are wanted. Although there is no application so far in LAs delivery, ultrasound-responsive nanoparticles exhibiting harmless property have shown precise localization in tumor targeting and imaging [141, 142]. However, ultrasound signal can be influenced by air attenuation and bone structure. Magnetic responsive nanoparticles exhibit broader application such as in respiratory system which is filled with air and central nervous system covered with cranial bone [143]. Furthermore, magnetic responsive nanoparticles can help spatially and temporally localize actives without restriction by tissues depth [143]. Generally, there are three mechanisms underlying magnetic response, which are magnetic deformation, magnetic guidance, and magnetic-induced hyperthermia [144, 145]. Aginate-based ferrogel undergoes pore formation with magnetic stimulation [146]. In contrast, chitosan-based nanoparticle undergoes pore formation with the help of heat produced by magnetic field [147, 148]. In order to decrease thermal damage to surrounding tissues, Wei Chen and his colleagues produced a core-shell structure to embed heat-producing core and prevent thermal damage [143]. The guidance function can help the nanoparticle migrate long distance and penetrate biological barrier [149]. Combination of aforementioned mechanisms can create synergistic outcomes [150].
Polymeric carriers endow LAs extended-release, but unexpected burst release does exist. Long-term degradation may induce foreign body response. Versatility of materials and mature techniques are advantages of polymeric carriers. Acidic metabolites, however, may hamper the effect of LAs. Although responsive polymers make delivery more intelligent, they do not solve the aforementioned problems above completely. Therefore, further improvements are needed.
Lipid-Polymer Hybrid Carriers of Local Anesthetic
Liposomal and polymeric nanocarriers both have drawbacks such as low solubility, poor stability, undesired drug leakage. and diffusion [151,152,153]. Conventional liposomes are easily cleared out by enzymatic degradation and macrophage engulfing. Therefore, surface modification with inert and hydrophilic coats, such as PEG, ganglioside GM1, and phosphatidylinositol, have been used for protection against degradation by enzymes and macrophages. Furthermore, pegylation can enhance the negative charge of liposome and reinforce its attraction to cationic actives. In the work of Brett A. Howell and his colleagues, higher concentration and slower release of bupivacaine in human serum was observed in pegylated liposomes compared to conventional liposomes [154]. Alternatively, apolar cavity of biologically active compounds formed by cyclodextrins (a polymeric peptide), also known as an inclusion, in multi-vesicular liposomes can help achieve longer release. Inspired by various pioneer attempts to overcome drawbacks of liposome and polymeric nanoparticles, lipid-polymer hybrid nanoparticles come to the stage of controlled release [151, 155].
There are three systems of hybrid nanoparticles:lipid-core polymer-shell, polymer-core lipid-shell, and the polymer-lipid matrix. Lipid-core polymer-shell system using a polymeric coat improves the stability of liposome and delays clearance, while maintaining optimal biocompatibility of lipid core. The amphiphilic properties of some polymers can reduce surface tension of nanoparticles and decrease particle size to achieve better biocompatibility. Additionally, responsive polymers can enable liposomes more flexible behavior in various physical environment [152, 156]. Poly (acrylic acid) (Chol-PAA) is a pH-sensitive polymer, which tends to form globular structure from random coil in low pH. In poly (acrylic acid) (Chol-PAA)-caged liposome, the polymeric coat shrinks when environmental pH decreases, compressing core liposome to release significantly when liposome collapses [152]. Marina Sokolsky-Papkov and her colleagues used hybrid polymer (DL-lactic acid and castor oil) to formulate bupivacaine-loaded nanoparticles. This poly (fatty-ester) achieved relatively longer in-vitro release (beyond 1 week) and sensory blockade (> 72 h) compared to previous research [157]. Further research confirmed its release profile and extended its analgesic efficacy among thermal pain, mechanical pain, and rearing assessment [158]. Another research study explored the difference between oil nucleus on stability, release profile, and analgesia property, and found that a higher entrapment efficacy was observed compared to polymeric DDS [159].
Polymer-core lipid-shell system is commonly used in intravenous administration of drugs, especially anticancer drugs [151, 155]. The two components together help inhibit water infiltration and slow hydrolysis down, and as a result prevent drug diffusion and burst leakage. Lipid shell also enhances biocompatibility of nanoparticle with similarity to cell membrane [160]; this is promising in achieving simultaneous co-delivery of multiple drugs [151, 152, 160]. On the other hand, polymeric core can facilitate mechanical stability, shape control, and size distribution. Additionally, it can increase drug entrapment efficacy. In the work of Jianguo Wang and his colleagues, nanoparticle showed a slower release speed, smaller particle diameter, and higher drug loading compared to traditional liposomes [161]. The work by Pengju Ma at el. showed that hybrid bupivacaine nanoparticle had better stability, analgesic efficacy, and cytotoxicity [162].
The third system is a polymer-lipid matrix which can be subdivided into polymerized liposomes and nano-in-micro type. As their names suggest, polymerized liposome is a covalently bound liposome which demonstrates better stability and modulated release as mentioned above with basic knowledge on polymeric DDS [154], while the nano-in-micro system gathers nanoparticles into a matrix to achieve controlled release as shown in the work of Khanal Manakamana and his colleagues [163]. Moreover, hybrid nanoparticle was used in transdermal route showing better skin permeation than free bupivacaine in three studies by Yaocun Yue and Aimei Li at el., which expands its clinical application of analgesia [161, 164, 165].
Future Perspectives
Nano-structured systems have been utilized in extended-release for drug delivery over decades. Tremendous breakthroughs have been seen in controlled release of LAs to achieve longer duration of analgesic and better safety profile, bringing in the successful approval of EXPAREL. At the same time, various modifications and combinations of nano-structured systems have broaden the horizon of LAs. With the guidance of physical or chemical stimuli, targeting LAs to treat the specific sources of pain may not be a difficult process anymore. Additionally, with the help of external and internal stimulus, we may modulate the release profile of LAs even after administration. Physiochemical properties of actives, rather than carriers alone, are also taken into account to formulate new and flexible systems. In the future, we may see precisely designed extended-release LAs to meet different demands of analgesic intensity, duration, and target sites in distinct surgeries, to make analgesia more individualized.
Conclusions
LAs are key components in multimodal analgesia. Short duration and adverse side effects limit its application, which induces the emergence of extended-release LAs. Nano-structured DDSs show better biocompatibility and biodegradation compared to micro-structured DDSs due to similar size with physiological environment. Among various nanocarriers, liposomes achieve the first success in super-long-lasting LAs, which can release bupivacaine for 72 h in vivo. Liposomes also potentiate the safety of LAs with the protection of emulsion. The instability of liposome, however, hinders its storage and co-administration profile with additional free LAs. Compared to liposome, polymersome has a more advantageous profile with better stability and prolonged release. Moreover, the electrospinning technique and the stimuli-responsive property endow polymersomes with more flexibility in morphology and release behavior. Besides the optimization of materials and manufacturing processes, combination of nanocarriers is an alternative way to improve drawbacks and boost strengths. This is where hybrid nanocarriers come to the stage:hybrids not only improve the release profile but also broaden administration routes, such as the transdermal route. With the ever-emerging versatility of nanocarriers, extended-release may become more specific and controllable in the future to satisfy various analgesic demands.
Disponibilidade de dados e materiais
Not applicable.
Abreviações
- BBB:
-
Blood-brain barrier
- CNS:
-
Central nervous system
- DDSs:
-
Drug delivery systems
- DPPA:
-
1,2-Dipalmitoyl-sn-glycero-3-phosphate
- DSPG:
-
1,2-Distearoyl-sn-glycero-3-phospho-(1'-rac-glycerol)
- EGFR:
-
Epidermal growth factor receptor
- EPR:
-
Permeabilidade e retenção aprimoradas
- FDA:
-
American Food and Drug Administration
- LAs:
-
Local anesthetics
- LAST:
-
Local anesthesia systemic toxicity
- PCA:
-
Patient controlled analgesia
- PEG:
-
Polietileno glicol
- PRINT:
-
Particle replication in nonwetting template
- RES:
-
Reticuloendothelial system
- TAP:
-
Transversus abdominis plane
- VEGF:
-
Vascular endothelial growth factor
Nanomateriais
- A visibilidade da produção em tempo real de 5 maneiras melhora suas operações de AM
- Variáveis globais, locais e não locais do Python
- Os fabricantes impulsionam mais avanços no flash 3D NAND
- Monitorando os avanços do dispositivo médico
- Os 10 principais avanços na tecnologia de fabricação de compósitos
- Escopo variável em C++
- Java 10 - Inferência de tipo de variável local
- Guiando a indústria:avanços em AGVs
- Descoberta Local OPC UA
- Oficina de Máquinas Local



