Nanobolhas de quitosana biocompatíveis para entrega dirigida de doxorrubicina mediada por ultrassom
Resumo
A entrega de nanobolhas (NBs) direcionada por ultrassom tornou-se uma estratégia promissora para a entrega de medicamentos não invasivos. A biossegurança e a capacidade de transporte de fármacos dos RNs têm sido um hotspot de pesquisas, principalmente no que se refere aos RNs com quitosana, devido à sua biocompatibilidade e alta biossegurança. Uma vez que a capacidade de transporte do fármaco dos RNs com quitosana e o desempenho da administração de fármacos assistida por ultrassom permanecem obscuros, o objetivo deste estudo foi sintetizar RNs de quitosana biocompatíveis carregados com cloridrato de doxorrubicina (DOX) e avaliar sua capacidade de entrega do fármaco. Neste estudo, a distribuição de tamanho dos RNs de quitosana foi medida por espalhamento dinâmico de luz, enquanto sua capacidade de carga de fármaco e liberação de DOX mediada por ultrassom foram determinadas por um espectrofotômetro de UV. Além disso, um sistema de imagem de ultrassom clínico foi usado para avaliar a capacidade dos RNs de quitosana em obter aprimoramento de imagem, enquanto o perfil de biossegurança dos RNs de quitosana livres foi avaliado por um ensaio de citotoxicidade em células MCF-7. Além disso, a captação de DOX mediada por NB e a apoptose de células Michigan Cancer Foundation-7 (MCF-7) foram medidas por citometria de fluxo. Os resultados mostraram que os RNs carregados com DOX (DOX-NBs) exibiram excelente capacidade de carregamento de fármacos, bem como a capacidade de obter aprimoramento ultrassônico. A irradiação de ultrassom (US) promoveu a liberação de DOX de DOX-NBs in vitro. Além disso, DOX-NBs efetivamente entregou DOX em células cancerosas de mamíferos. Em conclusão, quitosana NBs biocompatíveis são adequados para entrega de DOX direcionada por ultrassom e são, portanto, uma estratégia promissora para entrega de droga não invasiva e direcionada digna de investigação adicional.
Histórico
A quimioterapia é atualmente usada como a modalidade de tratamento primária para neoplasias malignas e melhora substancialmente a taxa de sobrevivência de pacientes com câncer. No entanto, a eficácia dos quimioterápicos é restringida por seus efeitos colaterais adversos, como a toxicidade sistêmica [1]. A distribuição local de drogas quimioterápicas pode reduzir sua toxicidade, aumentando sua dose terapêutica em locais-alvo e diminuindo os níveis plasmáticos de drogas circulantes. Devido à sua não invasividade e capacidade de direcionamento, a destruição de nano / microbolhas direcionada por ultrassom (UTN / MD) tem sido amplamente utilizada como um sistema de distribuição de drogas eficaz.
Em comparação com as microbolhas tradicionais, as partículas nanométricas podem cruzar a parede capilar com mais facilidade e, portanto, podem ser distribuídas ao local de destino com mais eficiência. RNs têm sido usados no estudo de terapia direcionada, como RN carregados com 5-fluorouracil testados para uso em carcinoma hepatocelular [2]. Shen et al. recentemente usaram RNs mediados por ultrassom para entregar resveratrol às células do núcleo pulposo [3], e RNs também têm sido usados no tratamento do câncer de mama [4].
As nanobolhas (NBs) utilizadas em UTN / MD são geralmente compostas por um núcleo de gás e uma casca estabilizada. Lipídios, surfactantes, polímeros ou outros materiais são usados na composição da casca. Diferentes tipos de RNs foram feitos em estudos anteriores. No entanto, muitos dos produtos químicos usados para formar NBs ou nanopartículas representam uma ameaça potencial ao corpo humano. Consequentemente, o transporte de algumas nanopartículas tem trazido eficácia terapêutica insatisfatória e toxicidade em células e tecidos normais [5]. Agentes químicos, como Tween 80 e glutaraldeído, apresentam alta toxicidade e riscos mutagênicos, restringindo suas aplicações clínicas [6, 7]. O PLA, outro material utilizado em RNs, pode causar efeitos colaterais clínicos em alguns casos [8]. Nesse contexto, é importante considerar a biocompatibilidade e segurança dos materiais utilizados na montagem dos RNs.
O polissacarídeo quitosana tem chamado a atenção por sua origem natural, biodegradabilidade, biocompatibilidade, imunogenicidade excepcionalmente baixa, atividade antibacteriana e praticidade [9, 10]. A quitosana é o derivado N-desacetilado da quitina, que é um dos materiais biológicos mais abundantes na Terra [11]. Além disso, um estudo anterior mostrou que, na presença de IFN-γ, os oligômeros de quitosana solúveis em água podem ativar macrófagos para matar células cancerosas [12]. Portanto, a própria quitosana tem efeitos antitumorais diretos e indiretos, tornando-a mais adequada como um carreador de drogas anticâncer. Os outros materiais que utilizamos em nossos RNs foram a lecitina e o ácido palmítico, excelentes candidatos para uso em RNs [13]. O ácido palmítico é um dos mais abundantes dos ácidos graxos saturados de 14, 16 e 18 carbonos e é normalmente sintetizado por acetil-CoA e possui baixa toxicidade e alta biocompatibilidade [14]. A lecitina é um surfactante nativo derivado principalmente da soja [15]. Pesquisas anteriores mostraram que a lecitina de soja apresenta benefícios para a saúde por causa de suas propriedades hipocolesterolêmicas. Por exemplo, a lecitina de soja é útil na redução do risco de doenças cardiovasculares, enquanto a soja purificada pode ser usada para encapsular a nisina [16, 17]. Neste estudo, utilizamos os materiais acima para confeccionar RN biocompatíveis. Com a ajuda de ultrassom para entrega, o cloridrato de doxorrubicina (DOX) foi usado como um medicamento modelo para testar a capacidade de carga de drogas dos novos RNs de quitosana biogênica, que foram funcionalizados antes da avaliação em humanos Michigan Cancer Foundation-7 (MCF- 7) células de câncer de mama. Além disso, os efeitos antitumorais de DOX-NBs também foram avaliados após UTN / MD.
Materiais e métodos
Materiais
Os NBs descritos neste estudo foram construídos usando perfluoropropano (C3F8, Centro de R&D para Gases Especiais do Instituto de Pesquisa de Engenharia Física e Química da Indústria Nuclear, Pequim, China) como núcleo e um revestimento de quitosana como casca. Além disso, Epikuron 200 (lecitina de soja contendo 95% de dipalmitoilfosfatidilcolina, Lukas Meyer, Hamburgo, Alemanha), etanol (grau analítico, Hushi, China), cloridrato de doxorrubicina (Sigma-Aldrich, Missouri, EUA), quitosana (100 ~ 300 kD , Bozhihuili, Qingdao, China) e ácido palmítico (JINDU, Shanghai, China) também foram usados neste estudo. O Pluronic F68 foi adquirido à Sigma-Aldrich (St. Louis, MO, EUA).
Linha celular
A linha celular de carcinoma de mama humano MCF-7 foi obtida da American Type Culture Collection (Rockville, MD, EUA) e cultivada em meio Eagle modificado por Dulbecco (DMEM) suplementado com 10% de soro fetal bovino inativado por calor (FBS) (Gibco, Carlsbad , CA, EUA). As células foram cultivadas sob 37 ° C, 5% CO 2 e 95% de umidade. As células na fase de crescimento logarítmico foram colhidas para experimentos.
Preparação de NBs de quitosana carregados com DOX
Fizemos RNs de acordo com métodos previamente descritos [18, 19]. Quitosana de peso molecular médio (100 ~ 300 kD) foi usada para os invólucros do DOX-NBs, e perfluoropropano foi usado para o núcleo. Para preparar a solução de DOX-quitosana, a dose apropriada de DOX foi dissolvida em água ultrapura e 2 ml de solução de DOX (1 mg / mL) foram adicionados à solução de água de quitosana por mistura com um misturador de vórtice por 5 s. A solução de DOX-quitosana foi incubada por 1 h a 65 ° C. Separadamente, uma solução de etanol contendo Epikuron 200 foi adicionada a uma solução aquosa de ácido palmítico. Depois de adicionar o volume apropriado de água ultrapura, o sistema ácido palmítico-Epikuron 200 foi homogeneizado usando um misturador de vórtice. Posteriormente, o sistema ácido palmítico-Epikuron 200 foi dividido em tubos Eppendorf de 1,5 mL (tubos EP), e o ar do tubo foi substituído por perfluoropropano por meio de seringa de 10 mL com agulha longa e fina. Cada tubo foi oscilado por 120 s em um oscilador mecânico (misturador Ag e Hg, Xi’an, China). Em seguida, todo o líquido nos tubos de EP de 1,5 mL foi vertido em um tubo de centrífuga e combinado com a solução de DOX-quitosana em um banho de gelo. Subsequentemente, a mistura foi incubada durante 30 min a - 4 ° C. Em seguida, uma solução aquosa de Pluronic F68 (0,01%, w / w ), um agente de estabilização, foi adicionado à mistura acima enquanto se agitava. Uma etapa de purificação de diálise (tubo de centrifugação de ultrafiltração, Millipore, 30 kDa) foi então realizada para remover qualquer DOX livre residual.
Observação das propriedades físicas dos RNs
A suspensão de DOX-NBs foi diluída pela adição de uma quantidade apropriada de PBS (solução salina tamponada com fosfato). A forma de DOX-NBs foi então observada e fotografada em um microscópio de fluorescência equipado com lentes objetivas de imersão em óleo × 100 (OLYMPUS BX41, Olympus Corporation, Japão). As imagens de fluorescência foram avaliadas usando um microscópio de fluorescência (Nikon TE2000-S, Japão). A morfologia do DOX-NBs também foi observada por microscopia eletrônica de transmissão (TEM) (JEOL, Tóquio, Japão). As suspensões aquosas das nanobolhas diluídas foram pulverizadas em grade de cobre revestida com Formvar e coradas com 4% w / v acetato de uranilo durante 10 min. Em seguida, as amostras foram visualizadas e fotografadas usando TEM. O tamanho e o potencial zeta de superfície dos DOX-NBs foram medidos por um analisador de potencial zeta e tamanho de partícula Delsa Nano C (Beckmann Instruments, EUA). Todas as medidas foram realizadas em triplicata para calcular o valor médio.
Estabilidade de DOX-NBs
O tamanho e a morfologia dos DOX-NBs foram medidos ao longo do tempo para observar a estabilidade dessas nanobolhas. Algumas partes dos DOX-NBs foram armazenadas em refrigerador a 4 ° C por 24 h ou 48 h. Os demais foram mantidos em temperatura ambiente por 6 h. A estabilidade das nanobolhas a 25 ° C também foi investigada em soro humano liofilizado (Seronorm ™ Human, Noruega). Para tanto, 1 mL da suspensão aquosa de DOX-NBs foi adicionado a 1 mL do soro e incubado por 6 h a 25 ° C. Em seguida, todos os DOX-NBs foram medidos por análise morfológica em microscopia óptica para avaliar a integridade de suas estruturas. O tamanho dos RNs foi medido por um analisador de tamanho de partícula e potencial zeta Delsa Nano C (Beckmann Instruments, EUA).
Determinação da capacidade de carga de DOX dos NBs
Uma curva padrão de concentração de DOX foi preparada usando diluições seriadas de DOX nas concentrações de 0,025, 0,05, 0,1 e 0,2 mg / mL e medida usando um espectrofotômetro de UV (UV-2450, SHIMADZU). Posteriormente, a eficiência de carregamento de DOX foi avaliada em 480 nm usando NBs em branco como controle, e a concentração de DOX em DOX-NBs foi calculada com base na curva padrão estabelecida acima. Para evitar a fotodegradação de DOX durante o processo de purificação e medição, todos os procedimentos foram realizados protegidos da luz. Posteriormente, a suspensão de DOX-NBs foi liofilizada por 1,5 dias com um liofilizador a -55 ° C e sob 0,080 mbar [20]. Os DOX-NBs liofilizados foram então pesados para calcular a capacidade de carga da droga em termos de eficiência de encapsulação da droga (EE) como segue:EE = A / B × 100%, onde A é a quantidade de DOX carregada em NBs, e B é a quantidade inicial de DOX na solução. Os experimentos foram repetidos três vezes.
Versão DOX mediada por ultrassom
A cinética de liberação in vitro de DOX dos DOX-NBs foi determinada na presença e ausência de ultrassom (US) pela técnica de bolsa de diálise a 37 ° C. Os DOX-NBs foram encerrados em uma membrana de diálise (Spectra / Por, ponto de corte 12.000–14.000 Da), que foi colocada em um recipiente de 100 ml de PBS com agitação a 100 rpm. O grupo US foi sonicado por US (VCX400, Sonics and Materials, EUA; densidade de potência, 1,0 W / cm2; frequência, 20 kHz) por 40 s antes do teste [21]. A liberação de DOX foi medida por até 24 horas, retirando 1 ml em cada tempo fixo e substituindo por 1 ml de PBS fresco. As concentrações de DOX no tampão externo foram medidas a 480 nm por um espectrofotômetro de UV. Os experimentos de liberação foram realizados em triplicata.
Imagem de ultrassom in vitro (curva de intensidade de tempo)
A imagem dos EUA e a estabilidade de DOX-NBs sob ultrassom foram verificadas in vitro em um sistema de scanner de ultrassom clínico (LOGIQ E9; GE, EUA). O experimento foi conduzido com frequências específicas, potências de transmissão e durações de exposição ao ultrassom. Utilizando um método desenvolvido anteriormente [19] (Fig. 5a), DOX-NBs alcançaram o aprimoramento do ultrassom. A estabilidade da imagem de ultrassom de DOX-NBs foi avaliada após sua exposição a um estímulo de ultrassom com um índice mecânico (IM) de 0,10 e uma profundidade de imagem de 4,5 cm. Todas as imagens dos EUA foram analisadas off-line com o Image J. Posteriormente, a análise das imagens foi conduzida usando o software embutido do LOGIQ E9 para calcular os valores da escala de cinza das amostras. Para cada um dos clipes de 60 s, que foram obtidos de 0 a 15 min, a correção de movimento foi realizada primeiro para cada quadro e o valor em decibéis foi obtido. Cada valor de decibel foi plotado em uma curva de tempo-intensidade para refletir as mudanças no aumento de contraste antes e depois da irradiação ultrassônica. O pico de intensidade e duração do realce foram expressos por uma curva de tempo-intensidade. Durante a análise, os valores de retroespalhamento corrigidos de faixa foram obtidos subtraindo os sinais de fundo correspondentes a uma amostra de água.
Ensaio de citotoxicidade para NBs vazios
A biossegurança de RNs de quitosana vazios foi testada usando um kit de ensaio Cell Counting Kit-8 (CCK-8) (Sigma-Aldrich, EUA). Antes do ensaio, as células MCF-7 foram semeadas a uma densidade de 2 × 10 3 células / poço em placas de 96 poços. As células foram submetidas a tratamento por meio de concentrações variadas de quitosana RN e condições de ultrassom. A biossegurança dos RNs de quitosana foi avaliada incubando células MCF-7 em concentrações seriais de RNs de 0 a 30%. Equipamento de estimulação por ultrassom de baixa intensidade (US10, Cosmogamma Corporation, Itália) foi usado para realizar a estimulação por ultrassom em uma frequência fixa de 1 MHz, usando um ciclo de trabalho de 70% e uma taxa de pulso de 100 Hz. Cada grupo processado com diferentes tempos de irradiação e diferentes intensidades de som. Por questões de segurança, o ultrassom foi usado a uma intensidade de 0,5 W / cm 2 ou 1,0 W / cm 2 com pulso de 30 ou 60 s (Tabela 1). A profundidade, frequência e outras condições de ultrassom foram mantidas consistentes durante todos os experimentos de ultrassom [22]. Após os tratamentos, as células foram cultivadas em placas de 96 poços por mais 24 h. Posteriormente, um meio de manutenção contendo 1% de FCS foi usado para substituir o meio contendo a droga, e uma solução de CCK-8 foi adicionada às placas de acordo com as instruções do fabricante. Após uma incubação adicional de 2,5 h a 37 ° C, a absorbância espectrofotométrica em cada poço foi determinada usando um leitor de microplaca (Bio-Rad, EUA) em um comprimento de onda de 450 nm.
Consumo intracelular de drogas in vitro
A captação intracelular de DOX foi determinada por citometria de fluxo (Beckman Coulter, Miami, EUA). Em resumo, as células MCF-7 foram semeadas em placas de seis poços a uma densidade de 2,5 × 10 5 células / poço em meio DMEM suplementado com FBS a 10%. Após a cultura durante a noite, o meio foi substituído por um meio de cultura contendo DOX-NBs ou DOX livre na mesma concentração, e as células foram tratadas com ou sem ultrassom. Em consideração à viabilidade celular e alta eficiência de sonoporação, uma concentração de DOX-NBs de 20% foi escolhida para os experimentos subsequentes, enquanto o tratamento de ultrassom foi estabelecido em uma intensidade de 0,5 W / cm 2 com pulso de 30 ou 60 s. Subsequentemente, após 1 h de incubação, o meio celular foi removido e as células foram lavadas três vezes com PBS fresco para remover DOX-NBs ou DOX livres e não ligados. As células foram então coletadas por centrifugação (5 min, 1000 rpm), ressuspensas em 500 μL de PBS antes da captação intracelular de DOX e analisadas em um citômetro de fluxo FACSCalibur. Durante a análise, o portão foi arbitrariamente definido para a detecção de fluorescência vermelha, e 10.000 células foram analisadas para cada amostra.
Os efeitos de DOX-NBs em células MCF-7 in vitro
Os ensaios de CCK-8 e a citometria de fluxo foram usados para realizar uma avaliação quantitativa da proliferação de células MCF-7 e apoptose após a absorção de DOX. Em resumo, as células MCF-7 foram semeadas e incubadas em placas de 96 poços ou placas de 6 poços e tratadas usando os procedimentos descritos acima. Para o ensaio de proliferação, as células tratadas foram incubadas a 37 ° C por 24 h, seguido por coloração CCK-8 por 2 h e leitura de absorbância em um leitor de microplaca. A apoptose induzida por DOX foi determinada por um ensaio de Anexina V-APC da seguinte forma:após um tratamento de seis horas, as células foram coradas pela adição de 0,5 μL de V-APC (Sungene Biotech, Tianjin, China) em cada poço e análise de citometria de fluxo (Beckman, Coulter, Fullerton, CA, EUA) foi usado para quantificar células apoptóticas.
Análise estatística
Todas as experiências foram realizadas em triplicado e os dados foram expressos como a média. As análises estatísticas foram realizadas usando SPSS versão 18.0. A p valor <0,05 foi considerado estatisticamente significativo.
Resultados
Caracterização físico-química de DOX-NBs
Os RNs preparados apresentaram morfologia esférica. Sob um microscópio invertido, a imagem dos RNs mostrou contornos esféricos discretos e intactos (Fig. 1a), o que foi consistente com a imagem do microscópio de fluorescência de DOX-NBs (Fig. 1b). Uma imagem TEM representativa da solução de DOX-NBs é mostrada na Fig. 1c. As propriedades físicas dos RNs foram determinadas pelo analisador de tamanho de partícula e potencial zeta. Conforme mostrado na Fig. 2, o diâmetro médio de DOX-NBs foi de 641 nm, P.I. 0,256. O potencial zeta dos DOX-NBs foi de + 67,12 ± 2,1 mV, suficientemente alto para fazer com que eles se repelissem, auxiliando na prevenção da agregação do RN e sustentando sua estabilidade a longo prazo.

RNs observados ao microscópio de luz (ampliação × 1000) ( a ) e a imagem do microscópio de fluorescência de RNs carregados com DOX ( b ) e imagem TEM de NBs carregados com DOX ( c )
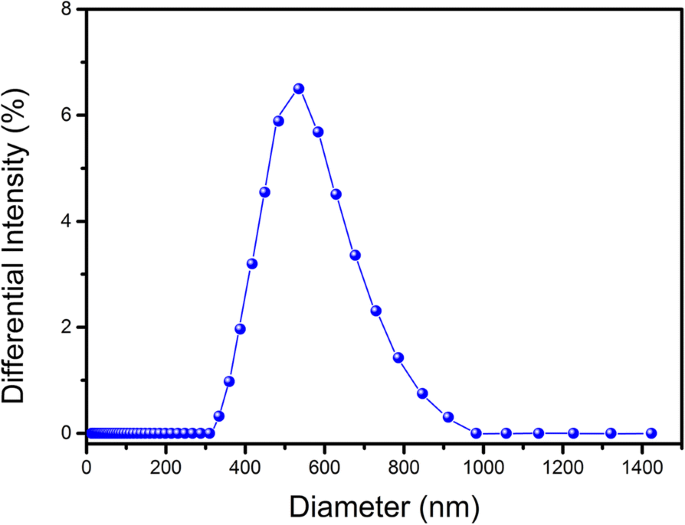
A distribuição de tamanho de NBs carregados com DOX
Estabilidade e eficiência de carregamento de drogas de DOX-NBs
Os DOX-NBs permaneceram estáveis em suspensão por 48 h a 4 ° C. Após serem armazenados à temperatura ambiente, o tamanho dos DOX-NBs foi ligeiramente maior tanto no PBS quanto no soro humano (Fig. 3). A capacidade final de carga de DOX-NBs foi de 64,12 mg DOX / g DOX-NBs, o que correspondeu a um EE de 54,18%.

Imagens ópticas de DOX-NBs a à temperatura ambiente, b após 6 h a 25 ° C em PBS, e c após 6 h a 25 ° C no soro
DOX Release por DOX-NBs In Vitro
A Figura 4 mostra o perfil de liberação in vitro de DOX de DOX-NBs em PBS na presença ou ausência de tratamento de US para avaliar os efeitos da sonicação na liberação de DOX. A quantidade de DOX liberada de DOX-NBs foi significativamente diferente entre o grupo dos EUA e o grupo de fora dos EUA. Após 5 h, os DOX-NBs no grupo dos EUA haviam liberado 46,45% do DOX encapsulado em comparação com apenas 9,3% da liberação no grupo fora dos EUA. O grupo não americano liberou apenas 19,4% do DOX após 24 horas. Em contraste, quase 80% do DOX recebeu alta no grupo dos EUA. Os resultados sugeriram que a irradiação com US pode promover a liberação de DOX dos DOX-NBs devido ao efeito da cavitação.
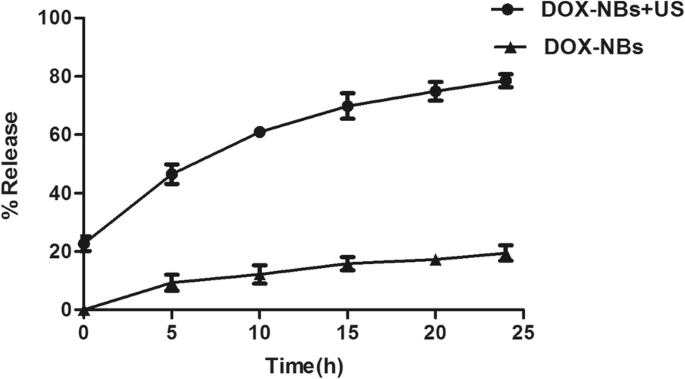
Liberação de doxorrubicina de DOX-NBs com ou sem irradiação ultrassônica (2 kHz, 1,0 W / cm 2 )
Estabilidade de ultrassom de DOX-NBs
DOX-NBs alcançaram aumento de ultrassom in vitro, conforme exibido na Fig. 5b. A atenuação do valor de decibéis ultrassônicos é mostrada na Fig. 5c. Os resultados mostraram que os DOX-NBs obtiveram bom realce ultrassom, e a curva suave demonstra que o processo de atenuação do ultrassom nas suspensões de RN foi relativamente lento. Isso indica que o sinal de ultrassom de DOX-NBs pode ser estável o suficiente para a imagem e realce de contraste.
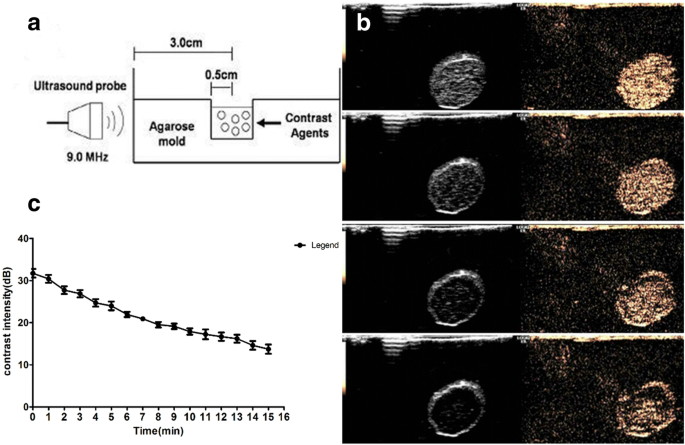
Uma ilustração esquemática da configuração experimental in vitro ( a ), imagens de ultrassom de RNs carregados com DOX (0, 5, 10 e 15 min) usando uma sonda de 9,0 MHz ( b ) e medições de intensidade de tempo de contraste ultrassônico e NBs carregados com DOX ( c )
Biossegurança de NBs vazios
A viabilidade das células MCF-7 foi medida por cultura com RNs vazios (sem DOX) por 24 horas após o ultrassom. Conforme mostrado na Fig. 6, os RNs vazios não afetaram significativamente a viabilidade celular sob certas intensidades ultrassônicas. Ao usar uma intensidade ultrassônica de 0,5 W / cm 2 e um tempo de irradiação de 30 s, 99,53% e> 80% das células MCF-7 estavam vivas em suspensões de NBs a 10% e 30%, respectivamente (grupo 1), e a diminuição na viabilidade das células MCF-7 foi dependente da dose. Além disso, a intensidade ultrassônica e o tempo de irradiação foram dois outros fatores que afetaram a viabilidade das células MCF-7. Em particular, quando a concentração de NBs vazios era de 30%, as células MCF-7 tratadas a 0,5 W / cm 2 por 30 s mostrou uma viabilidade maior do que aqueles tratados a 0,5 W / cm 2 por 60 s ou 1 W / cm 2 por 30 s (0,84% vs. 0,75% vs. 0,63%). Portanto, uma intensidade de ultrassom de 0,5 W / cm 2 e um tempo de irradiação de 30 s / 60 s foram usados para experimentos de absorção de células.
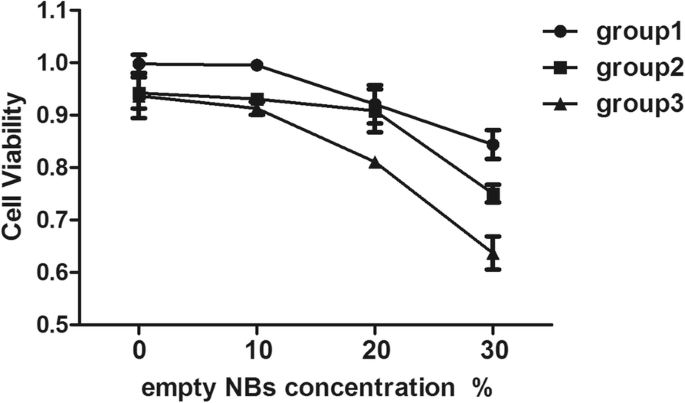
Citotoxicidade in vitro de várias concentrações de NBs e intensidade sonora em células MCF-7
Aprimoramento da entrega de DOX in vitro mediada por DOX-NBs e irradiação ultrassônica
As células MCF-7 tratadas com DOX-NBs ou DOX livre (em concentrações iguais de DOX) foram fixadas e sua intensidade de fluorescência foi medida por citometria de fluxo. As células que não receberam tratamento DOX foram usadas como controles em branco. A captação celular de DOX no grupo DOX-NBs foi comparada com a de DOX livre e o grupo controle. Na Fig. 7, a intensidade média de fluorescência de células MCF-7 incubadas com DOX-NBs foi muito menor do que a autofluorescência de células incubadas com DOX livre, ilustrando que a encapsulação de DOX em quitosana NBs poderia proteger as células da absorção de DOX e DOX- lesão induzida.
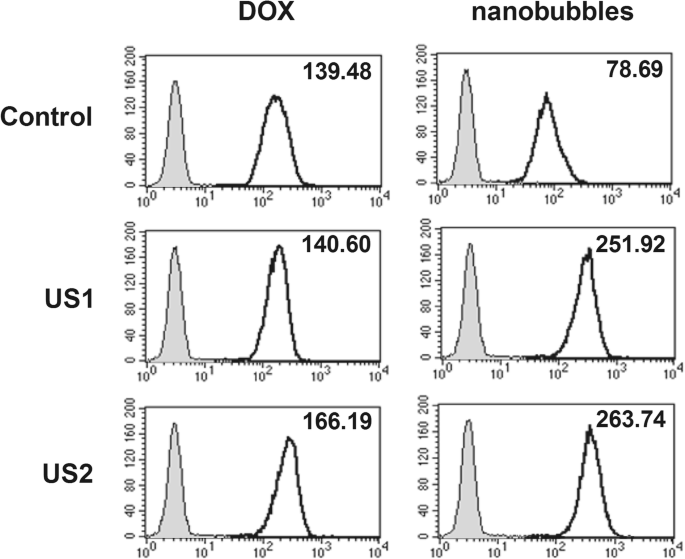
Análise de citometria de fluxo da entrega de DOX em células MCF-7 por NBs carregados com DOX (US1 0,5 W / cm 2 30 s, US2 0,5 W / cm 2 anos 60)
No entanto, a irradiação de ultrassom resultou em um aumento acentuado na captação de DOX em células MCF-7 incubadas com DOX-NBs; DOX-NBs podem fornecer mais DOX em células MCF-7 com a ajuda de irradiação ultrassônica. Em contraste, a absorção de DOX em células MCF-7 incubadas com DOX livre foi apenas ligeiramente aumentada sob irradiação ultrassônica. Os resultados sugeriram que a captação de DOX em células MCF-7 incubadas com DOX-NBs foi muito maior do que nas células incubadas com DOX livre sob irradiação ultrassônica.
Além disso, a absorção de DOX em células MCF-7 incubadas com DOX-NBs foi ligeiramente aumentada após um tempo de irradiação mais longo. Isso pode ser devido ao aumento da ruptura de DOX-NBs, gerando poros transitórios nas membranas das células MCF-7.
Aumento da proliferação de células tumorais induzida por DOX e apoptose por irradiação ultrassônica
Para investigar os efeitos anticâncer da entrega de DOX-NBs assistida por ultrassom, a viabilidade das células MCF-7 foi medida usando um ensaio de CCK-8 e citometria de fluxo. Os resultados mostram que a viabilidade das células MCF-7 no grupo DOX-NBs foi maior do que no grupo DOX sem ultrassom. Enquanto isso, a viabilidade das células MCF-7 no grupo DOX-NBs foi significativamente menor do que no grupo DOX com irradiação ultrassônica local. A proporção de viabilidade celular no grupo DOX-NBs (21,0 ± 2,2%, p <0,01) foi muito maior do que no grupo DOX livre sem irradiação ultrassônica (6,4 ± 0,7%), sugerindo que, como vetores de entrega de drogas, os RNs melhoram a diminuição induzida por DOX da proliferação celular na circulação sanguínea.
Além disso, a proporção de viabilidade celular diminuiu significativamente em células tratadas com DOX-NBs + US (3,1 ± 0,8%, 2,2 ± 0,9%) em comparação com aquelas tratadas apenas com DOX-NBs (21,0 ± 2,2%, p <0,01), DOX livre sozinho (6,4 ± 0,7%) e DOX livre + ultrassom (4,1 ± 0,8%, 3,8 ± 0,6%) (Fig. 8). Os dados indicaram que DOX-NBs + US aumentaram significativamente os efeitos citotóxicos de DOX em células MCF-7. O grupo DOX-NBs + US também demonstrou maior citotoxicidade em células MCF-7 do que os grupos DOX livre e DOX + ultrassom livre.
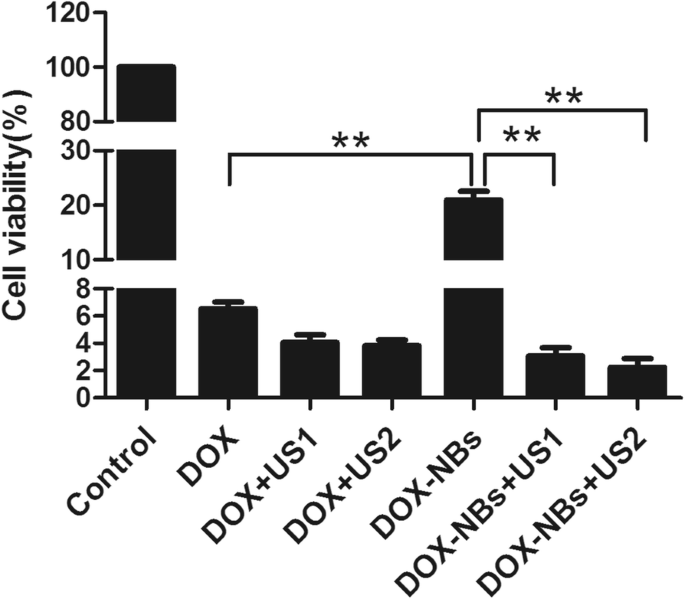
A comparação da viabilidade celular em diferentes grupos
A razão de viabilidade celular no grupo de DOX livre + ultrassom (4,1 ± 0,8%) foi menor do que no grupo de DOX livre (6,4 ± 0,7%). Portanto, o ultrassom também reduziu a viabilidade das células MCF-7 tratadas com DOX livre. A razão de viabilidade celular foi de 2,2 ± 0,9% quando as células foram tratadas com DOX-NBs + ultrassom (60 s), que foi menor do que quando tratadas com DOX-NBs + ultrassom (30 s) (3,1 ± 0,8%), indicando que o comprimento de pulso mais longo (60 s) foi mais eficiente na entrega de DOX-NBs.
Além disso, a apoptose de células MCF-7 foi avaliada por coloração com Anexina V 6 h após o tratamento com DOX livre ou DOX-NB, com ou sem irradiação de ultrassom. A porcentagem de células apoptóticas MCF-7 na presença de DOX livre foi 4,4 ± 0,9%, enquanto uma proporção semelhante foi observada em células tratadas com DOX livre e ultrassom (30 s, 60 s). A entrega de DOX-NBs assistidos por ultrassom aumentou significativamente a porcentagem de células apoptóticas em comparação com o grupo DOX livre (45,7 ± 1,1% vs. 4,4 ± 0,9%, p <0,01). Além disso, a porcentagem de células apoptóticas no grupo DOX-NBs sem irradiação de ultrassom foi menor do que no grupo de tratamento com DOX livre (3,2 ± 0,9% vs. 4,4 ± 0,9%). Consistente com o ensaio de viabilidade celular, esses dados indicaram que a entrega de DOX-NBs assistida por ultrassom aumentou o efeito anticâncer do DOX.
Discussão
O câncer mamário tem atraído cada vez mais atenção devido às altas taxas de incidência e mortalidade. De acordo com um relatório da Globocan, o câncer mamário é a causa mais frequente de mortes por câncer em mulheres em regiões menos desenvolvidas [23]. DOX é um agente anti-câncer mamário popular, pois pode induzir danos ao DNA [24]. No entanto, também pode causar efeitos colaterais graves, como cardiotoxicidade, em aplicações clínicas [25]. Para superar esses efeitos tóxicos, são necessários sistemas de entrega de drogas eficientes que tenham como alvo apenas as células cancerosas, aumentando assim a concentração da droga em seus locais-alvo e reduzindo-a em tecidos não-alvo [26]. Neste trabalho, RNs de quitosana biológica carregados com DOX foram projetados, os quais, quando usados em conjunto com o ultrassom, poderiam transportar o DOX de maneira direcional para as células do câncer de mama.
Quitosana biológica NBs compostos de lecitina e ácido palmítico foram formulados e usados para ressonância magnética / detecção de ultrassom, entrega de genes e entrega de oxigênio [13, 18, 27]. No entanto, a capacidade de carga da droga e a eficiência de entrega dos RNs de quitosana biológica estão longe de serem ideais. Marano et al. combinados NBs de glicol quitosana carregados com DOX e ondas de choque extracorpóreas (ESWs) para aumentar a atividade antitumoral de DOX [28]. Mas os ESWs não possuem a capacidade de imagem para avaliar o tamanho do tumor e detectar com precisão sua localização. Além disso, embora os efeitos colaterais graves de ESWs sejam raros, eles podem induzir arritmias cardíacas transitórias [29]. Os metabólitos do glicol, incluindo glicolato e precipitação de oxalato de cálcio, também podem causar acidose metabólica grave [30]. Comparado com ESWs, o ultrassom tem maiores vantagens devido à sua capacidade de imagem, não invasão e segurança.
Neste estudo, novos DOX-NBs foram preparados usando perfluoropropano como núcleo e quitosana como casca. A quitosana pode ativar macrófagos e também aumentar suas funções pró-inflamatórias [31]. Deve-se notar que os DOX-NBs carregados positivamente podem interagir fortemente com os componentes do sangue, resultando em rápida eliminação do sangue e acúmulo subótimo direcionado no local do tumor [32]. Para superar esse problema, a superfície de DOX-NBs foi revestida com Pluronic F-68, um copolímero em bloco anfifílico e não iônico formado por unidades de óxido de propileno e etileno, que também pode impedir a agregação de nanobolhas por estabilização estérica [13, 33 ]
Garantir a biossegurança do RN é fundamental para sua aplicação clínica. In this study, the safety of chitosan NBs was monitored via cell viability, which showed no obvious effect on cell viability with a chitosan NB concentration of 10% and ultrasound treatment (0.5 W/cm 2 , 30 s), suggesting low cytotoxicity of chitosan NBs. Indeed, even treatment with a high dosage (30%) of chitosan NBs resulted in less than 20% observable cell death. The results showed that cell viability in chitosan NBs was much higher than that in lipid-coated nanobubbles [19], indicating that chitosan NBs were highly biocompatible with MCF-7 cells and that the cell death observed in this study may be due to the energy released by ultrasound-induced NB disruption. The high safety profile of biocompatible chitosan NBs renders them suitable for loading other drugs in the future.
Our research shows that US irradiation can effectively promote the release of DOX from DOX-NBs and subsequent cellular uptake of DOX in vitro. Exposure of cells to DOX-NBs and ultrasound resulted in near instantaneous cellular entry of DOX. The reason for this is that sonoporation is a process by which ultrasonically activated ultrasound contrast agents pulsate near biological barriers (cell membranes or endothelial layers), increasing their permeability and thereby enhancing the extravasation of external substances. In this way, drugs and genes can be delivered inside individual cells [34]. Our data showed that the cellular uptake of DOX was significantly higher in the DOX-NBs group than in the free DOX group when ultrasound-assisted delivery was applied. Meanwhile, without ultrasound, MCF-7 cells in the free DOX group showed increased DOX uptake than those in the DOX-NBs group, indicating that the chitosan NBs could reduce cellular uptake of DOX in normal tissues and protect them in the absence of ultrasonic irradiation.
Chen et al. showed that the carrier-free HCPT/DOX nanoparticles enhanced synergistic cytotoxicity against breast cancer cells in vitro [35], but they could not reduce DOX cytotoxicity and its toxicity in the circulation. A biophysical research group from Vytautas Magnus University proposed combining DOX-liposomes with microbubbles and US to enhance targeting [36]. Their results showed that the cell survival rate of DOX-liposomes decreased by 60~70% when microbubbles and ultrasound were present. By comparison, the cell survival rate of the DOX-NBs + US group in our study was 85.3% or 89.5% ((21–3.1 or 21–2.2)/21) lower than that of the DOX-NBs group. This proves that the combination of DOX-NBs and US are more effective in transporting DOX than DOX-liposomes combined with microbubbles and US. We also found that the cells in the DOX-NBs + US group showed a higher rate of apoptosis than those in the free DOX and DOX-NBs only groups. This finding was not unexpected as greater accumulation of DOX in cancer cells can increase cell death, consistent with a previous report [37].
Conclusions
In summary, DOX-loaded biocompatible chitosan NBs were successfully prepared using a combination of biological surfactants. The prepared NBs possessed a good ability to achieve ultrasound enhancement and excellent biosafety. The in vitro results demonstrated that DOXNBs are an innovative drug delivery system that may be useful in obtaining efficient ultrasoundassisted DOX delivery for the treatment of mammary cancer.
Abreviações
- CCK-8:
-
Cell Counting Kit-8
- DMEM:
-
Dulbecco’s modified Eagle’s medium
- DOX:
-
Doxorubicin hydrochloride
- EE:
-
Encapsulation efficiency
- EP tubes:
-
Eppendorf tubes
- ESWs:
-
Extracorporeal shock waves
- MCF-7:
-
Human breast adenocarcinoma cell line
- NBs:
-
Nanobubbles
- US:
-
Ultrassom
- UTN/MD:
-
Ultrasound-targeted nano/microbubble destruction
Nanomateriais
- Para que serve o Hafnium?
- Nanopartículas de ouro para sensores quimio
- Nanofibras e filamentos para entrega aprimorada de drogas
- Para que é usado o Nióbio?
- Para que é usado o Bronze de Alumínio?
- Administração de medicamentos baseados em células para solicitações de câncer
- Nanopartículas lipídicas de PLGA rastreadas com 131I como transportadores de administração de drogas para o tratamento quimioterápico direcionado do melanoma
- Ferro fundido usado para usinagem
- Para que serve o Monel?
- Para que serve um torno?



