Nanotécnicas Inativam células-tronco cancerosas
Resumo
Uma das tarefas da oncologia atual é a identificação de células-tronco cancerígenas e a busca de meios terapêuticos capazes de sua inibição específica. O artigo apresenta os dados sobre as características do fenótipo das células do carcinoma de Ehrlich como um modelo conveniente e fácil de seguir de crescimento tumoral. A evidência de células-tronco cancerosas como parte do carcinoma de Ehrlich e o significado de CD44 + e CD44 - foram demonstradas subpopulações na manutenção do crescimento desse tipo de tumor. Uma alta (dez vezes) atividade tumorigênica do carcinoma de Ehrlich CD44 + células se comparadas a CD44 - células foi comprovado. Neste par de comparação, o CD44 + as células tinham um maior potencial de geração na cavidade peritoneal de CD44 alto , CD44 + CD24 - , CD44 + CD24 + subpopulações de células, destacando a presença de células-tronco cancerosas em um pool de CD44 + células.
Neste estudo, a capacidade de nanocomplexos híbridos sintetizados, compreendendo as nanopartículas de ortovanadados de terras raras GdYVO 4 :Eu 3+ e foi estabelecido o colesterol para inibir o crescimento do tumor e para aumentar a sobrevivência dos animais com tumores. Uma contribuição especial para o efeito de inibição do tumor é feita por cada um de seus componentes. O tratamento de células de carcinoma de Ehrlich com complexo híbrido de dois componentes resultou na redução máxima na concentração do CD44 mais tumorigênico alto células com aumento simultâneo no número de CD117 + células que diminuíram a intensidade de crescimento do tumor em 74,70 ± 4,38% se comparadas com o controle.
Histórico
O problema do crescimento maligno continua sendo um dos mais urgentes na medicina. Nas últimas décadas, houve algum progresso no desenvolvimento de novos tratamentos para o câncer. Isso se deve à revisão do conceito clássico de câncer e à descoberta de células-tronco cancerosas (CSCs), que são capazes de autorrenovação ilimitada e podem ser identificadas por uma série de marcadores fenotípicos. A maioria dessas células é resistente a radio e quimioterapias, causando recidiva do crescimento maligno e metástase. Existem novos métodos dominados de terapia anticâncer, a saber, permitindo inativar seletivamente as células tumorais com dano mínimo ao tecido normal [1].
Os CSCs foram identificados e descritos pela primeira vez em 1997 pela equipe de M. Dick [2]. Os autores investigaram uma leucemia mieloide aguda em que a subpopulação sendo 0,01–1% da população total de células poderia causar leucemia quando transplantada para camundongos imunodeficientes NOD / SCID (imunodeficiência combinada diabética não obeso-severa). Estas células indutoras de tumor foram fenotipicamente caracterizadas como CD34 + CD38 - . Em 2003, M. Al-Hajj e M.S. Wicha conseguiu identificar as CSCs em uma forma sólida de câncer de mama humano (BC) [3]. Foi descoberto que a população não separada de câncer de mama primário exibiu um potencial tumorigênico em 100% dos casos (10/10) quando administrada a camundongos NOD / SCID em uma concentração de 5 × 10 4 células / mouse. Reduzindo a concentração de células administradas para 1 × 10 4 células / camundongo diminuíram sua atividade tumorigênica 4 vezes (3/12) [3]. CD24 + CD44 + fração quando administrada em várias doses (2 × 10 4 até 100 células / camundongo) não permitiu o crescimento do tumor. Com isto, CD44 + CD24 - / subpopulação baixa possuía atividade tumorigênica significativamente maior, demonstrando a formação de tumores em 100% dos casos quando administrados 10 3 células / mouse. A capacidade mais pronunciada de formar tumores era inerente à subpopulação de CD44 + CD24 - / lo ESA + fenótipo. A administração a camundongos de apenas 200 dessas células resultou na formação de tumores sólidos em 100% (4/4) 5 meses após a injeção [3]. Esses estudos foram continuados por Ponti D. et al., Que mostraram a capacidade de certas populações de amostras de biópsia de câncer de mama em formar as mamoesferas in vitro em cultura sem soro [4]. A maioria das células das mamoesferas obtidas eram de CD44 + / CD24 - / baixo fenótipo, bem como um potencial tumorigênico aumentado in vivo quando administrado a camundongos SCID (imunodeficiência combinada grave). A capacidade de formação de tumor nesta subpopulação foi 1000 vezes maior em relação à linha tradicionalmente transplantada de carcinoma de mama MCF7 [4]. No entanto, os autores mostraram que apenas 20% de CD44 + CD24 - / baixo as células têm a capacidade de se auto-renovar. Isso pode ser devido à heterogeneidade dessa subpopulação, ou seja, a presença de marcadores adicionais (ESA, ALDH), determinando a função das células e também pode estar relacionado à taxa de expressão de CD44. Os trabalhos publicados durante os últimos anos mostram que os CSCs com alta expressão do marcador (CD44 alto ) têm a maior atividade tumorigênica [5, 6]. Em implantação ortotópica de 5 × 10 5 CD44 alto -RAS transformado e CD44 baixo células para camundongos NOD / SCID, verificou-se que uma subpopulação CD44 baixa possuía baixa tumorigenicidade (o tumor foi formado em 30% dos casos), enquanto o CD44 alto as células foram capazes de formar tumores em 100% dos casos [6].
Resumindo os dados publicados, a linha de diferenciação de subpopulações de células de câncer de mama pode ser representada da seguinte forma:
$$ \ mathrm {C} \ mathrm {D} {44} ^ {\ mathrm {alto}} \ to \ mathrm {C} \ mathrm {D} {44} ^ {+} \ mathrm {C} \ mathrm { D} {24} ^ {\ hbox {-}} \ to \ kern0.5em \ mathrm {C} \ mathrm {D} {44} ^ {+} \ mathrm {C} \ mathrm {D} {24} ^ {+} \ to \ mathrm {C} \ mathrm {D} {44} ^ {\ hbox {-}} \ mathrm {C} \ mathrm {D} {24} ^ {+} $$
Uma série de células com outros marcadores, particularmente Sca-1 + reivindica o estágio de CSCs. Os dados sobre uma redução do crescimento do tumor nos camundongos knock-out Sca-1 indicam a favor da hipótese do papel de iniciação do tumor de Sca-1 + células em um estágio inicial da tumorigênese [7]. Recentemente, muito mais atenção dos pesquisadores tem sido atraída não apenas pelas CSCs, mas também pelas células que fazem seu microambiente regulador de acessórios. O CD117 + células, que tradicionalmente são detectadas em um pool de células-tronco do sangue, merecem uma atenção particular entre elas [8]. A população total de células de carcinoma de mama humano compreende os chamados fibroblastos de estroma associados a carcinoma com CD117 + fenótipo. Eles apóiam o crescimento do tumor, promovendo sua angiogênese [9, 10]. Uma suposição da presença na população de células-tronco do carcinoma de Ehrlich (EC), estudo do potencial tumorigênico de CD44 + fração e função de CD117 + células na manutenção do desenvolvimento do tumor requer uma evidência extra.
A maioria dos experimentos para passagem de CSCs in vivo foi realizada em camundongos SCID ou NOD / SCID. Esses ratos não respondem com uma reação imune ao xenotransplante de células humanas. A busca por modelos experimentais adequados e relevantes para estudar e avaliar a atividade antitumoral de diversos agentes terapêuticos está em andamento. Uma delas é a linhagem celular tumoral transplantada in vivo da EC, que foi obtida de um câncer de mama espontâneo de camundongo [11]. Porém, praticamente não existem publicações quanto à composição da subpopulação de células EC e suas características fenotípicas, presença de CSCs e sua importância na manutenção do crescimento desse tipo de tumor. Levando em consideração a similaridade histogenética de EC e BC, pode-se presumir que na iniciação e no desenvolvimento do tumor simulado, os mesmos genes que controlam a proliferação de células cancerosas podem estar envolvidos, bem como vias bioquímicas semelhantes que levam à expressão de proteínas marcadoras de tumor. No entanto, a suposição sobre a presença de CSCs na população de CE e o estudo de seu potencial tumorigênico carece de evidências adicionais, o que foi um dos objetivos do presente estudo.
Nenhum problema menos urgente da oncologia atual é encontrar as drogas, não apenas reconhecendo especificamente, mas também inativando as CSCs. O próprio conceito de compreensão do problema foi a base formada na direção do momento “teranóstica” (terapia + diagnóstico) [12]. No âmbito da teranóstica, desenvolvem-se abordagens tecnológicas de utilização de medicamentos e ferramentas de diagnóstico e terapia simultânea do câncer. Uma das direções da teranóstica é o direcionamento de nanopartículas de ouro para o local do tumor e após a terapia fototérmica [13]. Outra abordagem para a identificação de células tumorais é o uso de pontos quânticos, poderosos agentes de contraste óptico que permitem o monitoramento do tumor in vivo [14]. A capacidade dos pontos quânticos de visualizar de forma não invasiva as células-tronco embrionárias humanas in vivo atesta a favor de sua possível aplicação biomédica [15].
Recentemente, maior atenção é dada aos nanoluminóforos baseados em materiais dielétricos e semicondutores de zona ampla, ativados com elementos de terras raras, a saber, nanopartículas (NPs) de metais de terras raras (em particular, vanádio e seus compostos) [16]. Esses materiais possuem alta fotoestabilidade, grande deslocamento de Stokes de luminescência, ausência do efeito de cintilação e estabilidade de faixas estreitas de luminescência características. Com isso, os efeitos antitumorais dos compostos de vanádio são conhecidos. Assim, foi demonstrado que um dicloreto de vanádio pode inibir significativamente a proliferação celular como resultado do acúmulo na heterocromatina nuclear com subsequente indução da aberração mitótica, supressão transitória de mitoses, levando ao acúmulo de células no final S e G 2 fases [17]. Pode ser promissor para o tratamento de tumores malignos o uso de nanocomplexos híbridos baseados em NPs baseados em terras raras de ortovanadados GdYVO 4 :Eu 3+ e colesterol, desenvolvido no Instituto de Materiais de Cintilação da Academia Nacional de Ciências da Ucrânia [18].
O objetivo de sua criação foi aumentar o efeito terapêutico dos agentes anticâncer devido à presença na composição de nanocomplexos com afinidade para as membranas das células-alvo. Um é o colesterol, que é ativamente “retirado” da corrente sanguínea pela proliferação de células cancerosas para construir as biomembranas. Isso é facilitado pela presença na superfície de um grande número de células tumorais SR-B1 (receptor necrófago, classe B tipo I) e receptores de caveolina-1 (Cav-1), que podem se ligar ao colesterol livre da corrente sanguínea [19] .
Assim, o objetivo deste trabalho foi identificar a composição da subpopulação de células EC, incluindo aquelas com sinais de CSCs, bem como sua atividade tumorigênica após pré-tratamento com nanocomplexos híbridos.
Métodos
Os experimentos foram realizados em camundongos Balb / C fêmeas de 8 meses de idade. Os camundongos foram mantidos em condições padrão de biotério (temperatura ambiente de 20 ± 2 ° C, umidade relativa de 50-70%, ciclo claro-escuro 12:12 h). Todos os protocolos experimentais foram aprovados pelo Comitê de Ética Animal do Institute for Problems of Cryobiology and Cryomedicine da National Academy of Sciences da Ukraine, Kharkiv, Ukraine, (rec. No. 1 de 23.01.2017) e em conformidade com a Convenção Europeia sobre o Uso de Animais Experimentais (Estrasburgo, 1986), aprovado pelo Primeiro Congresso Nacional da Ucrânia em Bioética (Kiev 2004).
Cultivo de células EC in vivo
Células de carcinoma de Ehrlich (EC) foram passadas na cavidade peritoneal (PC) de camundongos Balb / C. As células EC criopreservadas no líquido ascítico foram utilizadas como cultura primária [20]. Após o descongelamento, as células CE foram três vezes retransplantadas in vivo, para atenuação da influência dos fatores de congelamento-descongelamento e ganho por eles de características morfológicas e funcionais das células nativas [21]. Assim, as células EC “estabilizadas” foram injetadas intraperitonealmente em uma dose 3 × 10 6 células / camundongo em 0,3 ml de solução salina e cultivadas por 7 dias in vivo. Após 7 dias, os animais experimentais foram removidos do experimento sob anestesia leve com éter. O líquido ascítico do CP foi retirado por uma seringa através de uma agulha de 2,69 mm de diâmetro interno e colocado em tubo de medição de 10 ml. O número absoluto de células foi determinado pela ampliação do volume do líquido ascítico acumulado na cavidade peritoneal (ml) com o número de células EC contadas na câmara de Goryaev. Um aumento no número total de até 35,00 × 10 7 As células EC em PC de camundongos até o dia 7 foi um critério de desenvolvimento de carcinoma [21]. No futuro, as próprias células serviram de objeto de estudo.
Avaliação fenotípica de subpopulações de CE
Foi realizado com um citômetro de fluxo “FACS Calibur” (“Becton Dickinson,” EUA) usando anticorpos monoclonais (US “BD Biosciences”) para CD44 (FITC) (no. 553133, clone IM7), CD117 (FITC) (no. 553354, clone 2B8) e Sca-1 (FITC) no. 553333, clone E13-161.7) e CD24 (PE) no. 553262, clone M1 / 69) de acordo com as instruções do fabricante. Como um controle, as amostras com adição de anticorpos monoclonais não imunes marcados com FITC e PE dos mesmos isotipos ("BD Biosciences"), no. 553988, clone A95-1 e no. 553989, clone A95-1), como anticorpos para o marcador testado. Uma dupla coloração imunofenotípica foi realizada usando anticorpos monoclonais CD44 (FITC) e CD24 (PE). As células com uma fluorescência média do marcador CD44 superior a 10 3 (de acordo com uma escala logarítmica) foram referidos como CD44 alto subpopulações. O registro e a análise dos resultados foram realizados com o software “WinMDi 2.9” (Joseph Trotter, La Jolla, EUA).
Separação de CD44 + Fração de células EC usando classificação imunomagnética
Tendo em mente que os CSCs com um alto nível de expressão do marcador CD44 (CD44 alto ), composta por uma população heterogênea de CD44 + células, possuem a maior atividade tumorigênica, elas foram isoladas de uma população total de EC com um classificador magnético (BDTM Imagnet). Para isolar CD44 + facção, foram usados anticorpos monoclonais primários não marcados para o marcador CD44 (BD, 558739) e partículas magnéticas de IgG1 de camundongo secundárias-DM (BD, 557983) de acordo com o protocolo do fabricante. Pureza de separação para CD44 + células da população total de EC foi de 90%.
Determinação da atividade tumorogênica das células da população total e do CD44 isolado + e CD44 - - frações EC
Capacidade tumorigênica da população total e CD44 isolado + e CD44 - As frações de EC foram comparativamente analisadas pelo método de cultura in vivo descrito acima. A configuração experimental é mostrada na Fig. 1.
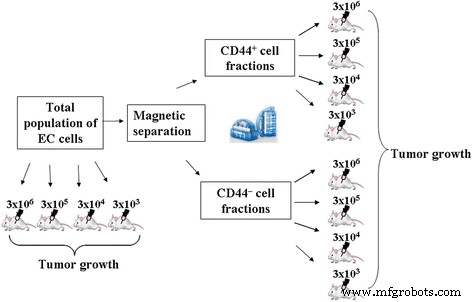
Projeto experimental ao analisar comparativamente a capacidade tumorigênica da população total e CD44 isolado + e CD44 - Frações EC
No primeiro conjunto de experimentos, avaliamos a capacidade tumorigênica da população total e do CD44 isolado + e CD44 - Frações de CE ao administrá-las a animais em uma dose padrão usada para iniciação de CE (3 × 10 6 células em 0,3 ml de solução salina).
Os animais foram divididos nos seguintes grupos ( n =10):
-
Grupo 1.1 - administração da população total de células EC (3 × 10 6 células / animal)
-
Grupo 2.1 - administração de CD44 + fração de células EC (3 × 10 6 células / animal)
-
Grupo 3.1 - administração de CD44 - fração de células EC (3 × 10 6 células / animal)
Em 7 dias após a inoculação em cada um dos grupos experimentais, um número total de células em PC de animais foi contado, as características fenotípicas das células foram avaliadas (como descrito acima) e CD44 alto / CD117 + proporção de células EC determinada como a proporção de CD44 alto porcentagem para CD117 + células [22]. Potencial proliferativo de células da população total de EC e CD44 isolado + e CD44 - as frações foram estimadas com base nos dados da seguinte forma:fator de multiplicidade (MF) do excedente da população de células durante o tempo de cultivo, M =N / N 0 ; e duplicação do tempo (TD), TD =(log 2 2) * t / [log 2 ( N / N 0 )], onde t é o momento da cultura celular (h), N é o número de células em t Tempo; N 0 é o número inicial da célula [23].
No segundo conjunto de experimentos, havia uma dose mínima estimada das células administradas da população total e CD44 isolado + e CD44 - Frações de EC, induzindo o crescimento do tumor. Suspensão total de células e CD44 isolado + e CD44 - As frações de EC foram administradas por via intraperitoneal a camundongos nas doses de 3 × 10 6 , 3 × 10 5 , 3 × 10 4 e 3 × 10 3 células por camundongo em 0,3 ml de solução salina e cultivadas por 7 dias no PC.
Os animais usados neste conjunto de experimentos foram divididos nos seguintes grupos ( n =10):
-
Grupo 1.1 - administração da população total de células EC (3 × 10 6 células animais)
-
Grupo 1.2 - administração da população total de células EC (3 × 10 5 células / animal)
-
Grupo 1.3 - administração da população total de células EC (3 × 10 4 células / animal)
-
Grupo 1.4 - administração da população total de células EC (3 × 10 3 células / animal)
-
Grupo 2.1 - administração de CD44 + fração de células EC (3 × 10 6 células / animal)
-
Grupo 2.2 - administração de CD44 + fração de células EC (3 × 10 5 células / animal)
-
Grupo 2.3 - administração de CD44 + fração de células EC (3 × 10 4 células / animal)
-
Grupo 2.4 - administração de CD44 + fração de células EC (3 × 10 3 células / animal)
-
Grupo 3.1 - administração de CD44 - fração de células EC (3 × 10 6 células / animal)
-
Grupo 3.2 - administração de CD44 - fração de células EC (3 × 10 5 células / animal)
-
Grupo 3.3 - administração de CD44 - fração de células EC (3 × 10 4 células / animal)
-
Grupo 3.4 - administração de CD44 - fração de células EC (3 × 10 3 células / animal)
Em cada grupo experimental, um número total de células em PC e de animais com desenvolvimento de ascite foi determinado 7 dias após a inoculação da CE.
Síntese de nanocomplexos
Nanocomplexos híbridos contendo nanopartículas esféricas (NPs) (de 2-3 nm de diâmetro) a uma concentração de 1,30 g / le colesterol de ovelha na concentração de 0,55 g / l (“Acros orgânicos”, Bélgica) foram sintetizados no Instituto de Materiais de Cintilação da Academia Nacional de Ciências da Ucrânia (Kharkiv), conforme relatado [18]. NPs baseados em ortovanadados de elementos de terras raras GdYVO 4 :Eu 3+ de formato esférico na concentração de 1,30 g / l foram preparados conforme descrito [24]. Soluções coloidais aquosas à base de ortovanadatos foram purificadas de impurezas por diálise usando as membranas “Cellu Sep H1” 3,5 KDa.
No nanocomplexo híbrido, os NPs carregados negativamente estão localizados ao longo da periferia das partículas de colesterol devido a van der Waals e interações hidrofóbicas. Os NPs estabilizam os nanocomplexos por meio de interações eletrostáticas. Os tamanhos dos nanocomplexos sintetizados não excedem 100 nm. Além disso, os NPs exibem propriedades antioxidantes e não estão sujeitos à oxidação. Esse fato contribui para o aumento da resistência da dispersão aquosa de colesterol em relação às espécies reativas de oxigênio. A estrutura esquemática do nanocomplexo híbrido é mostrada na Fig. 2.
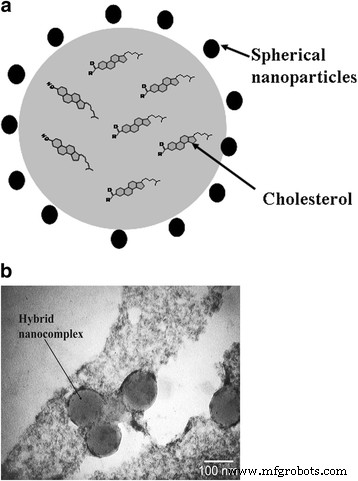
Nanocomplex híbrido: a representação esquemática e b fotomicrografia de microscopia eletrônica de transmissão de nanocomplexos híbridos, obtidos a partir de solução aquosa de colesterol colocada na rede de carbono
Para registrar um acúmulo de nanocomplexos híbridos em células durante os estudos in vitro, o corante fluorescente hidrofóbico 1,1′-dioctadecil-3,3,3 ′, 3′-tetrametilindocarbocianina perclorato (DiI) pode ser adicionalmente introduzido na dispersão aquosa de colesterol, permitindo na espectroscopia luminescente local avaliar a dinâmica de integração do complexo em uma membrana celular pela proporção do monômero –– bandas de luminescência do “agregado J” [25]. Nossos estudos anteriores mostraram que o nanocomplexo híbrido é capaz de ser integrado a não mais do que 10% das células da população total de EC e virtualmente a todas as células do CD44 isolado + fração com maior potencial carcinogênico. Isso permite o uso de nanocomplexos híbridos nesta modificação (NPs + colesterol + DiI) como método de identificação do acúmulo local de nanocomplexos em células cancerosas [26, 27].
Pré-tratamento de células CE com nanomateriais
A suspensão total de células EC com nanocomplexos híbridos ou NPs foi incubada em uma solução de glicose a 5% (“Infusion” CJSC, Kyiv) em temperatura ambiente por 3 h. Esse tempo de incubação foi anteriormente considerado um ótimo para nanocomplexos de ligação às células [26].
As seguintes variantes de pré-tratamento de células EC com nanomateriais foram testadas:
-
Opção 1–900 μl de células EC (1 × 10 7 ) 100 μl de NPs esféricos (1,3 g / l) foram adicionados.
-
Opção 2–900 μl de células EC (1 × 10 7 ) 100 μl de complexo híbrido (NPs esféricos (1,3 g / l) + colesterol (0,55 g / l)) foram adicionados.
O controle foram as células da população total da CE, as quais foram incubadas em solução de glicose a 5% sem tratamento com nanocompósitos. O número de animais em cada grupo experimental não foi inferior a 20.
Após a incubação, as células EC de todos os grupos testados foram lavadas três vezes com solução salina (1:1) por centrifugação (10 min a 300 g).
A intensidade do desenvolvimento de CE após o pré-tratamento com nanomateriais foi avaliada por injeção intraperitoneal em uma dose 3 × 10 6 células em 0,3 ml de solução salina. Em 7 dias após a inoculação das células EC em todos os grupos estudados, foram determinados:
-
Um número total (TN) de células EC na cavidade peritoneal.
-
Taxa de inibição (Ri) do crescimento de EC de acordo com a fórmula Ri =(TN (c) - TN (e)):TN (c) × 100%, onde TN (c) –– número total de células EAC no PC do grupo controle, TN (e) - número total de células EAC no PC do grupo experimental.
-
A taxa de crescimento (Rg) de EC foi calculada usando a fórmula Rg (e) =Rg (c) - Ri, onde Rg (e) - taxa de crescimento de tumores do grupo experimental de animais; Rg (c) - taxa de crescimento do tumor do grupo de controle, Ri - taxa de inibição do crescimento de EC no grupo experimental de animais; A taxa de inibição do crescimento de EC no controle foi considerada como 100%, então, não houve inibição do crescimento de EC.
-
CD44 alto / CD117 + proporção (proporção de CD44 alto porcentagem para CD117 + células).
-
A sobrevivência dos animais foi avaliada até o dia 20 após a injeção intraperitoneal de células EC não tratadas e tratadas com todos os tipos de células EC nanocompósitos.
O processamento estatístico foi realizado usando Mann-Whitney não paramétrico U teste no software Statistica 6.0. As diferenças foram consideradas estatisticamente significativas em P <0,05.
Resultados
Os resultados obtidos indicam a presença de uma população heterogênea de células EC portando em sua superfície os marcadores CD44, CD24, Sca-1 e aqueles que podem ser atribuídos a elementos reguladores acessórios do microambiente (CD117). As concentrações de células com essas características no pool de EC total (grupo 1.1) são mostradas na Tabela 1 e são completamente consistentes com os achados anteriores sobre a composição da subpopulação de EC [28]. A identificação da estrutura Sca-1 em praticamente todas as células EC permite considerá-la como um marcador versátil desse tipo de tumor.
O mais informativo em termos de identificação fenotípica de CSCs é a expressão da molécula de CD44, que por si só ou em combinação com outros marcadores de superfície são usados para isolar essa população de células de vários tumores, incluindo EC. De acordo com as noções clássicas, a diferenciação das células tumorais durante o desenvolvimento do câncer de mama é acompanhada pela redução da expressão do receptor CD-44 com seu desaparecimento gradual e surgimento das células que expressam o marcador CD24 [3].
Os candidatos para o papel de CSCs durante EC podem ser as células com CD44 alto fenótipo sendo a parte de CD44 + CD24 - - população. Esta suposição sobre a dependência de CE na atividade funcional de uma subpopulação de CD44 + as células foram testadas ao avaliar a intensidade do crescimento do tumor induzido por CD44 + e CD44 - facções e população total da CE. A Tabela 1 demonstra que a maior atividade indutora de tumor era inerente às células de CD44 + fração. Na verdade, depois de administrar 3x10 6 CD44 + células (grupo 2.1), um número absoluto de células no PC foi 23 vezes maior do que após o da população total de células EC (grupo 1.1), e 105 vezes mais do que quando CD44 - fração foi administrada (Grupo 3.1).
Com isso, foram encontradas mudanças não apenas quantitativas, mas também qualitativas nas composições de um tumor em desenvolvimento. A fração de CD44 + formou a ascite com um conteúdo predominante de CD44 + células, ou seja, CD44 alto , CD44 + CD24 - e CD44 + CD24 + células. Além disso, a concentração de CD44 alta células foi 2 vezes maior se comparado ao grupo 1.1 e 16 vezes maior no grupo 3.1. A fração de CD44 - , em contraste, formou um tumor que continha células mais maduras, ou seja, aquelas com CD44 - CD24 + fenótipo. A própria redistribuição da composição da subpopulação de células no grupo 3.1 aparentemente determinou o conteúdo absoluto mínimo de células no PC.
Importante é o fato estabelecido da presença entre as células EC de uma subpopulação com um CD117 + marcador. A molécula de CD117 é um receptor transmembrana de tirosina quinase. Em condições normais, é ativado pelo ligante correspondente, ou seja, fator de crescimento de células-tronco (SCGF) [29]. Na patologia oncológica ocorre a ativação dependente de ligandona do receptor c-KIT, que na maioria das vezes (até 92% dos casos) é uma consequência da mutação do oncogene c-kit ou é causada por um mecanismo desordenado de regulação da função deste receptor [30].
Considerando CD117 + células como as células do microambiente tumoral o fato estabelecido da dependência da intensidade de crescimento do tumor na presença ou ausência de CD117 + células e suas relações de concentração com CD44 high células é lógica. Como mostra a Tabela 1, ao iniciar a CE pela introdução da população total de células (grupo 1.1.) No PC, foram formadas 34,80 ± 1,27 × 10 7 células no CD44 alto / CD117 + razão, que era igual a 0,02 unidades relativas.
Potencial tumorigênico de CD44 - a fração foi 4 vezes menor (grupo 3.1) que se manifestou por um CD44 alto reduzido / CD117 + razão na mesma medida (4 vezes) se comparado com o grupo 1.1. Esta mudança em CD44 alta / CD117 + índice foi principalmente devido a uma diminuição no CD44 alto concentração (em 8,5 vezes) no fundo do conteúdo reduzido de CD117 + células (em 2 vezes) também.
Ao avaliar a intensidade do crescimento da ascite, gerado por CD44 + fração, um aumento significativo no número total de células em PC (quase 24 vezes se comparado ao grupo 1.1) foi observado. Além disso, um importante é o excesso em duas vezes de CD44 alto concentração e falta de CD117 + células. No material inicial do CD44 + fração (antes da cultura) de acordo com a análise de citometria de fluxo dos dados, o conteúdo de CD44 alto células foi 15 vezes maior do que na população total de células EC (dados não apresentados).
Para resumir o mencionado acima, podemos argumentar que um papel crucial na iniciação da CE é desempenhado por CSCs com uma alta taxa de expressão do marcador CD44 (CD44 alto ), enquanto uma das funções mais importantes do CD117 + subpopulação é uma regulação ("restrição") da atividade tumorigênica de CD44 alto células. A ausência de CD117 + células (grupo 2.1) parecem multiplicar o potencial proliferativo e de diferenciação de todo o pool de CD44 + células, causando um aumento significativo no número total de células no PC.
A análise do potencial proliferativo de um pool total de células EC e CD44 + facção favorece esta interpretação. É mostrado que o fator de multiplicação (MF) na população geral cultivada no CP no grupo 2.1. durante 7 dias aumentou quase em 24 vezes se comparado com o grupo 1.1. Isto foi acompanhado por uma diminuição no tempo celular dobrando de 24,47 ± 2,75 h no grupo 1,1-14,70 ± 1,35 no grupo 2.1 que pode caracterizar uma população de células ascíticas cultivadas a partir de CD44 + fração, como uma de proliferação mais ativa (Tabela 1).
Para provar a função especial de CD44 + células na iniciação e manutenção do tumor quando administrado EC mesmo em doses mínimas, era de interesse avaliar comparativamente a capacidade tumorigênica do CD44 + isolado e CD44 - fracções quando administradas em várias concentrações. Foi descoberto que após a introdução de 3 × 10 6 células da população total de EC, o crescimento do tumor foi observado em 100% dos animais (10/10) (Tabela 2). Reduzindo 10 vezes a dose de células administradas (3 × 10 5 ) resultou em uma diminuição proporcional no número absoluto de células no PC, tumor desenvolvido apenas em 50% dos animais (Tabela 2). Reducing the administered dose of total EC population of cells down to 3 × 10 4 did not lead to tumor formation in the PC.
Initiations of EC by introducing of CD44 + cells at concentrations of 3 × 10 6 and 3 × 10 5 cells per animal resulted in almost 100% tumor development for both cases. Herewith, tumorigenic potential of CD44 + fraction exceeded that of total population of EC cells administered in the same doses (in 23 and 21 times, respectively). Moreover, introduction of 3 × 10 4 cells of CD44 + fraction caused a tumor formation in 33% of animals, while total population of EC cells used in the same dose, did not cause the formation of ascites. With the introduction of 3 × 10 3 cells of CD44 + fraction, no animals with the developed EC have been identified.
Fraction of CD44 – cells just in a dose of 3 × 10 6 was capable of forming tumors in 50% of animals, the number of cells in the PC in this case was 4.5 times less than when introducing the total population and in 105.9 times less than when inducing by CD44 + fraction. Thus, the results of this part of research suggest that CSCs are mainly present in the pool of cells with CD44 + phenotype. This emphasizes the importance of this subpopulation of cells in initiation and development of EC.
As noted above, identification and inactivation of CSCs is a major theoretical and practical issue of oncology. On this basis, the next task of our study was to investigate the impact of hybrid nanocomplexes designed at the Institute for Scintillation Materials of National Academy of Sciences of Ukraine on the tumorigenic activity of EC cells.
As Table 3 demonstrates an incubation of EC cells with only NPs as a component of hybrid nanocomplexes (option 1) decreased the concentration of CD44 high virtually twice if compared to the control and 5 times the content CD44 + CD24 – cells in ascites formed in vivo. The number in it of more differentiated CD44 + CD24 + , CD44 – CD24 + cells remained practically unchanged if compared to the control. In this group, there was established reduction of CD117 + cells (35%) at a slightly changed content of Sca-1 + subpopulation. Based on the data, the inhibition rate of EC growth (59.41 ± 3.45%) in variant 1 was accompanied by a twofold decrease in the concentrations of CD44 high cells in comparison with the control that was also reflected in the reduction of CD44 high /CD117 + ratio (Table. 3).
Pretreatment of EC cells with hybrid nanocomplexes (option 2) reduced almost 10 times the concentration of CD44 high and CD44 + CD24 – cells in the developed ascites if compared to the control (Table 3). It should be noted that the concentration of more differentiated CD44 + CD24 + and CD44 – CD24 + cells after this treatment increased slightly if compared to the control. The redistribution pattern of EC subpopulation composition in this option was accompanied with a pronounced enhancement of tumor growth inhibition compared to option 1 (74.70 ± 4.38 and 59.41 ± 3.45%, respectively, P < 0.05) that underlined the importance of cholesterol as a targeted compound of antitumor therapy. Pretreatment with hybrid nanocomplexes (option 2) led to maximal reduction there was found a maximum reduction of CD44 high /CD117 + ratio (10 times) as compared with option 1, that again confirmed a specific role of ratio of these cell subpopulations in the EC growth.
For all the types of EC pretreatment, the reduction of CD44 high /CD117 + ratio was accompanied by a decrease in tumor growth rate and increased survival of animals to day 20 of EC development (Fig. 3).
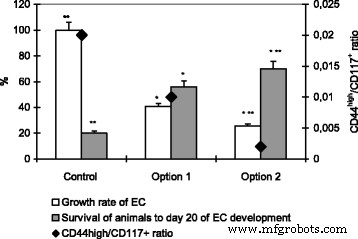
Tumor growth rate of EC, survival of animals and CD44 high /CD117 + ratio after incubation with nanocomplexes. Note:differences are statistically significant as compared with administration of the control (*), option 1 (**) (P < 0.05)
Discussion
One of the tasks of current oncology is elucidation of the mechanisms of initiation and development of malignant neoplasms. Mandatory participants in these events are the CSCs and so-called accessory-regulatory cells of tumor microenvironment. The variety of functional and structural characteristics of the CSCs in the development of different types of tumors determines the need for their further study. This is facilitated by the expansion of experimental model systems. One of them is the transplantable line of tumor cells of EC.
The elucidation of the peculiarities of this experimental model development, the subpopulation composition of tumor and tumorigenic potential of individual cell populations within the general pool of the EC cells will facilitate the development of new approaches to cancer therapy.
Using the method of phenotypic evaluation of progenitor cells of various levels of differentiation in the tumor focus makes it possible the identifying the stages, dynamics of development and invasiveness of the process. The established fact of heterogeneity of the EC subpopulation composition is important and there has been emphasized the value of CD44 + subpopulation in maintaining the growth of this type of tumor.
The most important role in implementing a tumorigenesis is played by an expression rate of the molecule. Indeed, in contrast to leukocytes for adhesion of those normally a low expression rate of CD44 receptor is required, triggering and self-maintenance in CSCs are implemented its much greater density on a cell surface [31].
It is known that CD44-glycoprotein is a hyaluronic acid (HA) receptor, a main component of extracellular matrix. The emerging set of HA-CD44 activates many receptor tyrosine kinases, resulting in activation of PI3K/Akt/ mTOR way [32, 33], which plays the role of a single universal signal transmission mechanism to the translation apparatus and is responsible for the integration of proliferative stimuli.
Among two known CD44-isoforms in normal hematopoietic cells its standard isoform (CD44s) is predominantly expressed [34]. In most malignant tissues there were detected both CD44s and variable isoforms of CD44- molecule (CD44v), resulting from alternative splicing of exons 6-15. Namely alternative splicing leads to a lengthening of CD44-extracellular domain, promoting its greater interaction with HA and tumor metastasis [35]. Due to that the role of CD44 high cells in triggering and maintaining the tumorogenesis is clear. It was previously found that a minor subpopulation of CD44 high cells had a high proliferative potential and played a critical role in EC developing [20].
In this paper, a special role of CD44 + -cells of the EC in initiation and maintenance of the tumor process in the EC under administration even in minimal doses has been shown. CD44 + cells were able to form a tumor even at a cell concentration of 100 times lower (10 4 cells/ mouse) if compared with the introduction of a total EC population (10 6 cells / mouse). The belonging of tumor cells to the CD44 + fraction was also confirmed by the fact that the EC initiation by the fraction of CD44-cells even at a dose of 10 6 cells / mouse caused the formation of a tumor only in 50% of cases, with an absolute number of cells in the PC 5 times less than in under introduction of a similar amount of the total population of EC and more than 100 times less than after the introduced CD44 + -fraction.
This is in accordance with the data of Shipitsin M et al. has shown that CD44 + and CD24 + cells in breast cancer development there are cell populations with different genetic profiles [36]. The research performed by Shipitsin M CD24 + cells have been noted to be more differentiated, while more progenitor-like functions are inherent to CD44 + células. The research performed by Shipitsin M CD24 + cells have been noted to be more differentiated, while more progenitor-like functions are inherent to CD44 + células. The authors suggest that CD24 + cells can be derived from CD44 + cells [36]. Fillmore C. and Kuperwasser C. supposed that CD24 + population was mainly characterized by less differentiated basal type of breast cancer, and CD44 + cells caused the development of luminal form of breast cancer, being more differentiated type of tumor [37].
Analyzing the patterns of tumor development, the classic hypothesis of «seed and soil» looks very actual [38], which postulated that an appropriate microenvironment (soil) is required for optimal growth of tumor cells (CSCs).
Most often the carcinoma-associated fibroblasts (CAFs) act as a tumor stroma in breast cancer and pancreatic cancer [39]. It has been shown that the CAFs, derived from invasive forms of human breast carcinomas, activated much stronger the growth of human breast cancer cell line MCF-7-Ras when administered to immunodeficient mice if compared with normal fibroblasts [9]. This function is implemented by the microenvironment cells due to the secretion by them of cytokines, chemokines and growth factors [10, 40].
Although so far the phenotypic identification of the microenvironment cells for various types of tumor has remained a subject of debate, most often used for this purpose the surface markers of primitive hematopoietic and endothelial cells, including c-kit (CD 117), CD133, VE-cadherin, VEGFR-2 and endoglin are used [41]. In this experimental model the most probable candidate to the role of tumor microenvironment cells is CD 117 + .
It is known that the c-KIT receptor (CD117 + ) is highly expressed in normal epithelium of the breast and progressively decreases with the development of breast carcinoma in situ and is almost completely lost in invasive breast cancer [42, 43]. Some authors proposed this kind of change in the expression rate of this marker as a possible test to assess the effectiveness of antitumor therapy [44].
Previously, after analysis of the significance of the content ratios for different subpopulations of EC cells when maintaining tumor growth, we proposed to use the CD44 high /CD117 + ratio as a prognostic criterion of tumor development [22].
Adequacy of using this index is confirmed in this study using the applied nanocomposites as therapeutic agents when treating the EC. The inhibition rate of EC growth (59.41 ± 3.45%) when treated with spherical NPs (option 1) was accompanied by a 2-fold decrease if compared to the control in the CD44 high -cell concentration, which was reflected in the reduced CD44 high / CD117 + índice. The maximum decrease in the CD44 high /CD117 + index (10 times if compared to option 1) was established using the hybrid nanocomplexes for a pre-treatment of EC cells. Thus, many cells of a total pool of EC, but primarily those with the phenotype CD44 high and CD117 + , can be the target of the effect of the studied nanocomplexes (both direct and indirect). A significant decrease in their concentrations in the growing pool of EC after pretreatment with hybrid nanocomplexes clearly coincides with a reduced intensity of tumor growth.
Judging by the decrease in the amount of CD44 high as the most potent CSCs forming the entire subsequent series of advanced tumor cells, the main component in manifestation of antitumor effect of the synthesized hybrid nanocomplexes is spherical NPs. Introduction of cholesterol having affinity to tumor cell membranes into composition of hybrid nanocomplexes enhanced an inhibitory activity of NPs. Similar data were obtained by Betker J.L. et al. after analysis of the structure and functioning principles of the membranes of tumor cells. The authors concluded that the incorporation of cholesterol into membranes of tumor cells could be a prerequisite for a targeted delivery of liposomes with therapeutic agents directly into a cell.
Thus, the importance of cooperative interactions of cells with different phenotypic signs in maintaining the EC growth has been proven. The cells with the CD44 high phenotype being the part of the population of CD44 + CD24 – can be considered as CSCs in this model system. The use of new forms of nanocomposites that are capable to bind to CSCs and induce tumor destruction as the EC is a promising direction the treatment of oncopathology.
Conclusions
- 1.
On the base of the findings of phenotypic assessment and functional potential studies, the Ehrlich carcinoma is a heterogeneous population of tumor cells of varying differentiation extent referred to high and less potent tumor-inducing precursors, as well as the cells composing their microenvironment.
- 2.
A high (tenfold) tumorigenic activity of the EC CD44 + cells if compared to CD44 – cells was proven. In this pair of comparison, the CD44 + cells had a higher potential of generating in PC of CD44 high , CD44 + CD24 – , CD44 + CD24 + cell subpopulations, highlighting the presence of CSCs in a pool of CD44 + células.
- 3.
There was found an ability of the synthesized nanocomplexes based on rare earth orthovanadates and cholesterol to inhibit the growth of CD44 + cell pool (CD44 high , CD44 + CD24 – , CD44 + CD24 + ) that was accompanied by a reduced intensity of EC growth (by 75%) and increased survival of the animal with tumors (in 3.5 times) in comparison with the control.
- 4.
It has been shown that the reduction in tumor growth rate after pretreatment with hybrid nanocomplexes was accompanied with a change in the composition of EC subpopulation that was reflected in a decrease in the CD44 high /CD117 + ratio. This ratio can be offered as one of diagnostic and prognostic tests of the severity and extent of oncology inactivation.
Abreviações
- BC:
-
Breast cancer
- CAFs:
-
Carcinoma-associated fibroblasts
- CSCs:
-
Cancer stem cells
- DiI:
-
1,1′-Dioctadecyl-3,3,3′,3′-tetramethylindocarbocyanine perchlorate
- EC:
-
Ehrlich carcinoma
- HA:
-
Hyaluronic acid
- MF:
-
Multiplicity factor
- NOD/SCID mice:
-
Nonobese diabetic-severe combined immunodeficiency mice
- NPs:
-
Nanoparticles
- PC:
-
Peritoneal cavity
- Rg:
-
Growth rate of EC
- Ri:
-
Inhibition rate of EC growth
- SCID mice:
-
Severe combined immunodeficiency mice
- TD:
-
Time doubling
Nanomateriais
- Baterias para fins especiais
- Sangue Artificial
- Célula solar
- Nano árvores para células solares sensibilizadas com corante
- Células solares de grafeno de alta eficiência
- Nano-heterojunções para células solares
- Demonstração de um biossensor flexível à base de grafeno para detecção sensível e rápida de células cancerosas do ovário
- Nanopartículas para terapia do câncer:progresso e desafios atuais
- Administração de medicamentos baseados em células para solicitações de câncer
- O que é uma parede de tronco?



