Nanopartículas de oxo-hidróxido de cobre dopado com ligante são antimicrobianos eficazes
Resumo
A resistência bacteriana às terapias antimicrobianas é um problema clínico crescente. Isso é verdadeiro tanto para aplicações tópicas quanto para terapia sistêmica. Topicamente, os íons de cobre podem ser antimicrobianos eficazes e baratos que atuam por meio de várias vias, limitando assim as oportunidades de resistência das bactérias. No entanto, a química do cobre não se presta a formulações fáceis que liberarão prontamente íons de cobre em pHs biologicamente compatíveis. Aqui, desenvolvemos tartarato de adipato de hidróxido de cobre nanoparticulado (CHAT) como um material barato, seguro e prontamente sintetizado que deve permitir a liberação de íon de cobre antimicrobiano em um ambiente de ferida infectado.
Primeiro, sintetizamos o CHAT e mostramos que ele tinha tamanhos de partículas dispersas de 2–5 nm e um potencial zeta médio de - 40 mV. Em seguida, quando diluído em meio bacteriano, o CHAT demonstrou eficácia semelhante ao cloreto de cobre contra Escherichia coli e Staphylococcus aureus , com atividade dependente da dose ocorrendo principalmente em torno de 12,5–50 mg / L de cobre. De fato, nesses níveis, o CHAT se dissolveu muito rapidamente e, como confirmado por um biossensor de cobre bacteriano, mostrou carga intracelular idêntica para íons de cobre derivados do cloreto de cobre. No entanto, quando formulado a 250 mg / L em uma matriz aplicada topicamente, ou seja, hidroxietil celulose, o benefício do CHAT sobre o cloreto de cobre era aparente. O primeiro rendeu liberação sustentada rápida de cobre dentro da faixa bactericida, mas o cloreto de cobre, que formou precipitados insolúveis em tal concentração e pH, alcançou uma liberação máxima de 10 ± 7 mg / L de cobre em 24 h.
Nós fornecemos uma formulação prática para terapia antimicrobiana à base de cobre. Novos estudos, especialmente in vivo, são merecidos.
Histórico
As infecções microbianas contribuem para milhões de mortes em todo o mundo [1]. Freqüentemente, a ineficiência de um tratamento antimicrobiano é devido à resistência microbiana aos antibióticos convencionais [2,3,4,5]. Como tal, novos antimicrobianos são avidamente procurados. O cobre tem sido reconhecido por seus efeitos antimicrobianos e pode ter o potencial para maior longevidade clínica do que os antibióticos padrão, uma vez que parece agir por meio de uma multiplicidade de mecanismos contra bactérias, incluindo interação com proteínas bacterianas e DNA, produção de espécies reativas de oxigênio (ROS) , e rompimento da integridade da membrana [6, 7]. Pelo mesmo motivo, sugere-se que o potencial de resistência antimicrobiana de cepas bacterianas patogênicas ao cobre e outros metais é limitado [7,8,9]. Além disso, o cobre é relativamente barato e de baixa toxicidade para os humanos, uma vez que sua essencialidade em níveis de traço garantiu a evolução de um controle homeostático rígido [10,11,12]. Há, portanto, o uso comum deste metal para medidas preventivas de infecção, principalmente para evitar a formação de biofilme bacteriano em superfícies em áreas de alto risco, como hospitais e lares de idosos [13, 14]. Em contraste, o cobre não encontrou uso terapêutico significativo em formulações de antimicrobianos tópicos, ao contrário da prata, que é amplamente utilizada [15].
As bactérias são suscetíveis ao carregamento de cobre em seu ambiente intracelular, e a eficácia de uma fonte de cobre está relacionada à sua capacidade de liberar íons de cobre [16, 17]. A este respeito, um desafio significativo para antimicrobianos à base de cobre é a obtenção de uma formulação concentrada que permite a liberação sustentada de cobre antimicrobiano em concentrações eficazes em fluidos, como exsudato de feridas. Isso ocorre porque o cobre é um íon de metal hidrolítico e conforme sua concentração aumenta no pH de formulações tópicas típicas (isto é, quase neutro), o mesmo acontece com sua tendência para induzir hidrólise e formar oxo-hidróxidos insolúveis [18]. Em pHs fisiológicos, esses oxo-hidróxidos não são bons substratos para a liberação de íons de cobre solúveis ou, portanto, potencialmente eficazes [16, 19, 20].
Recentemente, com o objetivo de encontrar um suplemento de ferro biodisponível, a questão da liberação efetiva de íons férricos de uma fonte concentrada de oxo-hidróxido em condições fisiológicas foi resolvida através da modificação estrutural das partículas primárias. Nesse trabalho, o ferro foi precipitado na presença de ligantes GRAS de dopagem de cristal, nomeadamente os ácidos adípico e tartárico, para desestabilizar propositadamente a estrutura final do oxo-hidróxido férrico. Esta estratégia tinha a vantagem de (a) prevenir a aglomeração irreversível das partículas de oxo-hidróxido férrico e (b) aumentar muito a sua labilidade (facilidade de solubilidade) em condições fisiológicas apropriadas. Este material foi denominado “tartarato de adipato de ferro [oxo] hidróxido” ou IHAT [21, 22]. Por analogia, consideramos aqui se o tartarato de adipato de cobre [oxo-] hidróxido (CHAT) poderia ser sintetizado e formulado em altas concentrações, mas ainda liberar íons de cobre em níveis antimicrobianos eficazes. Em particular, o objetivo deste trabalho foi desenvolver um processo sintético barato e escalonável que produz nanopartículas de oxo-hidróxido de cobre que, ao contrário de materiais relatados anteriormente, devem liberar prontamente concentrações biocidas de íons de cobre em um ambiente de ferida simulada.
Assim, neste estudo, sintetizamos CHAT e caracterizamos sua capacidade de entregar cobre biodisponível e, portanto, demonstrar atividade antimicrobiana. Nós nos concentramos em cepas de Escherichia coli como espécies "indicadoras" para bactérias Gram-negativas [19, 23], mas também demonstraram efeitos de prova de princípio contra Staphylococcus aureus , como bactérias Gram-positivas que frequentemente obtêm resistência a múltiplas drogas. Portanto, o estudo teve como objetivo avaliar o valor de desenvolver ainda mais o CHAT para aplicações clínicas na terapia antimicrobiana tópica.
Métodos
Salvo indicação em contrário, todos os experimentos foram realizados usando água de pureza ultra-alta (UHP) (purificação por osmose reversa; 18,2 ΩM / cm), à temperatura ambiente (20 ± 2 ° C), e todos os reagentes foram adquiridos da Sigma Aldrich.
Formulações de cobre e nanopartículas de CHAT
Os estoques de cloreto de cobre (cobre 40 mM) foram preparados pela dissolução de CuCl 2 · 2H 2 O na água. Os estoques de nanopartículas de óxido de cobre (CuO NPs; Sigma 544868) foram preparados a partir de um pó comercial que estava livre de impurezas, tinha um tamanho de partícula primária de 34 nm (intervalo de 10-50 nm) e foi testado anteriormente como um agente antimicrobiano [24, 25,26]. Esses estoques foram preparados a 1,3 g / L de cobre, dispersando o pó em água com agitação vigorosa. Suspensões coloidais de nanopartículas de CHAT foram sintetizadas usando um método de co-precipitação [27]. Resumidamente, cloreto de cobre, ácido tartárico e ácido adípico foram dissolvidos em água para atingir uma razão molar de cobre / ácido tartárico / ácido adípico na suspensão final de 2:1:1 e uma concentração de cobre de 2,5 g / L. O pH inicial da mistura foi sempre inferior a 2,5 e o cobre foi totalmente solubilizado. O pH foi então lentamente aumentado por uma adição gota a gota de uma solução concentrada de NaOH (5 M) com agitação constante até pH 8,2 ± 0,2.
Conteúdo de cobre e distribuição de fases das suspensões de CHAT
O teor de cobre em suspensões coloidais foi determinado por espectrometria de emissão óptica de plasma acoplado indutivamente (ICP-OES, Jobin Yvon 2000, Horiba). Todas as amostras foram diluídas até concentrações abaixo de 100 mg / L em 5% HNO 3 ( v / v ) pelo menos 24 horas antes da análise para garantir a solubilidade total do cobre. Os padrões de calibração (0,1 a 100 mg / L de cobre) foram combinados com a matriz em 5% HNO 3 , e a quantificação de cobre foi realizada a 324,754 nm. O fracionamento do cobre em porcentagens de cobre aglomerado, nanoparticulado e solúvel foi obtido por filtração e ultrafiltração de estoques de CHAT. As suspensões foram filtradas (cut-off de 200 nm), e o retentado foi considerado como a fração aglomerada. Para isolar o cobre solúvel e diferenciá-lo do cobre nanoparticulado, a suspensão coloidal foi ultrafiltrada através de um filtro 3-KDa (Sartorius Vivaspin 500 VS0192; 16.000 × g , 5 min), pois isso corresponde a um corte abaixo de 1 nm (Zetasizer Software 7.11, Malvern Instruments Ltd). O teor de cobre de todas as frações (total, filtrado de 200 nm, ultrafiltrado de 3 KDa) foi determinado por ICP-OES, e as frações expressas como porcentagem em relação ao teor total de cobre são as seguintes:
$$ {\ displaystyle \ begin {array} {l} \% \ mathrm {Solúvel} \ \ mathrm {Cobre} \ \ left (<1 \ mathrm {nm} \ right) \% \ kern0.5em =\ frac { \ kern0.5em {Cu} _ {3 \ mathrm {KDa}}} {Cu _ {\ mathrm {Total}}} \ times 100 \\ {} \% \ mathrm {Aglomerado} \ \ mathrm {Cobre} =\ frac {\ {Cu} _ {\ mathrm {Total}} - {Cu} _ {<200 \ mathrm {nm}} \ kern0.5em} {Cu _ {\ mathrm {Total}}} \ kern0.5em \ times 100 \ \ {} \% \ mathrm {Nanoparticulado} \ kern0.5em \ mathrm {Cobre} \ kern0.5em =100 - \% \ mathrm {Aglomerado} \ \ mathrm {cobre} - \% \ mathrm {Solúvel} \ \ mathrm {cobre} \ end {array}} $$
Determinação do conteúdo de cobre e proporções de cobre para ligante em nanopartículas CHAT secas
Nanopartículas de CHAT foram aglomeradas e precipitadas para permitir a recuperação e remoção de componentes não ligados. Para permitir isso, o etanol foi adicionado a suspensões coloidais de CHAT (2,5 g / L de cobre) a uma razão de 2:1 etanol / suspensão ( v / v ), e os aglomerados de CHAT resultantes foram recuperados por centrifugação (4500 × g × 15 min em um Mistral 6000). A fase de solução, contendo espécies de ligantes não ligadas, foi descartada. A determinação do teor de cobre em CHAT em fase sólida foi como segue. Um pó foi produzido por secagem em forno do pellet precipitado etanólico até peso constante a 45 ° C. Este foi então moído e 35,2 ± 0,3 mg ( n =2) foi digerido em 11 ± 1 g de HNO 70% 3 , com pesos precisos registrados. Depois de totalmente digerida, esta solução foi diluída 20 vezes em água e a concentração de cobre determinada por ICP-OES. As proporções de ligando para cobre foram determinadas diretamente a partir de aglomerados de CHAT precipitados com etanol, secos. Os aglomerados foram primeiro ressuspensos em água ao seu volume original para facilitar a dissolução com menores quantidades de HCl - um requisito para análise por cromatografia líquida de alto desempenho (HPLC). As alíquotas foram dissolvidas em 5% HNO 3 para análise ICP-OES de cobre (como descrito acima) ou em HCl 80 mM para análise de HPLC de ligantes (ácidos tartárico e adípico). A análise do ligante foi realizada em um sistema de cromatografia de fase reversa padrão (coluna C18 em um Waters Alliance 2690/5 equipado com um detector 2998 PDA; mais detalhes são fornecidos no arquivo adicional 1).
Caracterização físico-química de suspensões de CHAT
A distribuição hidrodinâmica do tamanho das partículas foi determinada por dispersão dinâmica de luz (DLS; Zetasizer NanoZS, Malvern Instruments Ltd). Alíquotas de suspensões coloidais de CHAT (2,5 g / L de cobre) foram transferidas para uma cubeta descartável de 1 mL, e as medições ( n =3) foram realizadas a 25 ± 2 ° C. Novamente, as configurações exatas são mostradas no arquivo adicional 2. O potencial zeta das suspensões de CHAT foi determinado por microeletroforese Doppler a laser (Zetasizer NanoZS, Malvern Instruments Ltd) usando células capilares dobradas descartáveis (DTS1070) e assumindo uma constante dielétrica de 78,5 e uma viscosidade de 0,89 cP. A caracterização por microscopia eletrônica de transmissão (TEM) foi realizada aplicando uma gota de suspensão de CHAT em grades perfuradas de carbono holey e secando a 50 ° C durante a noite. As grades foram então fotografadas no TEM (FEI-Philips CM100) a 120 kV no modo de campo claro.
Atividade antimicrobiana das formulações de cobre
Os ensaios foram realizados em meio MOPS de metal pesado (HMM), um meio compatível com íons de metal reconhecido (arquivo adicional 3), que foi suplementado com 0,4% de glicose e 0,1% de hidrolisado de ácido caseína, e pH ajustado para 7,2 ± 0,2 [28] . Antes da adição de compostos de cobre, Escherichia coli (NCTC11100) e Staphylococcus aureus RN4220 [29] foram cultivados durante a noite a 30 ° C sob agitação constante em uma incubadora Infors HT Minitron a 80 rpm. Posteriormente, as suspensões bacterianas foram diluídas para uma densidade óptica de 0,05-0,1 (ca. 10 6 células / mL) a 595 nm para E. coli ( Multiskan RC 351 Labsystem) ou 600 nm para S. aureus (Leitor de placas Multiskan, ThermoFisher Scientific). Em seguida, estoques de cloreto de cobre e CHAT coloidal foram diluídos em HMM e adicionados às suspensões bacterianas para obter concentrações finais de cobre entre 0,4 e 100 mg / L. A incubação, então, ocorreu por um período de 6 a 9 h, e o crescimento bacteriano foi determinado pelo monitoramento da densidade óptica como uma medida da biomassa bacteriana.
A solubilidade do cobre ao longo do tempo em meio de crescimento bacteriano foi determinada diluindo os estoques de cloreto de cobre e CHAT coloidal em HMM para 12,5, 25 e 50 mg / L de cobre e determinando a fração de cobre solúvel em 0, 2, 4 e 8 h por ultrafiltração (3 KDa) e análise de ICP-OES, conforme descrito acima.
Biodisponibilidade intracelular de formulações de cobre
Bactéria bioluminescente com detecção de Cu recombinante, E. coli MC1061 (pSLcueR / pDNPcopAlux), que respondem a quantidades sub-tóxicas de cobre biodisponível aumentando sua bioluminescência, foram usados para quantificar a biodisponibilidade de compostos de cobre [30]. As suspensões bacterianas foram preparadas conforme descrito para o ensaio de atividade antimicrobiana e incubadas com uma série de diluições de cloreto de cobre e CHAT (0 a 50 mg / L de cobre) em microplacas de 96 poços por 4 h. A bioluminescência foi medida com um Orion II Plate Luminometer (Berthold Detection Systems), e a indução de bioluminescência foi calculada da seguinte forma:
$$ Bioluminescência \ em dução, Dobra \ Mudança =\ frac {Bioluminescência \ em \ Cu \ exposição} {Bioluminescência \ mathrm {ce} \ sem \ Cu \} $$
Estresse intracelular induzido por formulações de cobre
A capacidade dos compostos de cobre para induzir ânions superóxido intracelular e quebras de DNA de fita simples foi avaliada com bactérias bioluminescentes recombinantes, E. coli K12 ::soxRSsodAlux e E. coli MC1061 (pDEWrecAlux), respectivamente [17]. As culturas bacterianas foram preparadas conforme descrito para o ensaio antimicrobiano, e as bactérias foram expostas a uma série de diluições de cloreto de cobre e CHAT (0 a 50 mg / L de cobre) em microplacas brancas de 96 poços durante 4 h. Os desempenhos dos biossensores foram controlados pela exposição de bactérias à menadiona química indutora de ânion superóxido (0,04–30 μg / L) ou ao peróxido de hidrogênio (0,1–150 mg / L), como controles positivos para E. coli K12 ::soxRSsodAlux ou E. coli MC1061 (pDEWrecAlux), respectivamente. Mais uma vez, as bactérias foram incubadas em microplacas brancas de 96 poços e a bioluminescência foi medida com um Orion II Plate Luminometer e a indução da bioluminescência foi calculada como na Eq. 5
Incorporação de Formulações de Cobre em Géis de Hidroxietilcelulose
Os estoques de cloreto de cobre, CHAT e nanopartículas de óxido de cobre não modificadas (CuO NPs) comerciais foram diluídos em água UHP para 250 mg / L de cobre. As suspensões resultantes de CHAT e CuO NPs estavam perto de pH neutro e podiam ser incorporadas diretamente no gel, mas a solução de cloreto de cobre ainda era ácida após a diluição e foi, portanto, ajustada para pH 7,0 ± 0,2. Hidroxietilcelulose (HEC) foi então dissolvida diretamente (2% w / v ) em vários estoques diluídos usando um misturador de rolo (Denley Spiramix 5) até a formação de géis homogêneos. Dez gramas de cada gel foram transferidos para tubos Falcon e deixados em repouso durante a noite. Em seguida, 10 mL de tampão de bicarbonato de sódio 50 mM recém-preparado (dissolvido de NaHCO 3 pó e ajustado para pH 7,0 ± 0,2) foi transferido para cada tubo com cuidado para minimizar perturbações na interface gel-líquido (área de superfície específica de 7,1 cm 2 ) As alíquotas foram então coletadas e analisadas por ICP-OES para determinar a liberação de cobre ao longo do tempo.
Resultados
Conforme descrito na seção "Métodos", o CHAT foi sintetizado de forma semelhante ao seu análogo de ferro, IHAT [21, 22], por dopagem de oxo-hidróxido de cobre (2,5 g / L de cobre) com ácidos tartárico e adípico. Isso produziu suspensões coloidais estáveis nas quais todo o cobre passou por um filtro de 200 nm, mas muito pouco (5%) passou por um filtro de 3-KDa. Isso indicou que a maior parte do cobre era nanoparticulada (95%; Fig. 1a) com pouco cobre "livre" e nenhum grande aglomerado detectável - novamente como o análogo IHAT [21, 22]. Quando precipitado em etanol, para remover espécies de ligantes não ligadas e, em seguida, seco, CHAT continha 31 ± 1% de cobre ( w / w ) por análise ICP-OES. As razões molares de cobre para ligante, as últimas determinadas por HPLC, foram 2:1 para cobre para tartarato e 2:0,3 para cobre para adipar. As partículas de CHAT pareceram quase monodispersas com diâmetros de 2–3 nm por imagem TEM (Fig. 1b). Esses achados foram consistentes com os dados de dimensionamento hidrodinâmico para CHAT mais uma concha de hidratação, uma vez que o diâmetro médio por volume na água UHP foi de 3,4 nm (Fig. 1c) e a distribuição de tamanho foi estreita (2,4-5,6 nm para 80% do volume) quando avaliado com espalhamento de luz dinâmico. O potencial zeta médio era - 39 mV (Fig. 1d), consistente com as nanopartículas que formam uma dispersão aquosa estável [27] e, de fato, a suspensão de estoque de CHAT mostrou-se estável por vários anos (arquivo adicional 4).
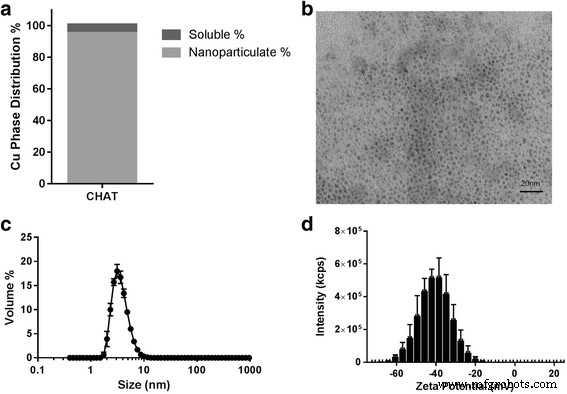
Caracterização da solução estoque de CHAT. a Distribuição da fase de cobre a 2,5 g / L CHAT:solúvel (<3 KDa) e porcentagem de nanopartículas. b Imagens de dispersão de nanopartículas por TEM. c Distribuição de tamanho de partícula hidrodinâmica de partículas recém-preparadas, conforme determinado por espalhamento de luz dinâmico. d Distribuição potencial Zeta ( n =3; barras de erro representam desvios padrão)
Em seguida, consideramos a atividade antimicrobiana do CHAT quando as suspensões de estoque foram diluídas em meio de crescimento bacteriano para concentrações associadas à atividade antimicrobiana dos sais de cobre. Para CHAT e cloreto de cobre, a curva de inibição de crescimento foi muito semelhante para ambos E. coli e S. aureus com a maioria das atividades ocorrendo em concentrações de cobre total entre 12,5 e 50 mg / L (Fig. 2). Completo E. coli a inibição do crescimento foi observada após incubação com 18,8 (CuCl 2 ) e 25 (CHAT) mg / L de cobre, enquanto para S. aureus , a inibição total do crescimento foi obtida em 75 (CuCl 2 ) e 100 (CHAT) mg / L de cobre (Fig. 2; A percentagem de inibição do crescimento vs concentração de cobre é fornecida no arquivo adicional 5).
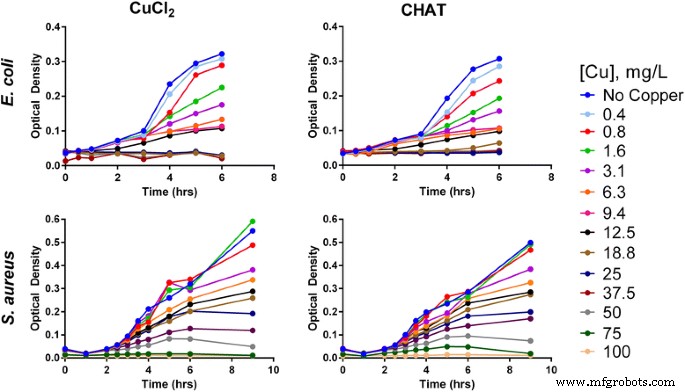
Escherichia coli (topo) e Staphylococcus aureus (abaixo) curvas de crescimento, representadas aqui como densidade óptica, após exposição a diferentes concentrações de cloreto de cobre (esquerda) ou CHAT (direita) em HMM suplementado.
De fato, nessas concentrações antimicrobianas, pelo menos 94% de CHAT foi solubilizado rapidamente (em 15 minutos), novamente conforme avaliado por ultrafiltração e análise de ICP-OES (Fig. 3a). Portanto, antecipamos que a eficácia antimicrobiana do CHAT estava associada a essa labilidade química, com a rápida dissolução das nanopartículas permitindo a aquisição bacteriana intracelular de íons de cobre. Para testar isso, desafiamos o sensor de Cu E. coli , MC1061 (pSLcueR / pDNPcopAlux), em que a bioluminescência aumenta em resposta a concentrações subtóxicas de íons de cobre intracelulares [30], com 0 a 50 mg / L de cobre como CHAT ou cloreto de cobre. O aumento das concentrações no meio de cultura de ambas as fontes de cobre levou ao aumento da bioluminescência no E. coli deformação do sensor de cobre (Fig. 3b), consistente com aumentos no cobre intracelular. O declive da curva de dose-resposta foi idêntico até 6,25 mg / L para ambas as fontes de cobre, confirmando que o cobre biodisponível de CHAT era comparável a uma fonte totalmente solubilizada. Depois disso, em concentrações de até 50 mg / L de cobre, a luminescência não aumentou devido à toxicidade de ambos os compostos de cobre (Fig. 3b).
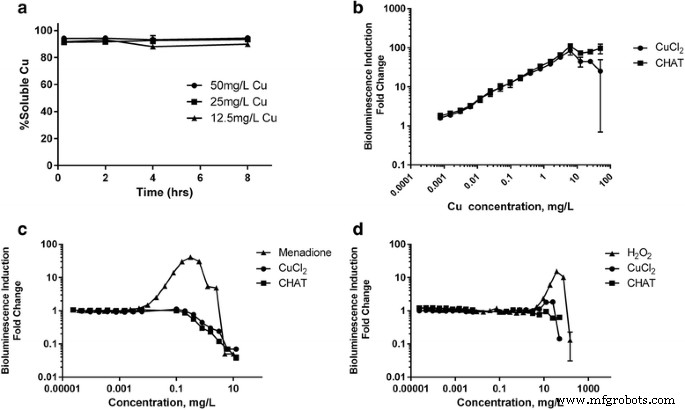
a Perfil de dissolução de CHAT em HMM suplementado a 12,5, 25 e 50 mg / L de cobre. Dose-resposta de indução de bioluminescência de bactérias luminescentes recombinantes: b com resposta a íon de cobre intracelular E. coli Bactéria MC1061 pSLcueR / pDNPcopAlux, c DNA com resposta a danos E. coli MC1061 (pDEWrecAlux) e d com resposta a ânion superóxido E. coli K12 ::soxRSsodAlux após exposição por 4 h em HMM suplementado a cloreto de cobre, CHAT (concentração em mg Cu / L) e respectivos controles (menadiona em c e H 2 O 2 em d )
Paralelamente ao estudo do cobre intracelular em E. coli expostos a soluções preparadas com CHAT ou cloreto de cobre, também testamos a capacidade dessas soluções de desencadear ânions superóxidos intracelulares ou de causar danos ao DNA bacteriano em diferentes E. coli biossensores baseados em Em nenhum dos casos houve um efeito significativamente observável, apesar dos sensores responderem a controles positivos relevantes, ou seja, peróxido de hidrogênio e menadiona, respectivamente (Fig. 3c, d). Tomadas em conjunto, as respostas equivalentes dos três biossensores bacterianos a soluções preparadas a partir de diferentes formas químicas de cobre apoiam fortemente a noção de que, em ambos os casos, as bactérias estavam sendo expostas ao mesmo cobre solúvel, apesar de uma formulação começar como nanoparticulada.
Finalmente, como observado acima, a vantagem do CHAT sobre os sais de cobre solúveis só seria aparente se uma formulação concentrada permitisse que o primeiro retivesse sua labilidade química, ao contrário do último. Usando hidroxietilcelulose (HEC), uma base aquosa comum para formulações tópicas [31,32,33], incorporamos 250 mg / L de cobre como cloreto de cobre, CHAT ou como NPs de CuO comerciais. Quando 10 mL de NaHCO 50 mM 3 tampão, como um exsudato de ferida simplificado, foram adicionados a 10 g de cada um dos géis de HEC com cobre incorporado (ou seja, 2,5 mg de cobre), houve liberação sustentada de cobre da preparação contendo CHAT, para mais de 60 mg / L por 24 h (Fig. 4). Além disso, a liberação foi relativamente rápida, com concentrações antimicrobianas ativas sendo alcançadas em 2–4 h. Em contraste, o cloreto de cobre com pH neutralizado era um substrato pobre para a liberação de cobre, como antecipado por sua tendência a hidrolisar e formar aglomerados de oxo-hidróxidos de cobre, então em 24 h, apenas 10 ± 7 mg / L de cobre havia sido alcançado em solução (Fig. 4). Os NPs de CuO comerciais não produziram nenhuma liberação de cobre discernível (Fig. 4).
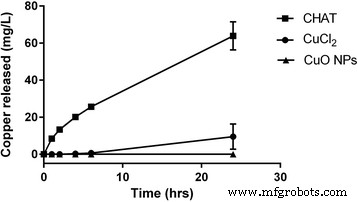
Liberação de cobre de matrizes HEC contendo CHAT, cloreto de cobre ou nanopartículas de óxido de cobre (CuO NPs), todas a 250 mg / L de cobre
Discussão
Mostramos aqui que um nanomaterial à base de cobre, nomeadamente CHAT, pode ser formulado em altas concentrações, ao contrário das nanopartículas à base de cobre descritas anteriormente [34, 35], embora mantendo suas propriedades como uma fonte lábil de cobre biodisponível com eficácia antimicrobiana. Como observado acima, a síntese de CHAT foi inspirada após muitos anos de trabalho anterior no análogo de ferro, IHAT [21, 22]. Este, por sua vez, foi inspirado pela solução da natureza para a rápida renovação mineral in vivo, para a reciclagem eficiente de íons metálicos essenciais, em que as moléculas orgânicas são usadas para desestabilizar a estrutura cristalina das partículas minerais primárias [21, 22]. Nas versões sintéticas, os ligantes GRAS são incorporados aos oxo-hidróxidos metálicos à medida que se formam em solução a partir de polímeros de reticulação [21, 22]. Por meio da desestabilização estrutural, isso garante labilidade da fase mineral final e também gera nanopartículas altamente negativas - conforme demonstrado pela medição do potencial zeta - que repelem a aglomeração e agregação, produzindo suspensões de nanopartículas que permaneceram estáveis por anos. Aqui, e como mostrado anteriormente para IHAT, tartarato foi o ligante dominante na obtenção dessas mudanças físico-químicas na estrutura do oxo-hidróxido de cobre, uma vez que sua incorporação foi de ca. 3 vezes maior do que o adipato - este último se comportando mais como um tampão durante a síntese [21, 22].
Na ausência de modificação, os oxo-hidróxidos metálicos precipitados de fresco irão aglomerar-se e agregar-se e começar a envelhecer, pelo que condensam e aumentam gradualmente a sua cristalinidade. Estas transições de tamanho e fase mineral reduzem a capacidade das estruturas de participar na reação reversa, ou seja, de se dissolver novamente. Não foi, portanto, surpreendente que quando o oxo-hidróxido de cobre foi formado recentemente, a partir da neutralização do pH de uma solução de cloreto de cobre, pelo menos algum cobre solúvel foi liberado em nosso ensaio de liberação de gel (Fig. 4), enquanto que para os NPs CuO comerciais, que foram aglomerado e composto por uma fase mineral mais condensada (ou seja, óxido de cobre), cobre indetectável foi liberado. A falta de dissolução de nanopartículas comerciais de 30 nm - que, independentemente de seu estado de agregação, teriam apresentado uma grande área de superfície para dissolução - mostra que a fase mineral é um fator chave na liberação de íons de cobre e que, como observado acima, a modificação das partículas primárias do mineral, obtidas aqui por meio de dopagem de ligante, é realmente necessário para provocar uma mudança marcante nas características de dissolução. Além disso, a síntese de CHAT foi realizada em temperatura ambiente, uma vez que a alta temperatura de síntese favorece fases menos amorfas que, consequentemente, podem reduzir as taxas de dissolução. Além disso, a síntese à temperatura ambiente tem o benefício de reduzir os custos energéticos ao fabricar em escala.
Embora possa haver outras maneiras de formular concentrações altas e estáveis de cobre que permitem a liberação sustentada e a rápida dissolução de íons quando necessário, não podemos imaginar outra síntese que seja tão direta e o custo dos produtos (para reagentes) tão baixo. Esses são fatores importantes, pois a questão das infecções tópicas e da resistência bacteriana não se restringe de forma alguma aos países desenvolvidos. Os países em desenvolvimento são cada vez mais atormentados por problemas de resistência bacteriana e, portanto, soluções eficazes e acessíveis são urgentemente necessárias [36, 37]. Embora não haja estudos suficientes para alcançar soluções de concreto, há evidências de que a resistência aos íons metálicos tóxicos é mais difícil para as bactérias do que a resistência aos antibióticos convencionais [7]. A teoria se baseia na ideia de que cobre e prata provavelmente não têm vias discretas de atividade antimicrobiana, mas, em vez disso, podem impactar vários alvos, incluindo vários sistemas enzimáticos e, portanto, pode desestabilizar a estrutura celular bacteriana geral [17, 19, 38]. Na verdade, foi demonstrado que as bactérias permanecem suscetíveis ao cobre e alguns outros íons de metais, apesar da exposição ao longo dos séculos [6, 7, 39]. Curiosamente, há evidências recentes de que os antimicrobianos à base de metal podem até retornar a sensibilidade bacteriana aos antibióticos convencionais, apesar da resistência anterior [40, 41].
Conclusões
Aqui, demonstramos que a questão dos íons de cobre biodisponíveis, em pHs fisiológicos e altas concentrações, pode ser resolvida dopando um nanomineral de cobre com ácidos orgânicos, em uma estratégia semelhante à anteriormente utilizada para análogos de ferro [21, 22]. Essas nanopartículas à base de cobre (denominadas CHAT) se dissolveram prontamente no meio bacteriano, mostrando absorção intracelular de cobre equivalente e atividade antibacteriana para sais de cobre solúveis. Criticamente, no entanto, e ao contrário dos sais de cobre simples, o CHAT pode ser concentrado em uma formulação de pH neutro e reter sua labilidade em termos de liberação de íons de cobre. De fato, o CHAT liberou íons de cobre dentro da faixa bactericida e poderia, portanto, ser a base para um novo agente antimicrobiano tópico, sozinho ou aumentando a eficácia da resistência aos antibióticos. Com o aumento da resistência aos antibióticos, novos antimicrobianos tópicos são necessários e o CHAT é barato, prontamente sintetizado e usa componentes geralmente reconhecidos como seguros (GRAS). Estudos in vivo são merecidos.
Abreviações
- CHAT:
-
Nanopartículas de tartarato de adipato de cobre [oxo] -hidróxido
- CuO NPs:
-
Nanopartículas de óxido de cobre
- DLS:
-
Espalhamento de luz dinâmico
- Escherichia coli :
-
E. coli
- GRAS:
-
Geralmente reconhecido como seguro
- HEC:
-
Hidroxietilcelulose
- HMM:
-
MOPS de metal pesado médio
- HPLC:
-
Cromatografia líquida de alta performance
- ICP-OES:
-
Espectrometria de emissão óptica de plasma indutivamente acoplada
- IHAT:
-
Nanopartículas de tartarato de adipato de ferro [oxo] -hidróxido
- MOPS:
-
3- ( N -morfolino) ácido propanossulfônico
- Staphylococcus aureus :
-
S. aureus
- UHP:
-
Pureza ultra-alta
Nanomateriais
- Como os tubos de cobre são fabricados
- Cobre
- Por que as inspeções de PM nem sempre são eficazes?
- Por que as pendências são importantes para uma manutenção eficaz
- Em sintonia com o coração de um átomo de cobre
- Nanopartículas de semicondutor
- Nanopartículas plasmônicas
- O que são Vias Cheias de Cobre?
- As propriedades antimicrobianas do cobre
- Quais são os melhores metais para usinagem? Aqui estão 5 opções



