Efeitos inibitórios sinergicamente aumentados da coadministração mediada por nanopartículas de pululana de lovastatina e doxorrubicina para células de câncer de mama triplo-negativas
Resumo
O câncer de mama triplo-negativo (TNBC) é um subtipo de câncer de mama que apresenta resistência aos medicamentos e é difícil de tratar. Neste estudo, enxertamos pululano solúvel em água com lovastatina (LV) para desenvolver um novo conjugado anfifílico, LV encapsulado em pululano (PLV). O conjugado PLV foi sintetizado com três razões diferentes de pululano para LV e caracterizado por infravermelho com transformada de Fourier (FTIR). O grau de substituição (DS) do LV em termos de razão molar foi de 7,87%, 3,58% e 3,06% para PLV (1/2), PLV (1/3) e PLV (1/4), respectivamente, por análise de RMN de prótons. Selecionamos o conjugado de PLV (1/2) para preparar nanopartículas de PLV carregadas com doxorrubicina (DXR) (NPs de PLV / DXR) por causa de suas propriedades superiores. O tamanho médio e o potencial zeta para NPs PLV (1/2) foram 177,6 nm e - 11,66 mV, respectivamente, determinados por espalhamento de luz dinâmico, e aqueles para NPs PLV / DXR foram 225,6 nm e - 10,51 mV, respectivamente. O perfil de liberação de droga in vitro mostrou que os NPs de PLV / DXR liberaram DXR de forma sustentável em 72 h, que foi mais robusto em pH 5,4 (97,90%) do que em pH 7,4 (76,15%). No estudo de citotoxicidade, PLV / DXR NPs mostraram maior inibição da proliferação de TNBC MDA-MB-231 do que células não TNBC MDA-MB-453 (IC 50 0,60 vs 11,05 μM). NPs de PLV / DXR carregados com FITC foram preparados para investigar a absorção celular:ambas as linhas celulares mostraram uma absorção dependente do tempo de NPs, mas o número de NPs que entraram nas células MDA-MB-231 foi maior do que entrar nas células MDA-MB-453 . A coadministração de NP baseada em pululano de LV e DXR pode inibir de forma eficiente as células TNBC, o que pode ajudar a projetar um sistema de liberação de drogas poderoso para o tratamento de TNBC.
Introdução
O câncer de mama triplo-negativo (TNBC) é um subtipo especial de câncer de mama que carece de um receptor de estrogênio (ER), receptor de progesterona (PR) e receptor de fator de crescimento epidérmico humano 2 (HER2) e tem pior prognóstico do que outros subtipos de câncer de mama [ 1,2,3]. As terapias direcionadas disponíveis dependem principalmente do direcionamento de receptores específicos na superfície da célula tumoral. Porque TNBC carece de um marcador de superfície específico para o direcionamento ativo para o tratamento, outras abordagens de direcionamento valem a pena explorar. Por exemplo, o direcionamento passivo, que envolve um efeito único de permeabilidade e retenção (EPR) aprimorada em tumores sólidos [4], permite que as partículas de um intervalo de tamanho específico tenham como alvo o local do tumor [5, 6]. Uma nanopartícula (NP) é um tipo de carreador de fármaco que pode tirar proveito do efeito EPR e se enriquecer em sítios de tumor sólido [4].
Recentemente, mostramos que a lovastatina (LV), uma das estatinas lipofílicas usadas para tratar a hiperlipidemia [7], inibe seletivamente o TNBC ao direcionar as células-tronco cancerosas [8, 9]. Além disso, demonstramos que a encapsulação de NP pode aumentar o efeito inibitório do LV no TNBC em um modelo de implante de células de câncer de mama em camundongos [8]. Nossos estudos, juntamente com achados anteriores [10, 11], sugerem que as estatinas lipofílicas, particularmente LV, podem ser reaproveitadas como drogas anticâncer para o tratamento de TNBC. No entanto, se o LV pode superar a resistência à quimio ou aumentar os efeitos terapêuticos dos quimioterápicos no TNBC permanece desconhecido.
A sinergia entre LV e diferentes tipos de agentes quimioterápicos, como doxorrubicina (DXR), 5-fluorouracil [12], cisplatina [13] e 1-β-D-arabinofuranosilcitosina [14], foi relatada em diferentes tipos de células cancerígenas. DXR é um composto de antraciclina com características intrincadas de ligação ao DNA e inibição da síntese de ácido nucléico. Além disso, o LV induziu a apoptose de células de câncer de ovário em sinergismo com DXR [15]. Além disso, o LV é um inibidor direto da proteína P-glicoproteína de efluxo [16], uma bomba acionada por ATP que pode facilmente descarregar DXR para o compartimento extracelular [17, 18]. Assim, o LV pode aumentar o efeito terapêutico de outros agentes terapêuticos, e a combinação de LV e essas drogas pode aumentar a eficácia terapêutica contra o TNBC.
As terapias combinadas atuais estão cheias de desafios. Por um lado, a quimioterapia combinacional pode ser seriamente limitada pelo metabolismo rápido, baixa solubilidade em água e baixa biodisponibilidade de drogas quimioterápicas [19, 20]. Por outro lado, com a farmacocinética variável, propriedades de transporte de membrana e biodistribuição não específica de diferentes medicamentos, é difícil atingir concentrações e proporções específicas de medicamentos administrados em células individuais [21,22,23]. Esses fatores afetam a eficácia terapêutica e o nível de sinergismo ou antagonismo para a combinação. Co-encapsular dois agentes terapêuticos em um carreador de drogas em nanoescala é uma maneira eficiente de superar esses desafios porque permite que as drogas carregadas no carreador mantenham uma proporção correta para os efeitos sinérgicos [24, 25].
Os nanocarreadores co-encapsulados incluem principalmente lipossomas, micelas poliméricas e micro ou nano esferas [26,27,28,29]. Micelas poliméricas, devido ao seu desempenho superior (por exemplo, com carga dupla de droga quimicamente conjugada e fisicamente encapsulada, alta carga de droga e alta biocompatibilidade), tem atraído muita atenção [26, 30]. Em nosso estudo anterior, preparamos uma série de NPs com pululana, um polissacarídeo hidrofílico com alta biocompatibilidade, e estudamos os efeitos de vários fatores em seu comportamento de liberação de drogas [31]. Neste estudo atual, preparamos uma nova micela polimérica de PLV com diferentes proporções de alimentação de pululano e LV e caracterizamos a distribuição de tamanho e potencial zeta e morfologia. Escolhemos o menor NP resultante para carregar com DXR porque era mais provável que fosse internalizado por células sob a premissa de usar o efeito EPR. Além disso, medimos a quantidade de carga do medicamento, a eficiência de encapsulação e a quantidade de liberação do medicamento de NPs de PLV / DXR em meios com diferentes valores de pH. Avaliamos a captação celular de NPs PLV / DXR carregados com FITC para examinar a entrada de NPs em células tumorais e o sinergismo de DXR e LV em combinação, bem como a citotoxicidade de NPs em MDA-MB-231 (TNBC) e MDA-MB Células -453 (não TNBC) (Esquema 1).
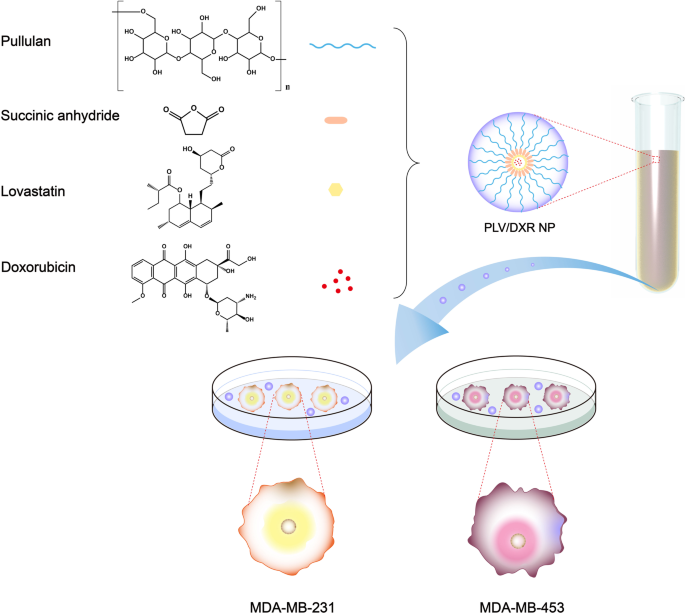
Ilustração esquemática de nanopartículas (NPs) e experimento de células in vitro. A pululana-lovastatina (PLV) NP foi formada pela automontagem de um polímero formado por pululana e LV em solução aquosa. No processo de formação do NP, o DXR foi carregado no núcleo hidrofóbico do NP. Em seguida, PLV / DXR foi usado para experimentos de células in vitro com células MDA-MB-231 e MDA-MB-453 representando câncer de mama triplo-negativo (TNBC) e células não TNBC, respectivamente
Materiais e métodos
Materiais
Pullulan (200 kDa) era de Hayashibara (Tóquio). O cloridrato de LV e DXR eram da J&K Scientific (Pequim). O cloridrato de 1-etil-3- (3-dimetilaminopropil) carbodiimida (EDCI) e a 4-dimetilaminopriidina (DMAP) foram adquiridos a Aladdin Reagent (Shanghai). Outros reagentes, como solventes, foram da Sinopharm Chemical Reagent Co. (Beijing). As linhas de células de câncer de mama MDA-MB-231 (TNBC) e MDA-MB-453 (não TNBC) foram adquiridas no Center for Cell Resource, Shanghai Institutes for Biological Sciences. O reagente CellTiterBlue era da Promega (Madison, WI, EUA). O meio de Eagle modificado por Dulbecco (DMEM) (Cat # SH30022.01) era da HyClone (EUA) e o soro fetal bovino (FBS) (Cat # 04-001-1ACS) era da Biological Industries (Israel).
Síntese de pululano enxertado em VE (PLV)
Em primeiro lugar, o monoéster de ácido succínico LV (LV-SA) foi sintetizado pelas seguintes etapas. Resumidamente, 0,60 g de anidrido succínico (SA, 6,0 mmol) e 2,0 g de LV (5,0 mmol) foram dissolvidos em 20 mL de piridina anidra e agitados durante 48 h a 50 ° C. A solução de reação resultante foi lentamente vertida em uma solução de HCl glacial de 1500 mL de pH 3 sob agitação constante para precipitar uma grande quantidade de um precipitado branco, e o pH da suspensão foi ajustado para pH 3 com HCI concentrado, seguido por filtração a vácuo . O precipitado foi então lavado com uma solução de HCl glacial de pH 3 e, em seguida, com ddH 2 O para neutro para dar um produto bruto. Finalmente, o produto bruto foi recristalizado a partir de um sistema solvente de acetona-água para obter LV-SA puro e o rendimento foi de 72%. O PLV foi produzido pela conjugação do grupo de ácido carboxílico de LV-SA com o hidroxil de pululano em razões molares de LV-SA para pululano de 1/2, 1/3 e 1/4. Resumidamente, 0,5 g (1,03 mmol) de LV-SA preparado, 0,15 g de DMAP (1,23 mmol) e 0,24 g de EDCI (1,23 mmol) foram dissolvidos em 20 mL de dimetilsulfóxido (DMSO) e agitados a 50 ° C durante 4 h. Pululano (0,33 g, 1/2; 0,50 g, 1/3; 0,67 g, 1/4) foi dissolvido em DMSO para obter uma solução a 2% (p / v). Em seguida, a solução de pululano foi adicionada lentamente à solução de reação para reação a 50 ° C durante 48 h. As misturas de reação foram colocadas em sacos de diálise (MWCO =8 ~ 12 kDa) e dialisadas contra 25% de etanol / água e água. Em seguida, as amostras foram liofilizadas [32]. Os conjugados de PLV com uma proporção de alimentação diferente de LV para pululano foram caracterizados por análise FTIR usando um espectrofotômetro FTIR (pelotas KBr, Nicolet, TM Nexus 470-ESP, Thermo Fisher Scientific, Waltham, MA, EUA). Conjugados de PLV também foram confirmados por 1 Foi calculada a espectroscopia de H NMR (solvente DMSO-d6, BRUKER AVANCE-500, Bruker, Billerica, MA, EUA) e o grau de substituição (DS) para LV para cada conjugado.
Preparação e caracterização de NPs
Uma quantidade de 50 mg de conjugado de PLV foi dissolvida em 12,5 mL de DMSO sob agitação suave a 37 ° C (para inchar totalmente o conjugado) para obter 4 mg / mL de solução de conjugado. Uma quantidade de 5 mL de solução de conjugado foi diluída para 2 mg / mL com DMSO para diálise contra 1000 mL de água destilada por 8 h com 10 vezes de trocas usando um saco de diálise (8 ~ 14 kDa). Em seguida, a solução foi sonicada usando um sonificador do tipo sonda (GA92-IIDA Ultrasonic cell pulverizer, Suzhou Jiangdong Precision Instruments) a 100 W com pulsação (pulso em 2,0 s, desligado 2,0 s) por 2 min em um banho de água gelada . NPs de PLV auto-montados foram obtidos e as amostras foram armazenadas a 4 ° C. Para preparar os NPs de PLV / DXR, 2 mg de DXR foram dissolvidos em 5 mL de DMSO e, em seguida, adicionados gota a gota a 5 mL de solução de conjugado, então os NPs de PLV / DXR foram preparados pelo mesmo método. Em um procedimento típico para a preparação de NPs de PLV / DXR carregados com FITC, 1 mg de DXR foi dissolvido em 2 mL de DMSO e, em seguida, adicionado gota a gota em 2,5 mL de solução de conjugado. Em seguida, 1 mL de solução FITC (0,6 mg / mL) em DMSO foi adicionado gota a gota e NPs de PLV / DXR carregados com FITC foram preparados pelo mesmo método.
NPs de PLV, NPs de PLV / DXR e NPs de PLV / DXR carregados com FITC foram filtrados através de membranas de 0,45 μm, em seguida, os tamanhos de partícula, potenciais zeta e índices de polidispersidade (PDI) foram determinados por espalhamento de luz dinâmica (DLS, Zetasizer 3000 HS, Malvern Instruments, Malvern, Reino Unido). As características morfológicas de NPs de PLV foram observadas por microscopia eletrônica de transmissão (TEM; Tecnai G2 20 S-Twin, FEI Hong Kong) na tensão de aceleração de 80 kV.
Determinação da capacidade de carga e eficiência de aprisionamento
Uma solução PLV / DXR NP (5 mL) foi sonicada por 5 min (pulso em 2,0 s, desligado 2,0 s) para liberar a droga dos NPs. A absorbância DXR na solução foi medida a 480 nm usando um espectrofotômetro UV-visível (Shimadzu UV-2550, Kyoto, Japão) para calcular as concentrações da droga. A eficiência de encapsulamento DXR (EE) e a capacidade de carregamento (LC) foram calculadas da seguinte forma:
$$ \ mathrm {EE} \% =\ frac {\ mathrm {quantidade} \ \ mathrm {de} \ \ mathrm {droga} \ \ mathrm {in} \ \ mathrm {NPs}} {\ mathrm {quantidade} \ \ mathrm {of} \ \ mathrm {total} \ \ mathrm {adicionado} \ \ mathrm {drug}} \ times 100 \% $$ $$ \ mathrm {LC} \% =\ frac {\ mathrm {quantidade} \ \ mathrm {of} \ \ mathrm {drug} \ \ mathrm {in} \ \ mathrm {NPs}} {\ mathrm {NP} \ \ mathrm {weight}} \ times 100 \% $$
Liberação de droga in vitro
O perfil de liberação de DXR de NPs de PLV / DXR foi medido em solução tampão de fosfato 0,1 M a 37 ° C pelo método de diálise como descrito [33]. Normalmente, 6 mL de NPs de PLV / DXR (igual a 139,4 mg de DXR) foram transferidos para um saco de diálise (MWCO =3500 Da) e então incubados a 37 ° C em 15 mL de PBS (pH 7,4 e 5,4). Em tempos predeterminados, 3 mL de solução tampão externa foram retirados e substituídos por 3 mL de PBS fresco (pH 7,4 ou 5,4). A quantidade de DXR liberado foi medida por espectrofotometria de fluorescência. A porcentagem de liberação de drogas ( Q %) foi calculado da seguinte forma:
$$ Q \% =\ left ({C} _n \ times V + {V} _n \ sum \ limits_ {t =0} ^ n {C} _i \ direita) / \ left ({W} _ {\ mathrm { NP}} \ times \ mathrm {LC} \% \ right) $$
onde W é o peso NP, C n é a concentração da amostra em Tn , V é o volume total da mídia de lançamento, V n é o volume da amostra (2 mL), e C i é a concentração da amostra em T i ( eu =0, 0,5, 1,… n horas, ambos V 0 e C 0 são iguais a zero).
Cultura de células
As linhas de células de câncer de mama humano MDA-MB-231 e MDA-MB-453 foram cultivadas em meio DMEM completo contendo 10% de FBS sob condições úmidas de 37 ° C, 5% de CO 2 , e normóxia (21% O 2 ) As células experimentais foram todas derivadas de células em fase de crescimento logarítmico.
Citotoxicidade in vitro
Células MDA-MB-231 e MDA-MB-453 semeadas em placas de 96 poços (4 × 10 3 células / poço em um volume de 100 μL) foram cultivadas em condições de cultura de rotina por 24 h. Em seguida, NPs de PLV / DXR com várias concentrações de droga (razão de massa de DXR e LV foi de 8,13) foram adicionados e incubados por 48 h. Finalmente, 20 μL de reagente CellTiter Blue (Promega) usado para medir a proliferação celular foram adicionados e incubados por 1–4 h a 37 ° C. A absorvância a 530/590 nm foi medida usando um leitor automático de microplacas. A viabilidade celular foi expressa como uma porcentagem da absorbância em relação aos grupos de controle sem tratamento.
Análise de efeito sinérgico in vitro
A análise de isobol foi usada para avaliar quantitativamente o sinergismo e o antagonismo produzidos por drogas emparelhadas. De acordo com o princípio de dose equivalente de Tallarida e o modelo aditivo Loewe, um isobol é gerado, que é uma linha para definir o efeito aditivo de medicamentos emparelhados [34, 35]. Na prática, conforme descrito anteriormente [8], primeiro adquirimos as curvas dose-efeito para DXR livre e LV livre e, após transformar a dose e o efeito da droga, usamos a regressão linear para obter equações de regressão linear para calcular as doses combinadas dos pares drogas que dão um efeito específico. Os dados para traçar o isóbolo são ilustrados na Tabela 1. Os pontos no isóbolo definem DXR / LV em diferentes proporções para produzir um efeito máximo de 50%. Um IC 50 da dose de droga emparelhada localizada abaixo do isóbolo indica um efeito sinérgico, enquanto um IC 50 acima do isobole indica um efeito antagônico.
Captação celular in vitro
Os NPs FITC PLV / DXR foram obtidos por diálise. A captação celular de PLV / DXR FITC NPs foi testada usando um leitor de microplaca de fluorescência. Células MDA-MB-231 e MDA-MB-453 foram semeadas (2 × 10 5 / poço) em placas de 2,5 cm e incubadas a 37 ° C por 24 h. As células foram então incubadas com concentrações de PLV-DXR FITC NPs a 37 ° C durante 1, 2 e 4 h. O meio de cultura foi então removido e lavado duas vezes com PBS frio. As células foram fixadas com paraformaldeído 4% por 5 min e montadas em lâminas usando meio de montagem contendo DAPI. Em seguida, a captação celular de NPs foi visualizada por microscopia de fluorescência.
Análise estatística
Os dados são expressos como média ± DP e foram analisados por t de Student teste. As diferenças foram consideradas estatisticamente significativas em P <0,05.
Resultados
Citotoxicidade in vitro e efeito sinérgico de DXR e LV
Para avaliar o efeito inibitório do LV e DXR contra a proliferação de células TNBC e não TNBC, a viabilidade celular foi avaliada pelo ensaio Alamar blue. Determinamos primeiro o efeito inibitório de LV e DXR nas duas linhas de células TNBC por meio de um teste de drogas livre. Uma série de razões de concentração LV / DXR foram obtidas definindo a concentração de uma constante de droga e alterando a da outra droga. Para a linha celular MDA-MB-231, tanto LV quanto DXR conferiram uma inibição dependente da concentração, mas LV teve um efeito inibitório significativo em concentrações de até 3,0 μM (Fig. 1).
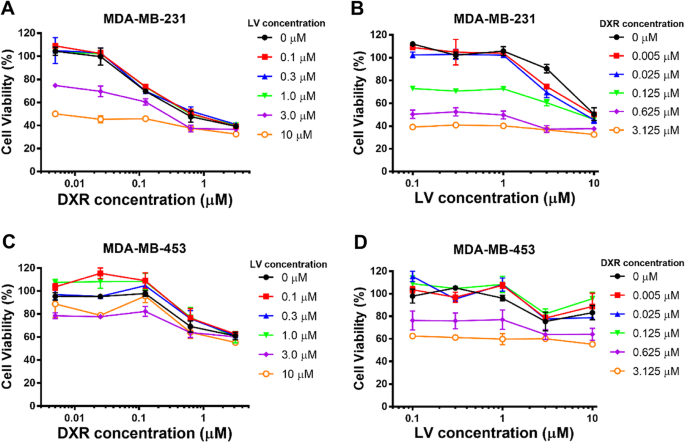
Citotoxicidade da doxorrubicina livre (DXR) e lovastatina livre (LV) em células de câncer de mama. Citotoxicidade in vitro de DXR, LV e DXR e LV livres combinados contra MDA-MB-231 ( a , b ) e MDA-MB-453 ( c , d ) células cancerosas
O IC 50 os valores para LV sob diferentes tratamentos de DXR e para DXR sob diferentes tratamentos de LV são mostrados na Tabela 2, e também traçamos esses IC 50 (Fig. 2a) para refletir visualmente o efeito combinado de DXR / LV. O IC 50 para DXR livre sozinho foi de 0,865 μM, e para LV livre sozinho foi de 10,07 μM. Quando a concentração de DXR aumentou de 0,125 para 0,625 μM (aumento de cinco vezes), o IC 50 para LV diminuiu de 10,92 para 0,28 μM (redução de 39 vezes), e quando a concentração de DXR aumentou de 0,625 para 3,125 μM (aumento de cinco vezes), o IC 50 valor para LV diminuiu de 0,28 para 0,0004085 μM (redução de 685 vezes). Da mesma forma, quando a concentração de LV aumentou de 1,0 para 3,0 μM (aumento de três vezes), o IC 50 valor para DXR diminuiu de 1,005 para 0,3033 μM (redução de 3,3 vezes) e quando a concentração de VE aumentou de 3,0 para 10 μM (aumento de 3,3 vezes), o IC 50 valor para DXR diminuiu de 0,3033 para 0,007196 μM (redução de 42 vezes). Assim, para a mesma taxa de inibição da proliferação de células MDA-MD-231, DXR pode reduzir significativamente a quantidade de LV necessária, e LV também pode reduzir significativamente a quantidade de DXR necessária. Este achado é essencial para a quimioterapia tumoral porque DXR é uma droga quimioterápica altamente potente com efeitos colaterais adversos indesejáveis e deve ser mantida em baixa concentração, e LV tem efeitos colaterais adversos mínimos [36]. Para células MDA-MB-453, DXR mostrou uma inibição dependente da concentração, mas LV não mostrou nenhuma inibição significativa nas concentrações examinadas. Além disso, o DXR teve um efeito inibitório significativo nas células MDA-MB-453 em concentrações de até 3,0 μM, o que foi muito menos eficaz do que as células MDA-MB-231 (Fig. 1). Recentemente, descobrimos que o LV inibiu seletivamente um painel de linhas de células TNBC em comparação com linhas de células não TNBC [8]; portanto, a combinação de LV e DXR pode ser adequada para o tratamento de células TNBC, mas não de células não TNBC.
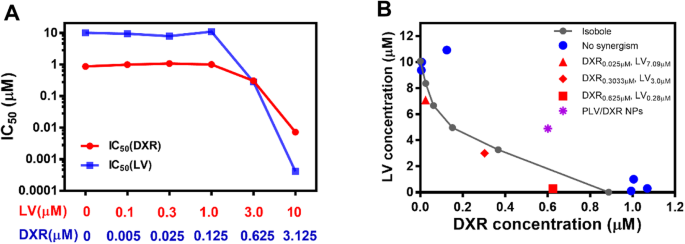
Sinergismo de DXR e LV. IC 50 valores para DXR e LV com diferentes concentrações de LV e DXR calculadas por GraphPad Prism 7 ( a ) e o método isobole ( b )
Para avaliar ainda mais quantitativamente o sinergismo de DXR e LV, usamos o método isobol. Com diferentes razões DXR / LV para atingir o efeito máximo de 50% (Tabela 1), traçamos um isóbolo que indicou o efeito aditivo da razão DXR / LV (Fig. 2b). O IC 50 doses de DXR / LV a 0,025 / 7,09, 0,3033 / 3,0 e 0,625 / 0,28 (μM / μM) estavam abaixo do isobol, o que sugere que DXR / LV nessas proporções produziria um efeito sinérgico. Assim, este efeito sinérgico (1 + 1> 2) alcançaria ainda mais doses de fármaco farmacologicamente estatisticamente minimizadas com eficácia de fármaco maximizada [37]. Essas três proporções sinérgicas pareceram representar esses resultados:(1) uma dose baixa de DXR (0,025 μM) poderia aumentar melhor a eficácia terapêutica de LV porque DXR de 0,025 μM poderia produzir uma inclinação negativa maior para a curva dose-efeito de LV (Fig. . 2b); (2) com alta concentração de DXR, a adição de uma pequena quantidade de LV pode ajudar muito o efeito de DXR contra células MDA-MB-231 porque o IC 50 para DXR sozinho foi de 0,865 μM, mas a adição de apenas 0,28 μM LV reduziu o IC 50 de DXR para 0,625 μM, ou seja, 0,28 μM LV substituiu completamente a eficácia de 0,24 μM de DXR (Tabela 2); e (3) quando a dose de LV era cerca de 10 vezes a de DXR, a razão DXR / LV deveria ter o melhor efeito sinérgico porque o ponto (0,3033, 3,0) estava mais distante do isóbolo (Fig. 2b).
Síntese e caracterização estrutural de conjugados PLV
Os conjugados anfifílicos de PLV foram sintetizados como mostrado no Esquema 2. O PLV foi obtido por esterificação de pululano e LV. As estruturas dos conjugados de PLV foram confirmadas por FTIR e 1 Espectro de H NMR (Fig. 3). De acordo com a análise de FTIR (Fig. 3a), os conjugados de PLV foram produzidos com sucesso. Para os espectros de conjugados de PLV, além de manter os picos característicos de pululano (1644, 1642 e 1648 cm −1 ), os picos aprimorados em 1459 cm −1 e 1360 cm −1 também mostrou os picos de vibração de curvatura de –CH 3 e –CH 2 -, respectivamente, para LV. Além disso, observamos um alto deslocamento do número de ondas dos picos de absorção de alongamento –C =O (ligação de éster em LV) em 1725 cm −1 de conjugados de PLV por causa da ligação éster recém-gerada, e esses picos foram aumentados com uma razão molar aumentada de LV para pululano (Fig. 3a).
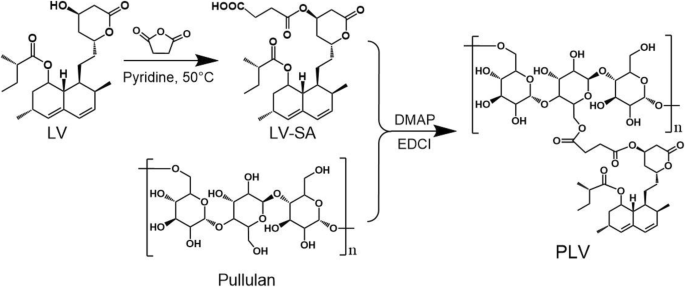
Síntese química de conjugados anfifílicos de PLV. LV e anidrido succínico (SA) reagiram sob a catálise de piridina para formar LV-SA a 50 ° L. Em seguida, LV-SA foi ligado a pululano por uma ligação éster sob a catálise de EDC e DMAP para formar o polímero PLV
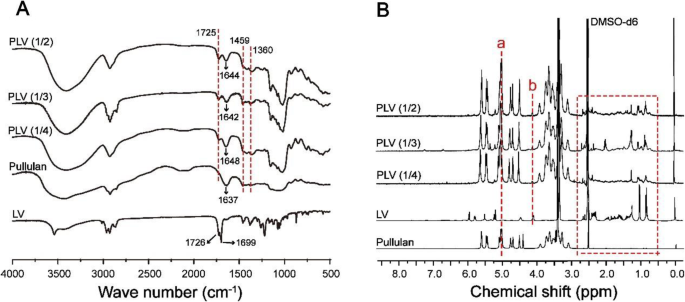
Caracterização estrutural de conjugados de pululano-lovastatina (PLV). a Espectros de FTIR para pululano, LV, PLV (1/2), PLV (1/3) e PLV (1/4), com pico em 1644, 1642 e 1648 cm −1 como picos característicos de pululano. As linhas pontilhadas em 1360, 1459 e 1725 cm −1 mostrar os picos de vibração de curvatura de –CH 3 - e –CH 2 - para LV. b 1 Espectro de H NMR para pululano, LV, PLV (1/2), PLV (1/3) e PLV (1/4)
Confirmamos a síntese bem-sucedida de conjugados PLV por 1 Espectro de H NMR (Fig. 3b). O 1 Os espectros de H-NMR mostraram os picos característicos de pululano e novos picos atribuídos ao CH 3 , CH 2 , e prótons CH da porção LV a 0,5 ~ 2,7 ppm (quadro vermelho), que indicou a conjugação bem-sucedida de LV com pululano. Usamos os picos característicos de pululano a 4,94 ~ 5,14 ppm (a) correspondendo aos prótons da ligação glicosídica α-1,6 e α-1,4 de C 1 para definir as unidades de glicose no pululano [38]. Os sinais em 4,12 ppm (b) corresponderam ao próton do C 13 em LV. Assim, o DS de resíduos de LV por 100 unidades de glicose de pululano foi calculado pela razão de C 13 prótons (4,05 ~ 4,15 ppm) de LV para prótons de açúcar (4,94 ~ 5,14 ppm) com a seguinte equação:DS = I 4,05 ~ 4,15 / eu 4,94 ~ 5,14 × 100%. Os dados DS para LV estão na Tabela 3.
Caracterizações de NPs PLV
O conjugado PLV sintetizado pode se automontar em micelas em uma solução aquosa. O tamanho médio e o índice de polidispersidade (PDI) foram 177,2 nm e 0,138, respectivamente, para NPs PLV (1/2); 189,7 nm e 0,160 para NPs PLV (1/3); e 219,8 nm e 0,050 para NPs de PLV (1/4) (Tabela 3; Fig. 4a, b). Além disso, o potencial zeta para NPs PLV (1/2), PLV (1/3) e PLV (1/4) era - 11,66, - 10,51 e - 8,30 mV, respectivamente. O tamanho dos NPs de PLV diminuiu com o aumento do DS de LV, sem alteração significativa no potencial zeta. A mudança no tamanho é atribuída principalmente ao fortalecimento da interação hidrofóbica entre os grupos de LV, que resulta na formação de núcleos hidrofóbicos mais compactos [39]. Estudamos previamente NPs de pululano com diferentes valores de DS de colesterol e descobrimos que, até certo ponto, quanto maior o DS hidrofóbico do polímero anfifílico, menor o tamanho dos NPs formados [33]. Neste estudo, como o DS do grupo hidrofóbico LV era maior, o tamanho dos NPs também era menor. Além disso, as imagens TEM (Fig. 4c) mostraram que os NPs estavam geralmente em uma forma esférica com boa monodispersidade. NPs de PLV (1/2), com o maior DS levando ao maior carregamento de VE e o menor tamanho, foram selecionados para os seguintes experimentos.
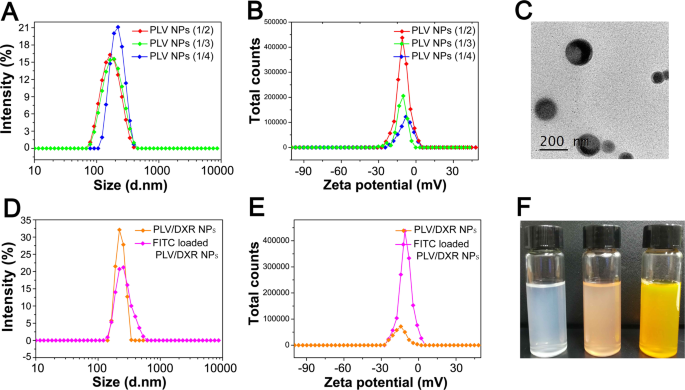
Caracterização de nanopartículas (NPs). a Tamanho de partícula e distribuição de PLV. b Potencial zeta de PLV. c Imagem de microscopia eletrônica de transmissão de PLV (1/2). d Tamanho de partícula e distribuição de PLV / DXR e PLV / DXR carregado com FITC. e Potencial Zeta de PLV / DXR e PLV / DXR carregado com FITC. f Fotografia de PLV, PLV / DXR e PLV / DXR carregado com FITC
NPs PLV / DXR também exibiram morfologia esférica e um tamanho maior, 225,6 nm, do que NPs PLV vazios. A eficiência de encapsulamento e capacidade de carregamento de NPs PLV / DXR foi de 20,92% e 1,93%, respectivamente. A interação hidrofóbica entre o núcleo hidrofóbico das NPs e o grupo hidrofóbico da droga determina a quantidade de carga da droga nas NPs. Considerando que a solubilidade em água do cloridrato de DXR usado neste experimento foi ligeiramente maior, a interação hidrofóbica entre DXR e o núcleo hidrofóbico dos NPs foi fraca, o que levou a uma quantidade menor de DXR realmente encapsulado nos NPs. Para esclarecer ainda mais a absorção de NPs por células tumorais, FITC foi carregado em NPs de PLV / DXR. Com o carregamento de FITC, o tamanho médio dos NPs de PLV / DXR carregados com FITC foi de 253,8 nm e o potencial zeta médio - 15,09 mV (Fig. 4d, e).
Liberação de droga in vitro
Para revelar o comportamento de liberação de DXR de NPs de PLV / DXR, perfis de liberação de DXR in vitro foram avaliados em PBS em pH 7,4 e 5,4, mimetizando as condições em tecidos fisiológicos normais e no microambiente intracelular, respectivamente. NPs PLV / DXR exibiram duas fases de liberação DXR:uma liberação rápida nas primeiras 8 he uma liberação sustentada depois disso (Fig. 5), que é consistente com o perfil de liberação de NPs típicos. Além disso, com uma diminuição do pH de 7,4 para 5,4, a liberação cumulativa de DXR foi acelerada significativamente até 76,15% e 97,90%, respectivamente, em 72 h. Portanto, a liberação de DXR de NPs de PLV / DXR foi sensível ao pH até certo ponto, o que é especialmente útil para aumentar a eficácia terapêutica e reduzir os efeitos colaterais in vivo [40].
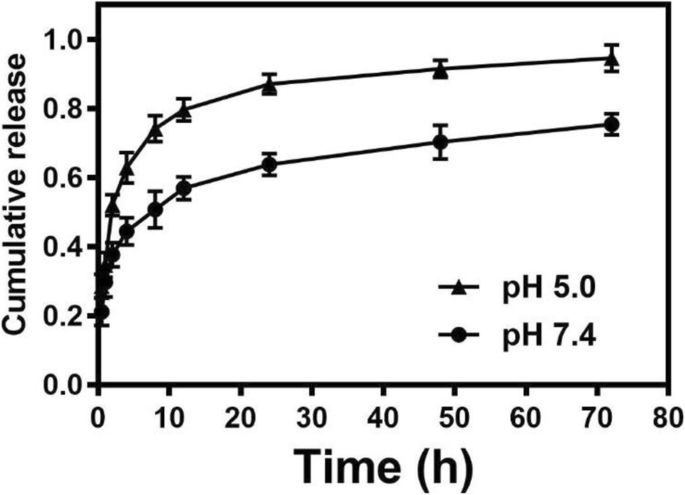
Perfis de liberação in vitro de DXR de PLV / DXR em solução salina tamponada com fosfato em pH 7,4 vs 5,4 em momentos diferentes após a diálise
Captação celular de NPs PLV / DXR carregados com FITC
Obtivemos imagens de microscopia de fluorescência de células MDA-MB-231 (Fig. 6a) e MDA-MB-453 (Fig. 6b) em 0,5, 1 e 4 h, respectivamente, após a exposição a NPs PLV / DXR carregados com FITC e encontraram um aumento dependente do tempo na intensidade da fluorescência vermelha e verde de 0,5 a 4 h após o tratamento com NP (Fig. 6), o que indica uma captação celular dependente do tempo de DXR e NPs carregados com FITC, respectivamente. Além disso, a quantidade de FITC que entra nas células MDA-MB-231 foi maior do que a que entra nas células MDA-MB-453. A quantificação adicional da intensidade de fluorescência revelou uma diferença significativa na captação de DXR entre as células MDA-MB-231 e MDA-MB-453 1 h após o tratamento com NP (Fig. 6c).
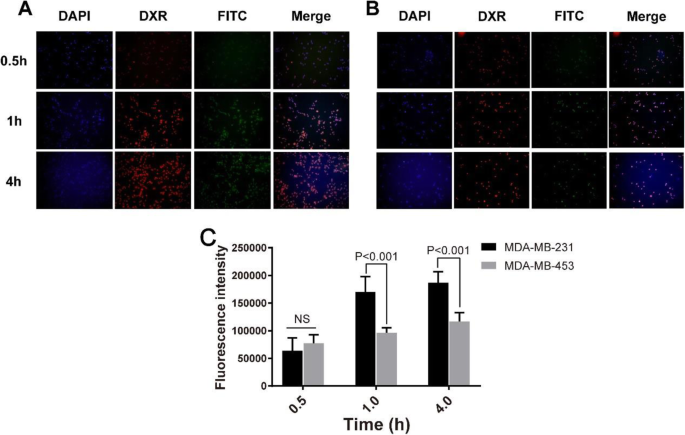
Captação de drogas por células de câncer de mama carregadas em NPs de PLV / DXR. Imagens de microscopia de fluorescência de PLV / DXR carregado com FITC capturadas por MDA-MB-231 ( a ) e MDA-MB-453 ( b ) células em 0,5, 1 e 4 h (azul para DAPI, vermelho para DXR, verde para FITC). c Análise quantitativa da captação celular de DXR em células MDA-MB-231 e MDA-MB-453 após tratamento com PLV / DXR
Citotoxicidade in vitro de NPs PLV / DXR
Após confirmar o efeito inibitório de DXR e LV na viabilidade das células MDA-MB-231 e MDA-MB-453 e demonstrar o efeito sinérgico de DXR e LV, determinamos a citotoxicidade in vitro de NPs de PLV / DXR nessas duas células linhas. As células MDA-MB-231 e MDA-MB-453 foram incubadas com NPs de PLV / DXR a uma concentração equivalente à do DXR livre. A citotoxicidade de NPs de PLV / DXR aumentou com o aumento da concentração de DXR e foi maior para as células MDA-MB-231 do que para as células MDA-MB-453 (Fig. 7a). Este achado é consistente com a tendência de citotoxicidade de medicamentos livres (Fig. 7b) e indica que o carregamento de medicamentos gratuitos em NPs não afetou o comportamento inibitório dos medicamentos. NPs de PLV / DXR tiveram maior efeito inibitório na proliferação de MDA-MB-231 do que células MDA-MB-453, o que foi consistente com o efeito inibitório preferencial de LV em TNBC. A inibição do crescimento de células MDA-MB-231 foi maior com NPs PLV / DXR do que DXR livre (IC 50 0,6012 vs 0,865 μM), o que sugere que os NPs podem facilitar a captação e retenção celular da droga carregada dentro da célula, causando citotoxicidade aumentada em comparação com a droga livre.
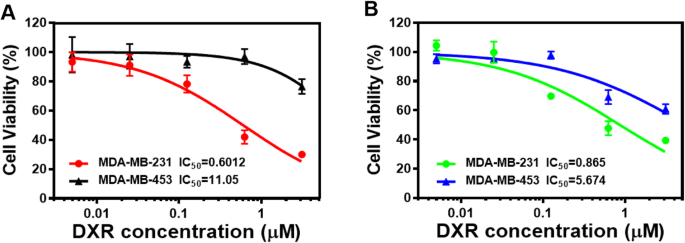
Citotoxicidade in vitro do fármaco distribuído por NP vs fármaco livre. Citotoxicidade de PLV / DXR ( a ) e DXR grátis ( b ) contra células MDA-MB-231 e MDA-MB-453
Discussão
Neste estudo, PLV / DXR NPs preparados para perfil de liberação de droga in vitro liberaram DXR de forma sustentável em 72 h, que foi robusto em pH 5,4 (97,9%). Os NPs de PLV / DXR inibiram mais fortemente a proliferação de TNBC MDA-MB-231 do que células não TNBC MDA-MB-453. Ambas as linhas celulares mostraram absorção dependente do tempo de NPs, mas as células MDA-MB-231 absorveram mais NPs do que as células MDA-MB-453. Assim, a coadministração de NP à base de pululano de LV e DXR poderia inibir de forma eficiente a proliferação de células de câncer de mama TNBC, o que pode sugerir um sistema de distribuição de droga poderoso para o tratamento de TNBC.
Recentemente, o uso de LVs na prevenção e tratamento de TNBC ganhou reconhecimento, e estudos mostraram ainda que o LV inibe preferencialmente a proliferação de células TNBC e induz apoptose [10, 41]. No entanto, clinicamente, os LVs são principalmente em preparações orais, mas outros medicamentos antitumorais para quimioterapia, incluindo DXR, estão principalmente na forma de injeção. Essa situação resulta em indesejável eficácia quimioterápica por combinar LV e outros fármacos, por dificuldade em atingir o tecido tumoral na dose e no tempo esperados. A formulação de LV como uma injeção é difícil de alcançar devido à sua insolubilidade em água. Portanto, os nano sistemas de entrega são necessários para que o LV seja usado para eficácia antitumoral e também permita a co-encapsulação de vários medicamentos para uma quimioterapia de combinação mais fácil.
Nosso grupo preparou recentemente um nanocompósito à base de cerassoma para encapsular o LV, o que resolveu o problema da solubilidade do LV em água até certo ponto, mas a eficiência de carregamento da droga em geral não era alta (5 ~ 6%) [8]. Zhang et al. desenvolveram nanocápsulas de conjugado camptotecina-floxuridina para carregar LV. Essas nanocápsulas, consistindo de duas drogas quimioterápicas aprovadas pela Food and Drug Administration dos EUA, alcançaram capacidade de carga ultra-alta para camptotecina-floxuridina (68,3%), mas a eficiência de carga para LV ainda era baixa (2,8%) [29]. No presente estudo, usamos LV para a modificação hidrofóbica de pululano para obter conjugados de PLV anfifílicos e, em seguida, preparamos NPs de PLV / DXR, que não apenas resolveram a questão da solubilidade em água de LV, mas também renderam alta capacidade de carga de droga (15,69% para LV e 1,93% para DXR).
A estratégia de encapsular dois ou mais medicamentos antitumorais em um nanocarreador tem sido amplamente aceita para a entrega eficiente de medicamentos [42]. Sui et al. usaram NPs de pululano enxertado com DXR carregando sorafenibe para alcançar quimioterapia sinérgica contra carcinoma de mama murino [30]. Nosso estudo usou uma metodologia semelhante para NPs PLV / DXR, exibindo maior eficácia inibitória para células MDA-MB-231 em comparação com DXR sozinho. No entanto, os NPs de PLV / DXR não apresentaram efeitos sinérgicos, o que pode estar relacionado ao atraso da endocitose de NP e liberação de VE, o que merece um estudo mais aprofundado.
O índice de combinação tem sido amplamente utilizado para quantificar os efeitos sinérgicos de duas drogas [43,44,45]. O método de análise de isobolograma usado na avaliação quantitativa dos efeitos sinérgicos pode efetivamente evitar resultados falso-positivos [35]. Neste estudo, rastreamos a relação de sinergia ideal de uma gama de relações DXR / LV com base na análise de isobolograma.
Nossa pesquisa fornece uma justificativa para o projeto de um sistema de co-entrega mais eficiente para eliciar efeitos inibitórios sinergicamente aumentados no TNBC. Uma vez que nosso trabalho é preliminar e baseado na premissa de que o efeito EPR é viável, investigações adicionais da eficácia in vivo deste novo sistema de co-entrega em TNBC usando modelos ortotópicos de crescimento de tumor de mama e modelos de xenoenxerto derivados de pacientes são garantidos.
Conclusão
Neste estudo, desenvolvemos novos NPs carregados com drogas duplas enxertando quimicamente LV em pululano e encapsulando fisicamente DXR, que tinha excelente monodispersidade, alta capacidade de carga de drogas e bom comportamento de liberação de drogas. Os NPs PLV / DXR mostraram comportamento de liberação sensível ao pH sustentável de DXR. Os NPs de PLV / DXR internalizaram e inibiram mais eficazmente a proliferação de TNBC MDA-MB-231 do que células não TNBC MDA-MB-453. Além disso, demonstramos o efeito sinérgico de uma mistura DXR / LV livre, que fornece um regime de quimioterapia de combinação para um potencial futuro tratamento clínico de TNBC.
Disponibilidade de dados e materiais
As conclusões feitas neste manuscrito são baseadas nos dados que são apresentados e mostrados neste artigo.
Abreviações
- 1 H NMR:
-
Ressonância magnética nuclear de prótons
- DLS:
-
Espalhamento de luz dinâmico
- DMAP:
-
4-Dimetilaminopriidina
- DMEM:
-
Meio Eagle modificado por Dulbecco
- DMSO:
-
Dimetilsulfóxido
- DS:
-
Graus de substituição
- DXR:
-
Doxorrubicina
- EDCI:
-
Cloridrato de 1-etil-3- (3-dimetilaminopropil) carbodiimida
- EE:
-
Eficiência de encapsulamento
- EPR:
-
Permeabilidade e retenção aprimoradas
- ER:
-
Receptor de estrogênio
- FBS:
-
Soro fetal bovino
- FTIR:
-
Transformada de Fourier Infra-vermelho
- HER2:
-
Receptor 2 do fator de crescimento epidérmico humano
- LC:
-
Capacidade de carregamento
- LV:
-
Lovastatina
- LV-SA:
-
Monoéster de ácido succínico de lovastatina
- NP:
-
Nano-partícula
- PDI:
-
Índices de polidispersidade
- PLV:
-
Lovastatina encapsulada em pululano
- NPs PLV / DXR:
-
Nanopartículas de PLV carregadas com doxorrubicina
- PR:
-
Receptor de progesterona
- SA:
-
Anidrido succínico
- TNBC:
-
Câncer de mama triplo-negativo
Nanomateriais
- Nanofibras e filamentos para entrega aprimorada de drogas
- Demonstração de um biossensor flexível à base de grafeno para detecção sensível e rápida de células cancerosas do ovário
- Nanopartículas para terapia do câncer:progresso e desafios atuais
- Administração de medicamentos baseados em células para solicitações de câncer
- Nanotécnicas Inativam células-tronco cancerosas
- Síntese de nanocristais de ZnO e aplicação em células solares de polímero invertido
- Efeitos sinérgicos de nanopartículas de Ag / BiV1-xMoxO4 com atividade fotocatalítica aprimorada
- Potencial antiproliferativo e de desencadeamento de apoptose de nanopartículas lipídicas direcionadas à base de paclitaxel com internalização celular aprimorada por receptores de transferrina - u…
- Influência dos nanotubos de carbono e seus derivados nas células tumorais in vitro e parâmetros bioquímicos, composição do sangue celular in vivo
- Efeitos tóxicos induzidos por nanopartículas de zircônia em células 3T3-E1 semelhantes a osteoblastos



