Nanopartículas para terapia do câncer:progresso e desafios atuais
Resumo
O câncer é uma das principais causas de morte e morbidade com uma fisiopatologia complexa. As terapias tradicionais contra o câncer incluem quimioterapia, radioterapia, terapia direcionada e imunoterapia. No entanto, limitações como falta de especificidade, citotoxicidade e resistência a múltiplos medicamentos representam um desafio substancial para o tratamento favorável do câncer. O advento da nanotecnologia revolucionou a arena do diagnóstico e tratamento do câncer. As nanopartículas (1–100 nm) podem ser usadas para tratar o câncer devido às suas vantagens específicas, como biocompatibilidade, toxicidade reduzida, estabilidade mais excelente, maior permeabilidade e efeito de retenção e direcionamento preciso. As nanopartículas são classificadas em várias categorias principais. O sistema de entrega de nanopartículas de drogas é particular e utiliza características do tumor e do ambiente do tumor. As nanopartículas não apenas resolvem as limitações do tratamento convencional do câncer, mas também superam a resistência a múltiplas drogas. Além disso, à medida que novos mecanismos de resistência a múltiplas drogas são desvendados e estudados, as nanopartículas estão sendo investigadas com mais vigor. Várias implicações terapêuticas das nanoformulações criaram novas perspectivas para o tratamento do câncer. No entanto, a maior parte da pesquisa é limitada a estudos in vivo e in vitro, e o número de nanofármacos aprovados não foi muito ampliado ao longo dos anos. Esta revisão discute vários tipos de nanopartículas, mecanismos de direcionamento e nanoterápicos aprovados para implicações oncológicas no tratamento do câncer. Além disso, também resumimos a perspectiva, as vantagens e os desafios atuais da tradução clínica.
Introdução
Câncer é um termo genérico para um conjunto de doenças caracterizadas por divisão celular aleatória e descontrolada e capacidade de invasão. Esforços extensivos ao longo de vários anos têm se concentrado na detecção de vários fatores de risco para o câncer. Para alguns tipos de câncer, a etiologia foi influenciada por fatores ambientais específicos (fatores adquiridos), como radiação e poluição. No entanto, um estilo de vida pouco saudável, como uma dieta mal balanceada, consumo de tabaco, tabagismo, estresse e falta de atividade física tem um forte impacto na determinação do risco de câncer [1, 2]. Embora esses fatores externos tenham sido reconhecidos como as principais causas do câncer, o envolvimento de mutações de proto-oncogenes, padrões de expressão de genes supressores de tumor e genes envolvidos no reparo do DNA tem sido difícil de estimar. Apenas 5–10% dos casos de câncer estão ligados à genética hereditária [3]. O avanço da idade é outro fator de risco crucial para o câncer e para muitos tipos de câncer individuais.
O câncer é um dos maiores problemas de saúde pública em todo o mundo e a segunda principal causa de morte. De acordo com a American Cancer Society, o número de novos casos está previsto em 1,9 milhões até o final do ano de 2021 [4]. As abordagens terapêuticas convencionais usadas no tratamento do câncer incluem cirurgia, quimioterapia, radioterapia, terapia direcionada, imunoterapia e terapia hormonal [5, 6]. Embora a quimioterapia e a radioterapia possuam capacidades de citostase e citotoxicidade [7], essas abordagens são frequentemente associadas a efeitos colaterais agudos e um alto risco de recorrências. Os efeitos colaterais mais comuns induzidos por incluem neuropatias, supressão da medula óssea, distúrbios gastrointestinais e de pele, queda de cabelo e fadiga. Além disso, existem alguns efeitos colaterais específicos de drogas, como antraciclinas e cardiotoxicidade induzida por bleomicina e toxicidade pulmonar [8] (Fig. 1).
Nanopartículas para terapia do câncer
O advento da terapia direcionada fez crescer a terapia de precisão [9]. No entanto, ainda existem muitos efeitos adversos inevitáveis, como a multirresistência, limitando a eficácia terapêutica [8]. Os agentes imunoterapêuticos produziram resultados promissores, não apenas no tratamento do câncer primário, mas também na prevenção de metástases à distância e na redução da taxa de recorrência [10]. No entanto, a doença autoimune é um dos principais efeitos colaterais da imunoterapia. Além disso, estudos e fragmentos de evidências sugerem que a imunoterapia é menos eficaz contra tumores sólidos do que o linfoma [11]. Esses cânceres criam uma matriz extracelular incomum (ECM), que é um grande desafio para as células imunes se infiltrarem [12]. Essas terapias e imunoterapias direcionadas recém-desenvolvidas interferem nas vias de sinalização que são vitais em comportamentos malignos e funções homeostáticas normais da epiderme e derme e causam eventos adversos dermatológicos (dAEs) [13].
Considerando todos esses detalhes, a demanda pelo avanço de novas estratégias para buscar uma terapia precisa do câncer ganhou impulso nos últimos anos. Esforços recentes têm sido feitos para abordar as limitações das abordagens terapêuticas existentes usando nanopartículas. Os sistemas de distribuição de medicamentos baseados em nanopartículas têm refletido benefícios no tratamento e gerenciamento do câncer, demonstrando boa farmacocinética, direcionamento preciso, efeitos colaterais reduzidos e resistência aos medicamentos [14, 15].
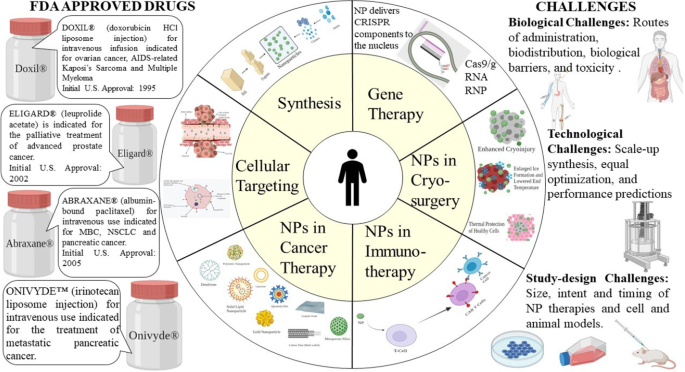
Na esteira dos avanços da nanotecnologia, uma série de drogas nanoterapêuticas foram comercializadas e são amplamente comercializadas, e muitos mais entraram no estágio clínico desde 2010. As drogas nanoterapêuticas fizeram progresso no domínio dos sistemas de distribuição de drogas e multidrogas antitumorais resistência (MDR), fornecendo uma chance para terapia de combinação de medicamentos e inibição dos mecanismos de resistência aos medicamentos [16]. O esforço pioneiro foi feito para aplicar a nanotecnologia na medicina na ETH Zurique na década de 1960 [17]. Esta combinação provou ser um amálgama melhor no desenvolvimento de vários dispositivos de diagnóstico e melhores terapias. Esta revisão enfoca principalmente os princípios básicos da aplicação da nanoterapêutica, as perspectivas dos desafios atuais e descreve o caminho de pesquisas futuras.
Nanopartículas
Nanopartículas (NPs) são tecnicamente definidas como partículas com uma dimensão menor que 100 nm com propriedades únicas geralmente não encontradas em amostras volumosas do mesmo material [18]. Dependendo da forma geral da nanopartícula, estas podem ser classificadas como 0D, 1D, 2D ou 3D [19]. A composição básica das nanopartículas é bastante complexa, compreendendo a camada superficial, a camada de casca e o núcleo, que é fundamentalmente a porção central do NP e normalmente é denominado como o próprio NP [20]. Devido às suas características excepcionais, como alta relação superfície:volume, dissimilaridade, tamanho submícron e sistema de direcionamento aprimorado, esses materiais ganharam muita importância em campos multidisciplinares.
NPs têm penetração no tecido profundo para aumentar o efeito de permeabilidade e retenção (EPR). Além disso, as características da superfície afetam a biodisponibilidade e a meia-vida ao cruzar efetivamente a fenestração epitelial [21]. Por exemplo, NPs revestidos com polietilenoglicol (PEG), um polímero hidrofílico, diminuem a opsonização e contornam a depuração do sistema imunológico [22]. Além disso, é possível otimizar a taxa de liberação de drogas ou fração ativa manipulando as características do polímero de partícula. Ao todo, as propriedades distintas dos NPs regulam seu efeito terapêutico no gerenciamento e tratamento do câncer.
Síntese de NPs
Os NPs são de diferentes formas, tamanhos e estruturas. Para conseguir isso, vários métodos de síntese são adotados. Esses métodos podem ser amplamente categorizados em dois grupos principais:1) abordagem de baixo para cima e 2) abordagem de cima para baixo. Essas abordagens podem ser classificadas em diferentes subclasses com base nas condições de reação e operação (Fig. 2).
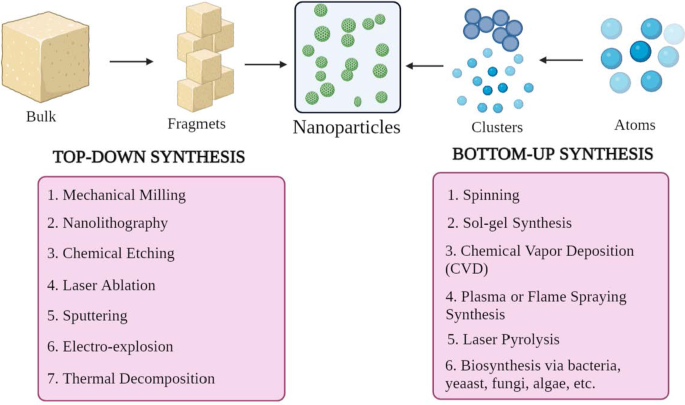
Classificação da síntese NP a de cima para baixo e b abordagens de baixo para cima
Abordagem de baixo para cima
Este método envolve a construção de material de átomos a clusters para NPs, ou seja, a construção de substâncias mais simples, portanto conhecido como método construtivo [23]. Alguns métodos comumente usados são spinning, síntese de solgel, deposição de vapor químico (CVD), plasma ou síntese de spray de chama, pirólise a laser e biossíntese.
Abordagem de cima para baixo
É também conhecido como método destrutivo, que reduz o material ou substância a granel para sintetizar NPs. Uma molécula maior é quebrada ou decomposta em unidades menores que são convertidas em NPs [24]. Inclui técnicas como moagem mecânica, nanolitografia, gravação química, ablação a laser, pulverização catódica, eletroexplosão e decomposição térmica.
Notavelmente, os parâmetros morfológicos, como tamanho, forma e carga de NPs podem ser modificados, alterando as condições de reação e outros parâmetros de síntese [25]. Além disso, o mecanismo de crescimento também determina as propriedades químicas dos NPs. Portanto, compreender o mecanismo de crescimento é essencial para sintetizar NPs necessários.
Mecanismos de segmentação celular
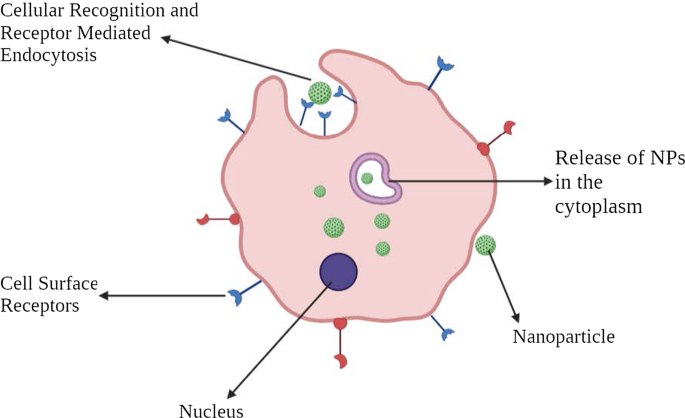
Para uma terapia eficaz contra o câncer, é essencial desenvolver ou projetar um sistema de entrega de drogas ou genes que tenha uma excelente capacidade de direcionar as células tumorais, poupando as células saudáveis normais. Aumenta a eficácia terapêutica, protegendo assim as células normais do efeito da citotoxicidade. Isso pode ser alcançado pela entrega bem organizada de NPs no microambiente tumoral (TME), direcionando indiretamente as células cancerosas. Essas nanoformulações devem passar por inúmeras barreiras fisiológicas e biológicas. Essas barreiras são sistemas complexos de várias camadas (epitélio, endotélio e membranas celulares) e componentes (barreiras mecânicas e físico-químicas e barreiras enzimáticas). Esses fatos impõem especificações com relação ao tamanho, biocompatibilidade e química de superfície de NPs para evitar o direcionamento inespecífico. No entanto, a mera internalização citosólica de uma molécula de fármaco NP não significa que ela alcance seu alvo subcelular. Engenharia e otimização específicas são obrigatórias para habilitar o direcionamento celular ou nuclear.
Vários estudos foram realizados até agora e vários outros estão em andamento para descobrir o projeto de direcionamento de drogas baseado em NP. Esses nanocarreadores normalmente devem possuir certas características fundamentais, como 1) capacidade de permanecer estável no sistema vascular (sangue) até atingirem seu alvo, TME, 2) para escapar da depuração do sistema reticuloendotelial (RES), 3) escapar do sistema de fagócitos mononucleares ( MPS), 4) se acumulam em TME via vasculatura tumoral, 5) penetração de alta pressão no fluido tumoral e 6) atingem o alvo e apenas interagem com células tumorais [26]. Os aspectos vitais, como funcionalização da superfície, propriedades físico-químicas e características fisiopatológicas regulam o processo de direcionamento de fármacos NP.
Geralmente, os NPs considerados aptos para o tratamento do câncer têm uma faixa de diâmetro de 10–100 nm. A fim de compreender o processo de interação e interferência entre os portadores de NP e as células cancerosas e a biologia do tumor, é importante abordar os mecanismos de direcionamento. Os mecanismos de direcionamento podem ser amplamente classificados em dois grupos, direcionamento passivo e direcionamento ativo.
Segmentação passiva
A observação do acúmulo preferencial de poucas macromoléculas nas células cancerosas foi constatada no final da década de 1980. A primeira macromolécula relatada como acumulando no tumor foi poli (estireno-co-ácido maleico) -neocarzinostatina (SMANCS) por Matsuura e Maeda [27]. Em estudos posteriores, esta distribuição preferencial foi atribuída à ocorrência de fenestrações que são encontradas nos vasos sanguíneos do tumor danificado e à drenagem linfática deficiente, cujo amálgama é conhecido como "efeito de permeação e retenção aprimorada".
Sob certas condições, como hipóxia ou inflamação, a camada de endotélio dos vasos sanguíneos torna-se mais permeável [28]. Em situações de hipóxia, as células tumorais de crescimento rápido tendem a ativar mais vasos sanguíneos ou engolfar os existentes para lidar com a situação. Este processo é conhecido como neovascularização. Esses novos vasos sanguíneos vazam, pois têm poros grandes que levam a uma baixa seletividade permanente dos vasos sanguíneos do tumor em comparação com os vasos sanguíneos normais [29, 30]. Esses grandes poros ou fenestrações variam de 200 a 2000 nm, dependendo do tipo de câncer, TME e localização [31]. Esta angiogênese rápida e defeituosa fornece muito pouca resistência ao extravasamento e permite que os NPs se difundam a partir de tais vasos sanguíneos e, por fim, se acumulem nas células cancerosas.
Em tecidos normais, a drenagem de LEC (líquido extracelular) para os vasos linfáticos freqüentemente ocorre a uma velocidade média de fluxo de 0,1–2 µm / s, o que mantém a drenagem e renovação constantes [32]. Quando um tumor é formado, a função linfática é prejudicada, o que resulta em captação mínima de fluido intersticial [33]. Este recurso contribui para a retenção de NPs, uma vez que não são eliminados e acumulados no interstício do tumor. Este processo denota a parte de retenção aprimorada do efeito EPR. Esta característica excepcional não se aplica a moléculas com tempo de circulação curto e é eliminada rapidamente das células cancerosas. Portanto, para melhorar tais situações, o encapsulamento dessas pequenas moléculas em carreadores de drogas nanométricas é rotineiramente realizado para aumentar sua farmacocinética, fornecer seletividade tumoral e reduzir os efeitos colaterais [34].
Sobre o efeito EPR, o TME é um recurso vital na seleção de alvos passivos. Uma das características metabólicas importantes das células tumorais em rápida proliferação é a glicólise. É a principal fonte de energia para a divisão celular [35] e torna o ambiente circundante ácido. Este pH reduzido de TME pode ser explorado para usar NPs sensíveis ao pH que liberam drogas em pH baixo [36].
Este tipo de direcionamento de tumor é denominado como "passivo". O direcionamento passivo depende principalmente da biologia tumoral diferente (vascularidade, fluidez) e características do portador (tamanho e tempo de circulação). Este tipo de direcionamento a tumor não possui um ligante específico para certos tipos de células tumorais. O efeito EPR depende muito da biologia tumoral fundamental, como 1) o grau ou extensão da angiogênese e linfangiogênese, 2) a extensão ou grau de invasão tumoral perivascular e 3) pressão intratumoral. Esses fatores, combinados com as características físico-químicas dos NPs, determinam a eficiência do sistema de entrega de drogas NP (Fig. 3).
Segmentação de celular passiva
Exemplos de segmentação passiva
Os taxanos são um dos grupos de drogas de maior sucesso usados no tratamento do câncer. O paclitaxel demonstrou grande potência contra uma ampla gama de cânceres. Câncer de mama, câncer de pulmão (células pequenas e não pequenas) e câncer de ovário são as histologias mais tratadas com taxanos. US-FDA, em 2005, aprovou Abraxane® (paclitaxel ligado à albumina, Abraxis Bio-Sciences), que é usado para câncer de mama avançado ou metastático (MBC).
Abraxane® é um medicamento anti-microtúbulo que estabiliza os microtúbulos evitando a despolimerização. Ocorre quando a droga estimula a montagem de microtúbulos a partir de dímeros de tubulina. Este ganho de estabilidade dificulta a reorganização dos microtúbulos, o que é muito importante durante a interfase e as funções celulares mitóticas. Durante o ciclo celular e a mitose, o paclitaxel, um taxano bem utilizado, dispara uma matriz incomum de microtúbulos juntamente com vários asteres, respectivamente. Abraxane® sozinho ou combinado com outro agente citotóxico, como a gemcitabina, diminui o estroma pancreático em modelos de camundongos com xenoenxerto de câncer pancreático [37].
Genexol PM® é uma nanoformulação inovadora de paclitaxel e formulação micelar polimérica liofilizada estéril sem CrEL. Genexol PM®, de acordo com os testes, demonstrou ter uma dose máxima tolerada (MTD) três vezes maior em camundongos nus. Além disso, a biodistribuição exibiu níveis duas a três vezes maiores em diferentes tecidos, como fígado, baço, rim e pulmão, e mais proeminentemente nas células cancerosas. Foi aprovado na Coreia do Sul para tratar MBC. Ainda está em estudo clínico de fase II nos EUA para tratar câncer de pâncreas [38].
DaunoXome® (daunorrubicina lipossomal; Gilead Science / Diatos) é um medicamento anticâncer que reduz o crescimento de células tumorais. A substância ativa é a daunorrubicina. É uma formulação única de daunorrubicina (na forma de lipossoma) usada para tratar o sarcoma de Kaposi, uma forma de câncer que afeta a pele, os pulmões e os intestinos. US-FDA aprovou isso em 1996 [39].
Embora a neovascularização e a angiogênese influenciem a difusão dos NP, ela leva a uma maior pressão intersticial, que inibe o acúmulo de NPs. Além disso, devido ao suprimento sanguíneo heterogêneo, o crescimento das células tumorais é irregular, ou seja, as células que estão próximas aos vasos sanguíneos se dividem mais rapidamente do que aquelas que estão longe do vaso sanguíneo ou profundamente na área hipóxica ou necrótica de formação de núcleo dentro o tumor. Este vazamento irregular, que causa alta pressão intersticial, impede a administração e o acúmulo de drogas e retarda o processo de neovascularização [34]. No entanto, é possível controlar o efeito do EPR, tanto mecanicamente quanto quimicamente. Estes incluem óxido nítrico, peroxinitrato, bradicinina, VPF (fator de permeabilidade vascular), ultrassom, radiação, hipertermia, etc. No entanto, existem certas limitações e contra-indicações.
Segmentação ativa
O direcionamento ativo depende de ligantes ou moléculas específicas, como a transferrina e o folato, que se ligam a moléculas ou receptores que são especificamente expressos ou superexpressos nas células alvo (órgãos, tecidos, células ou domínios subcelulares doentes) [40]. Este tipo de direcionamento é denominado direcionamento mediado por ligante [41]. Aqui, os NPs que possuem ligante com funções específicas, como retenção e captação, precisam estar próximos ao alvo para que haja maior afinidade. Essa estratégia aumenta as mudanças de ligação dos NPs à célula cancerosa, aumentando a penetração da droga. A principal indicação do mesmo foi observada em 1980 com anticorpos enxertados na superfície de lipossomas [34], seguido por vários outros tipos de ligantes como peptídeos, aptâmeros. Conseqüentemente, o método principal tem como objetivo aumentar o crosstalk entre NPs e o alvo sem flutuar a biodistribuição total [42]. O mecanismo vital de direcionamento ativo ou direcionamento mediado por ligante é a identificação do ligante pelos receptores do substrato alvo. Os ligantes ilustrativos podem incluir proteínas, peptídeos, anticorpos, ácidos nucleicos, açúcares, pequenas moléculas como vitaminas, etc. [43]. Os receptores mais comumente estudados são o receptor da transferrina, o receptor do folato, as glicoproteínas e o receptor do fator de crescimento epidérmico (EGFR). A interação ligante-alvo desencadeia o dobramento da membrana e a internalização de NPs via endocitose mediada por receptores. Existem vários mecanismos pelos quais a segmentação ativa ocorre. A maioria do direcionamento de tumor é feito pelo direcionamento de células tumorais em geral por NPs. Este processo melhora a penetração celular. Como afirmado antes, a transferrina é um dos receptores amplamente estudados. É um tipo de glicoproteína sérica que auxilia no transporte de ferro para as células. Descobriu-se que esses receptores estão superexpressos na maioria das células tumorais, especialmente nos tumores sólidos, e são expressos em níveis mais baixos nas células saudáveis. Portanto, podemos modificar os NPs com ligantes associados que têm como alvo específico a transferrina [44]. Por exemplo, as células A2780 de carcinoma de ovário superexpressam a transferrina. Esse recurso é usado por NPs PEG-fosfatidil-etanolamina modificados com transferrina (Tf-Mpeg-pe) que visam especificamente essas células [45]. Outro método alternativo é direcionar as células adjacentes às células cancerosas, como as células endoteliais angiogênicas. Essas células também têm contato próximo com os vasos sanguíneos do tumor. Essa estratégia torna possível criar hipóxia e necrose, reduzindo o suprimento de sangue para as células cancerosas. Foi descoberto que os tecidos tumorais são mais ácidos do que os normais. Isso foi amplamente explicado pelo efeito Warburg [46]. Isso explica a mudança do metabolismo das células cancerosas para a glicólise, formando ácido lático. Quando o ácido láctico se acumula, a célula morre. Para lidar com essa situação, as células começam a superexpressar bombas de prótons que bombeiam o excesso de ácido láctico para o ambiente extracelular, tornando-o mais ácido. Portanto, o sistema de entrega de drogas sensível ao pH baseado em lipossomas foi estudado.
A natureza multivalente dos NPs melhora o crosstalk de NPs revestidos com ligante com células cancerosas alvo. O projeto de tais NPs é complexo, pois a arquitetura NP e a química do ligante-alvo influenciam a eficácia de todo o método. Outros fatores, como via de administração, propriedades físico-químicas, como densidade do ligante [47] e tamanho dos NPs [8], contribuem para o sucesso do sistema (Fig. 4).
Representação pictórica de segmentação celular ativa
Exemplos de segmentação ativa
EGFR, um membro da família ErbB de receptores de tirosina quinase (TK), é superexpresso em vários tipos de câncer, especialmente com histologia de células escamosas. NPs de ouro com nanopartículas de anti-EGFR-PEG-AuNPs e anti-IgG-PEG-Au podem ser usados para direcionar o SCC humano [48].
Herceptin® é um medicamento terapêutico que tem como alvo o receptor 2 do EGF humano (HER2) que é superexpresso nas superfícies das células do câncer de mama. A doxorrubicina lipossomal PEGuilada direcionada a HER2 foi desenvolvida para reduzir a cardiotoxicidade, um efeito colateral conhecido das antraciclinas [49].
A superfície do endotélio tumoral expressa uma glicoproteína conhecida como molécula de adesão de células vasculares-1 (VCAM-1) que está envolvida no processo de angiogênese. Um estudo destacou NPs que têm como alvo VCAM-1 no modelo de câncer de mama, indicando seu papel potencial [50].
O ácido fólico, também conhecido como vitamina B9, é vital na síntese de nucleotídeos. O ácido fólico é internalizado pelo receptor de folato, que é expresso nas células. No entanto, as células tumorais superexpressam FR-α (alfa isoforma do receptor de folato), enquanto FR-β é superexpressado em células cancerosas líquidas [51]. O direcionamento dos receptores de folato por NPs tem sido atualmente para tratamentos específicos de câncer [52, 53].
Nanopartículas na terapia do câncer
NPs usados extensivamente em sistemas de entrega de drogas incluem NPs orgânicos, NPs inorgânicos e NPs híbridos (Fig. 5).
Vários tipos de nanomateriais usados na terapia do câncer
Nanopartículas orgânicas
Nanopartículas poliméricas
Nanopartículas poliméricas (PNPs) são bem definidas como “macromoléculas coloidais” com arquitetura estrutural específica formada por diferentes monômeros [54]. A droga é aprisionada ou anexada ao exterior dos NPs, criando uma nanosfera ou nanocápsula para atingir a liberação regulada da droga no alvo [55]. Inicialmente, os PNPs eram compostos de polímeros não biodegradáveis, como poliacrilamida, polimetilmetacrilato (PMMA) e poliestireno [56]. No entanto, o acúmulo desses levou à toxicidade devido à dificuldade em eliminá-los do sistema. Polímeros biodegradáveis, como ácido polilático, poli (aminoácidos), quitosana, alginato e albumina estão sendo usados e são conhecidos por reduzir a toxicidade e aumentar a liberação de drogas e biocompatibilidade [57]. Pesquisas comprovadas refletiram que, ao revestir os PNPs com polissorbatos e ao usar o efeito surfactante dos polissorbatos. O revestimento externo aumenta as interações dos NPs com a membrana da célula endotelial da barreira hematoencefálica (BBB) [58].
Um estudo mostrou que nanocápsulas carregadas com indometacina envolveram uma diminuição substancial no tamanho do tumor e melhoraram a sobrevida em um modelo de glioma de xenoenxerto em ratos [59]. Este é um campo em crescimento, com mais de dez NPs poliméricos contendo drogas anticâncer em desenvolvimento clínico. Alguns exemplos incluem paclitaxel poliglumex (Xyotax), PEG-camptotecina (Protecano), dextran-camptotecina modificada (DE 310), copolímero HPMA-DACH-platinado (AP5346), copolímero-platinado HPMA (AP 5280), copolímero HPMA-paclitax ( PNU166945), e copolímero HPMA-doxorrubicina galactosamina (PK2) [60].
Dendrímeros
Os dendrímeros são macromoléculas poliméricas esféricas com arquitetura hiper-ramificada definida. Estruturas altamente ramificadas são a característica dos dendrímeros. Normalmente, a síntese de dendrímeros é iniciada pela reação de um núcleo de amônia com ácido acrílico. Essa reação resulta na formação de uma molécula de "triácido" que ainda reage com etilenodiamina para produzir "tri-amina", um produto GO. Este produto reage posteriormente com o ácido acrílico para dar origem ao hexa-ácido, que posteriormente produz o produto “hexa-amina” (Geração 1) e assim por diante [61]. Normalmente, o tamanho dos dendrímeros varia de 1 a 10 nm. No entanto, o tamanho pode atingir até 15 nm [62]. Dada sua estrutura específica, como peso molecular definido, ramos ajustáveis, biodisponibilidade e carga, eles são usados para direcionar os ácidos nucleicos. Alguns dendrímeros que são amplamente usados são poliamidoamina (PAMAM), PEG (poli (etilenoglicol)), PPI (polipropilenimina) e TEA (trietanolamina) [63].
Um dendrímero PAMAM foi inicialmente projetado para alcançar o gerenciamento de MDR. Os dendrímeros PAMAM montados com DNA foram descritos extensivamente. Em comparação com animais tratados com quimioterapia de agente único, os dendrímeros sintetizados atrasaram significativamente o crescimento de xenoenxertos de câncer epitelial [64].
Nanopartículas de mAb
Os anticorpos monoclonais são amplamente usados no tratamento do câncer por suas habilidades específicas de direcionamento [65]. Esses mAb agora são combinados com NPs para formar conjugados anticorpo-droga (ADCs). Provou-se que são altamente específicos e atraentes do que os medicamentos citotóxicos ou o mAb isoladamente. Por exemplo, um NP droga-anticorpo que consiste em núcleo de paclitaxel e uma superfície modificada com trastuzumabe apresentou uma melhor eficácia antitumoral e menor toxicidade do que paclitaxel de agente único ou trastuzumabe sozinho no controle de células epiteliais da mama HER2 positivo [66].
Vesículas extracelulares
Vesículas extracelulares (EVs) são vesículas de fósforo-lipídeo de camada dupla variando de 50-1000 nm n de tamanho [67]. Os EVs são secretados continuamente por diferentes tipos de células e variam em origem, tamanho e composição. EVs são divididos em três classes:1) exossomos, 2) microvesículas e 3) corpos apoptóticos [68]. NPs combinados com exossomos são amplamente usados, pois possuem lipídios e moléculas que são muito semelhantes às células de origem. Além disso, eles escapam da vigilância imunológica e se internalizam muito rapidamente nas células cancerosas. Eles agem como veículos naturais, entregando drogas citotóxicas e outras drogas antitumorais aos locais-alvo. Os exossomos carregados com doxorrubicina (exoDOX) são o melhor exemplo. exoDOX é usado para tratar câncer de mama e tem mostrado ótimos resultados em comparação ao tratamento conservador com doxorrubicina, aumentando a citotoxicidade e evitando a cardiotoxicidade [69]. Os NPs do exossomo têm recursos de biocompatibilidade intrínseca, estabilidade química avançada e comunicações intracelulares em comparação com os NPs sintéticos. No entanto, desvantagens como deficiência de condições padrão para isolamento e purificação exossômica são cruciais e precisam ser abordadas [70, 71].
Lipossomas
Estas são vesículas esféricas compreendendo fosfolipídios que podem ser unilamelares ou multilamelares para encapsular moléculas de drogas [72]. Os lipossomas são únicos por terem características como baixa toxicidade intrínseca, fraca imunogenicidade e inércia biológica [73]. Os lipossomas são o primeiro medicamento em nanoescala aprovado em 1965 [74]. Uma estrutura típica de lipossoma é composta por um "núcleo hidrofílico" e uma "bicamada fosfolipídica hidrofóbica". Esta arquitetura única torna possível para eles aprisionarem drogas hidrofílicas e hidrofóbicas para proteger eficazmente a droga aprisionada da degradação ambiental em circulação [75].
Os lipossomas fornecem uma excelente plataforma para a entrega de drogas, como doxorrubicina, paclitaxel e ácido nucleico, bem como demonstrando maior eficácia antitumoral e maior biodisponibilidade [76]. Doxil® e Myocet® são formulações aprovadas à base de lipossomas de daunorrubicina usadas para tratar MBC [77, 78]. No entanto, devido a deficiências como eficácia de encapsulação diminuída, remoção rápida por MP, adsorção de células e vida útil curta, a aplicação de NPs baseados em lipossomas é limitada.
Nanopartículas lipídicas sólidas (SLN)
Eles são nanocarreadores coloidais (1–100 nm) compostos de uma monocamada de fosfolipídeo, emulsificante e água [79]. Eles são conhecidos como nanomateriais de dimensão zero. O componente lipídico pode ser triglicerídeos, ácidos graxos, ceras, esteróides e lipídeos PEGuilados [80]. Ao contrário dos lipossomas convencionais, os SLNs têm uma "estrutura semelhante a micelas" dentro da qual a droga é aprisionada em um núcleo não aquoso. Examples include mitoxantrone-loaded SLN, which has shown reduced toxicity and enhanced bioavailability [81]. The incorporation of doxorubicin and idarubicin by SLN in “P388/ADR leukemia cells” and the “murine leukemia mouse model” has shown positive results [82].
Nanoemulsions
Nanoemulsions are colloidal NPs with heterogeneous mixtures of an oil droplet in aqueous media ranging from 10–1000 nm [83]. Three representative types of nanoemulsions can be made in:1) oil-in-water system, 2) water-in-oil system, and 3) bi-continuous nanoemulsions. Membrane-modified nanoemulsions have been extensively studied. For instance, nanoemulsions loaded with spirulina and paclitaxel showed an improved anti-tumor effect by regulating immunity through TLR4/NF-kB signaling pathways [84]. Nanoemulsion consisting of rapamycin, bevacizumab, and temozolomide is known to treat advanced melanoma [85]. Nanoemulsions are different from liposomes and certainly have enhanced characteristics than others, such as optical clarity, stability, and biodegradability [86]. However, there are challenges to clinical applications of these nanoemulsions as these involve high temperature and pressure and instruments such as homogenizers and microfluidizers that are expensive.
Cyclodextrin Nanosponges
Cyclodextrins are usually used as stabilizers to increase the drug loading capacity of NPs [87]. Nanosponges are tiny, mesh-like structures [88]. Β-cyclodextrin nanosponges loaded with paclitaxel have shown sound cytotoxic effects in MCF-7 cell line culture [89]. Similarly, camptothecin has shown improved solubility and stability when formulated with cyclodextrin-based nanosponges [90].
Inorganic Nanoparticles
Carbon Nanoparticles
Carbon NPs as the name suggests are based on the element carbon. They have been widely utilized in medical arenas because of their optical, mechanical, and electronic properties combined with biocompatibility [91]. Due to their inherent hydrophobic nature, carbon NPs can encapsulate drugs through π-π stacking [92]. Carbon NPs are further categorized into graphene, carbon nanotubes, fullerenes, carbon nanohorns, and graphyne. Although all these are carbon-based, they vary in their structure, morphology, and properties.
“Graphene” is 2D crystal with sp2-hybridized carbon sheet that holds extraordinary mechanical, electrochemical, and high drug loading properties. Further, based on composition, properties, and composition, graphene can be divided as follows:1) single-layer graphene, 2) graphene oxide (GO), 3) reduced graphene oxide (rGO), and 4) multi-layer graphene [93]. GO and rGOs are widely used due to their ability to target hypoxia [94] and irregular angiogenesis in TME [95]. Studies have shown that GO-doxorubicin exhibits higher anticancer activities in cellular models of breast cancer [96].
Fullerenes are large carbon-cage molecules composed of carbon allotrope with different conformation types such as sphere, ellipsoid, or tube. They are the most widely studied nanocarriers as they have typical structural, physical, chemical, and electrical properties [97]. These are used in photodynamic therapy as they have triple yield and generate oxygen species due to the presence of extended π-conjugation and the ability to absorb light [98]. PEG-modified fullerenes showed promising photodynamic effects on tumor cells [99].
Carbon nanotubes (CNTs) are cylindrical tubes, most often considered as rolls of graphene, were discovered in the late 1980s. They are classified into two groups:1) single-walled CNTs and 2) multi-walled CNTs. As they are carbon-based, they can bring upon immune response by interacting with immune cells, thereby suppressing the tumor growth. Traditionally, they have been used as DNA delivery vectors and for thermal ablation therapy. For instance, a fluorescent single-walled CNT with mAb encapsulating doxorubicin is used to target colon cancer cells. Such CNTs form a complex which is effectively engulfed by the cancer cells leading to the intracellular release of doxorubicin, whereas the CNTs are retained in the cytoplasm [100].
Quantum Dots
Quantum dots are typically nanometer-scale semiconductors with a broad spectrum of absorption, narrow emission bands, and high photostability, allowing them to be widely used in biological imaging [101]. Based on carbon, these are divided into:1) graphene quantum dots, 2) nanodiamond quantum dots, and 3) carbon quantum dots. Besides biological imaging, quantum dots are being actively investigated in cancer treatment. The most commonly used quantum dots is graphene quantum dots due to their inherent biocompatibility and rapid excretion. For example, quantum dots aptamer—doxorubicin conjugate targets prostate cancer cells [102]. However, the deficiency of optimized process in producing quantum dots is the major obstacle.
Metallic Nanoparticles
Metallic nanoparticles are commonly explored in “biological imaging” and targeted DDS due to their remarkable optical, magnetic, and photothermal properties. Some of the most commonly used metallic NPs are gold NPs, silver NPs, iron-based NPs, and copper NPs. Gold NPs are used as intracellular targeting drug carriers because the size and surface properties are easily controlled [103]. Moreover, their visible light extinction behavior makes it possible to track NP trajectories in the cells. “Anti-HER2 functionalized gold-on-silica nanoshells” have been shown to aim HER2 positive breast cancer cells [104]. Combidex®, an iron oxide NP formulation, is presently in the late-stage clinical testing phase to detect nodal metastases [105]. Feraheme®, a ferumoxytol containing iron oxide NP formulation, is used to treat iron-deficiency anemia. This is also used to treat nodal metastases in prostate and testicular cancer and was approved by FDA in June 2009 [106, 107].
Magnetic Nanoparticles
Magnetic NPs are generally used in MRI imaging, and drug delivery contains metal or metal oxides. These are usually covered with organic substances like polymers and fatty acids to enhance stability and biocompatibility [108]. LHRH-conjugated superparamagnetic iron oxide NPs are effective in targeting and imaging of breast cancer [109]. Moreover, magnetic NPs are used in magnetic hyperthermia for thermal ablation of cancer cells [110, 111]. Some of the magnetic NPs that are in the market or in the clinical trial phase are Feridex® and Resovist® for liver metastasis and colon cancer [112].
Calcium Phosphate Nanoparticles
“Calcium phosphate NPs” is biologically compatible, biodegradable, and do not cause any harsh adverse reactions. Hence, they are used as a delivery agent for insulin, growth factors, antibiotics, and contraceptives [113]. They are also used in the delivery of oligonucleotides and plasmid DNA [114]. Calcium phosphate NPs combined with either viral or non-viral vector has been positively used as delivery vectors in cellular gene transfer. A “liposomal nanolipoplex formulation” of calcium and glycerol has shown decreased toxicity and enhanced transfection features [115, 116].
Silica Nanoparticles
Silica being a significant component of many natural materials was only studied concerning biology recently. Silica NPs are commonly used to deliver genes by functionalizing the NP surface with amino-silicanes [117]. N-(6–aminohexyl)–3–aminopropyl–trimethoxysilane functionalized silica NPs have shown excellent efficiency in the transfection of Cos-1 cells with minimal toxicity and is now commercially available [118]. Mesoporous silica NPs are considered one of the best drug carriers due to their better pharmacokinetic properties. They have been extensively used in immunotherapy. According to a study, colorectal cancer cells have shown successful uptake of camptothecin-loaded mesoporous silica NPs.
Mechanism of NPs in Overcoming Drug Resistance
Drug resistance is one of the chief problems in cancer therapy and management. It prevails across all types of cancer and all possible treatment modalities. Drug resistance is a phenomenon that results when diseases become tolerant to pharmaceutical treatments. Drug resistance can be classified into two types:1) innate and 2) acquired [119]. Innate resistance usually results from pre-existing mutations in the genes that are involved in cell growth or apoptosis. Acquired resistance is defined as the type of resistance that is developed after a particular anti-tumor treatment, which may result from the development of new mutations or from alterations in the TME during treatment. Nanoparticles, due to their extraordinary ability to co-encapsulate multiple therapeutic agents, can also be used to overcome cancer-related drug resistance.
Targeting Efflux Transporters
Efflux transporters are classified under the family of “ATP-binding cassette (ABC) transporters.” These have a significant role in MDR. The primary function of these transporters is to pump out drugs out of the cell and reduce the concentration. “P-glycoprotein (P-gp)” is one such efflux transporter that is overexpressed by drug-resistant cancer cells [120, 121].
Overexpression of P-gp has been linked with inadequate treatment response, especially in breast cancer [122] and ovarian cancer [123]. NPs can be used to tackle efflux pumps. As NPs internalize the cell via “endocytosis” instead of diffusion and release the drug at the “perinuclear site,” which is distant from active efflux pumps, NPs can bypass the efflux pumps [124]. Besides, by modifying the control of drug releases, such as by utilizing low pH levels and redox as triggers, NPs can effectively bypass efflux pumps [125, 126].
Combination therapy is yet another method to overcome MDR. NPs can be loaded with multiple drugs within a single drug carrier [127]. Inhibiting efflux transporter expression instead of just dodging them would be another viable option. This can be achieved by building NPs in such a way that it can entrap both efflux pump inhibitors and chemotherapy agents [128]. A recent study positively reflected upon reversing MDR in breast cancer cells by using NPs that co-deliver COX-2 inhibitors and doxorubicin [129]. Similarly, using silica NP that encapsulates miRNA-495 and doxorubicin has proved effective in overcoming drug resistance in lung cancer cells [130]. Another interesting study found out that using NPs in the tumor neo-vasculature targeting KDR receptors is a more effective anti-tumor function than P-gp inhibitor combination therapy. Yet, another way of overcoming drug resistance is by depleting the source of ATP, which is essential for the functioning of ABC transporters. This can be done by targeting mitochondria which leads to a decrease in ATP production.
Targeting an Apoptotic Pathway
Cancer cells proliferate due to faulty apoptotic machinery and upsurge their survival adding to drug resistance [131]. The faulty apoptotic pathway gets activated by “deregulation of Bcl-2” and “nuclear factor kappa B (NF-κB).” These are the most widely investigated anti-apoptotic proteins and can be potentially used as the target for reversing drug resistance. Using a classic process of co-delivery of “Bcl-2 siRNA and chemotherapeutics” by NPs is a way to overcome MDR [132]. NF-κB inhibitors have been used in combination with “pyrrolidine dithiocarbamate (PDTC)” [133] and curcumin [134]. Besides suppressing anti-apoptotic factors, triggering pro-apoptotic factors is another to fight “apoptotic pathway-mediated drug resistance.” For instance, a combination of ceramide and paclitaxel is a good example [135]. Ceramide restores the expression of a chief tumor suppressor, p53 protein, by regulating alternative pre-mRNA splicing. Delivering ceramide via NPs is an excellent way to correct the p53 missense mutation [136]. Owing to its potential, a combination of ceramide and paclitaxel has shown significant therapeutic efficacy in cancer drug resistance models. Transfecting the p53 gene by cationic SLNs has been reported in lung cancer cases [137]. Similarly, transfecting the p53 gene by PLGA has been carried out in breast cancer cells models that have shown potent induction of apoptosis and inhibition of tumor growth [138].
Some NP-based DDS act by impeding efflux pumps and encouraging apoptosis [139]. A pioneering study conducted to prove both pump- and non-pump-mediated drug resistance used an “amphiphilic cationic NP” entrapping paclitaxel and Bcl-2 converter gene in drug-resistant liver cancer models. NP complex diminished P-gp-induced drug efflux and the apoptosis activation. Similarly, co-delivery of “doxorubicin and resveratrol encapsulated in NPs” has shown noteworthy cellular toxicity on doxorubicin resistance breast cancer cells by downregulating the expression of Bcl-2 and NF-κB, thereby initiating apoptosis as well as through the inhibition of efflux transporter expression [140]. A similar study was done on multi-drug resistant prostate cancer cells by using folic acid-conjugated planetary ball milled NPs encapsulated with resveratrol and docetaxel. This worked by downregulating anti-apoptotic gene expression while inhibiting ABC transporter markers [141].
Targeting Hypoxia
Hypoxia is yet an additional aspect that backs MDR [142]. Due to abnormal blood vessels in the vicinity of the tumor and due to the increasing demand of oxygen by the rapidly growing tumor, some tumor cells are repeatedly in a hypoxic condition. The part of the tumor that is in hypoxic condition often escapes from the chemotherapy drugs. Hypoxia creates an oxygen ramp inside the tumor that intensifies tumor heterogeneity, encouraging a more aggressive phenotype. Moreover, the hypoxia condition has been established to facilitate the overexpression of efflux proteins [143]. The major protein, “hypoxia-inducible factor 1α (HIF-1α)” acts an important role. Hence targeting HIF-1α or silencing HIF-1α gene is a way to overcome drug resistance. NPs containing HIF-1α siRNA can be used to reduce hypoxia-mediated drug resistance [144]. Instead of directly targeting HIF-1α, indirect inhibition of HIF-1α signaling can be used. For example, the “PI3K/Akt/mTOR pathway” is known to control the expression of HIF-1α. Inhibition of this pathway effectively downregulates the expression of HIF-1α, which enhances the sensitivity of MDR cells to cancer treatment [145]. NPs like PLGA-PEG and PEGylated and non-PEGylated liposomes can be used effectively. In addition, “heat shock protein 90 (HSP90)” is needed for transcriptional activity of HIF-1 and inhibition of HSP90, which downregulates the expression of HIF-1α [146]. The HSP90 inhibitor in “17AAG loaded NPs” has dramatically improved MDR in bladder cancer treatment [147].
Nanoparticles and Proteomics
When NPs are subjected to the biological system, they are surrounded by cellular and serum proteins which form a structure known as protein corona (PC) [148]. Based on the degree of interaction of these proteins with the NPs, there are classified into the hard corona and soft corona. “Hard corona” is formed when these proteins have a high binding affinity towards the NPs. “Soft corona” is produced when these proteins are loosely bound to the NPS. It has been established that the most protein forming a PC first will be eventually substituted by proteins with higher affinities. This is known as Vroman effect [149]. Hence developing the technology that can manufacture NPs with desired properties is essential. Several proteomic approaches such as MS, LC–MS, SDS-PAGE, isothermal microcalorimetry (ITC), etc. [150], are being used. PC affects the crosstalk of NP with the biological setting and thereby governs the application and usage of the same in the medical field.
Cancer proteomics studies the number of proteins in cancer cells and serum, which supports hunting proteins and biomarkers that aids in diagnosis, treatment, and prognosis [151]. It also helps in understanding cancer pathogenesis and drug resistance mechanism. Post-translational modifications (PTMs) play an indispensable part in occurrence, recurrence, and metastasis. Besides using chemotherapy and kinase inhibitors, novel agents like siRNA, mRNA, and gene editing are central therapeutics used with NPs.
Nanotechnology for Small Interfering RNA (siRNA) Delivery
siRNAs are small ds RNA molecules (around 21 nucleotides long) that suppress the expression of genes in the target. This process is known as “RNA interference.” A few siRNA-based NPs that are currently under clinical investigations are ALN-TTR01 that is used to target the transthyretin gene to treat transthyretin-mediated amyloidosis, and Atu027, which is a liposomal siRNA that targets protein kinase N3 and TKM-ApoB that knock downs the expression of ApoB [152, 153].
Nanotechnology for Tumor microRNA Profiling and Delivery
MicroRNAs are a class of endogenous “single-stranded non-coding RNA” molecules that control post-transcription gene expression by blocking translation of the target mRNA or repressing protein production by destabilizing mRNA [154]. These are emerging as vital biomarkers that are a significant target for cancer diagnosis, therapy, and treatment. The base priming nature of nucleic acid forms the very foundation for nanotechnology used miRNA profiling techniques. Several profiling techniques use biosensors or surface plasmon resonance imaging techniques in combination with molecular biology enzymatic reactions. Nanotechnology can be used for the delivery of MicroRNAs. For example, biodegradable polycationic prodrugs showed promising results in the regulation of polyamine metabolism [155]. MicroRNA-loaded polycation-hyaluronic acid NPs of single-chain antibody fragments have shown progressive downregulation of “survivin expression” in high metastatic cancer load in the lung of murine B16F10 melanoma.
DNA Nanotechnology for Cancer Therapy
DNA-based nanostructures have been synthesized for DNA sensors to detect nucleic acid, DNA-coated gold NPs for lead sensing by hybridizing Pb-activated DNAzyme to the linking DNA, scaffolds to organize organics, inorganic, and biomolecules into distinct morphology molecular transporters, and drug delivery (Table 1).
Advantages of Nanoparticles in Cancer Therapy
The utilization of nanotechnology in the diagnosis, treatment, and management of cancer has led to a whole new era. NPs, either by active or passive targeting, augment the intracellular concentration of drugs while avoiding toxicity in the healthy tissue. The targeted NPs can be designed and altered as either pH-sensitive or temperature-sensitive to establish and regulate the drug release. The pH-sensitive drug delivery system can deliver drugs within the acidic TME. Similarly, the temperature-sensitive NPs release the drugs in the target site due to changes in temperature brought in by sources like magnetic fields and ultrasound waves. In addition, the “physicochemical characteristics” of NPs, such as shape, size, molecular mass, and surface chemistry, have a significant part in the targeted drug delivery system. Further, NPs can be modified according to the target and used to target a particular moiety.
Conventional chemotherapy and radiation therapy have several disadvantages concerning efficacy and side effects because of uneven dispersal and cytotoxicity. Therefore, cautious dosing is required that effectively kills cancer cells without any significant toxicity. To reach the target site, the drug has to pass several fortifications. Drug metabolism is a very complex process. In physiological conditions, the drug needs to pass TME, RES, BBB, and kidney infiltration. RES or macrophage system is made up of “blood monocytes, macrophages, and other immune cells” [160]. MPS in the liver, spleen, or lungs react with the drugs and activate “macrophages or leukocytes” that rapidly remove the drug. This leads to a short half-life of the drug [161]. To overcome this, NPs with “surface modification,” such as PEG, bypass this mechanism and increase the “drug half-life.” Besides, kidney infiltration is a crucial function in the human body. Proper kidney infiltration thus minimizes the toxicity caused by NPs.
The brain-blood barrier (BBB) is a specialized protection structure offered to protect the CNS from harmful and toxic agents. “Brain capillary endothelial cells” are arranged in the form of a wall that provides essential nutrients to the brain. Since the primary function of BBB is to block toxic agents to reach the brain, currently available chemotherapy agents for brain cancer are highly limited to intraventricular or intracerebral infusions [162]. However, NPs are known to cross BBB. Now, several approaches such as EPR effect, focused ultrasound, peptide-modified endocytosis, and transcytosis are used to deliver NPs. Glutathione PEGylated liposome encapsulated with methotrexate showed improved methotrexate uptake in rats [163]. Au-NPs are often used as they have proven to help transport drugs to induce apoptosis [164].
NPs being carriers also increase the drug stability by preventing the degradation of the encapsulated cargo. Additionally, a large volume of drugs can be encapsulated without any chemical reaction. Dry solid dosage forms are more stable than nanoliquid products [165]. Stabilizers can be used to enhance stability. Yet another way to increase stability is to use porous NPs.
Tumor has unique pathophysiology features such as extensive angiogenesis, flawed vascular architecture and defective lymphatic drainage. The NPs use these features to target tumor tissue. Due to reduced venous return in tumor tissue and meager lymphatic clearance, NPs are effectively retained. This phenomenon is known as EPR. Similarly, by targeting the adjacent tissues, tumor-targeting can be accomplished [166].
NPs can be administered through several routes like oral, nasal, parenteral, intra-ocular etc. NPs have a high surface-to-volume ratio and intracellular uptake. Studies have reported that NPs are more effective than microparticles as drug carriers [167].
Nanoparticles in Immunotherapy
The immune system sets an important part in the establishment and development of cancer cells. The advancement of immunotherapy has revolutionized cancer therapy. It is found that NPs not only help in target delivery of chemotherapy but can also be used in combination with immunotherapy. There are several approaches in immunotherapy aimed at activating the immune system against cancer cells [168] by “immune checkpoint blockade therapy,” “cancer vaccine therapy,” “chimeric antigen receptor (CAR)-T cell therapy,” and “immune system modulator therapy” [169,170,171]. NP-based immunotherapy includes “nanovaccines,” “aAPCs (artificial antigen-presenting cells),” and “immunosuppressed TME targeting.”
Nanovaccines specialize in delivering “tumor-associated antigens” and “adjuvants” to antigen-presenting cells, such as dendritic cells (DCs) [172]. Moreover, these can also be employed as adjuvants to enhance “APC antigen presentation” and promote DC maturation that leads to the stimulation of cytotoxic T cells that have anti-tumor function [173, 174]. Liposomes, PLGA NPs, gold NPs are found to have the ability to deliver TAAs into DCs in the cytoplasm [175]. Mesoporous silica, the most used inorganic NP, has exhibited an adjuvant role, leading to immune response stimulation [176]. Artificial APCs interact with MHC-antigen complexes directly which binds to T cells. They also bind to co-stimulatory molecules that bind to co-stimulatory receptors leading to T cell activation [177]. Targeting the immunosuppressed TME is yet another method of using NPs in immunotherapies. This is done by targeting essential cell types in TME such as “tumor-associated macrophages (TAMs),” regulatory T cells, and “myeloid-derived suppressor cells (MDSCs).”
Besides, the combination of chemoimmunotherapy has been demonstrated to be a capable approach in cancer therapy. For instance, a study has shown that co-loading Nutlin-3a, which is a chemotherapeutic agent and cytokine GM-CSF, in “spermine-modified acetylated dextran (AcDEX) NPs” improved cytotoxic CD8( +) T cells proliferation and activated an immune response [178].
“Programmed cell death protein 1 (PD-1)” and “programmed cell death ligand 1 (PD-L1)” are some of the essential immune checkpoints [179]. Hence immune checkpoint inhibitors are used to target these using NPs. According to a study, conventional immune checkpoint inhibitors of PD-L1/PD-1 displayed inconsistent responses. To enhance the chances and bonding of immune checkpoint inhibitors and immune checkpoints, multivalent poly (amidoamine) dendrimers were used. Usage of these dendrimers not only showed enhanced PD-L1 blockade but also showed improved drug accumulation at the tumor site [180].
Nanoparticles in Cryosurgery
Cryosurgery is an advanced practice of freeze-destroying cancer tissue. Although this is less invasive and causes intraoperative bleeding and postoperative complications, certain drawbacks like inadequate freezing capacity and damage to adjacent cells need to be addressed [181]. The rise of nanotechnology has enabled the use of NPs in cryosurgery.
The primary working of nanocryosurgery is introducing NPs with particular properties into the cancer cells and causing freezing [182]. During this process, ice is formed within the cells, which causes damage to it. This is an important process and can be carried out effectively using NPs. The thermal conductivity property of NPs can be exploited, which significantly freeze the tumor tissue and cause tumor damage [183]. Besides, they cool down rapidly, and it is feasible to regulate the “growth direction” and “direction of the ice ball” (Fig. 6).
Diagrammatic representation of NPs in cryosurgery
When the location of the tumor makes it not feasible for cryosurgery or if other adjacent organs are at risk, there are high chances that the freezing can damage healthy tissue. Recently, phase change materials (PMs) made up of NPs are used to protect the adjacent normal healthy tissue during cryosurgery [184]. For instance, liposome-based microencapsulated phase change NPs have shown incredible results in protecting surrounding healthy tissue [185]. These NPs are deemed to possess large latent heat and low thermal conductivity, making them perfect for cryosurgery.
Significant Challenges in the Clinical Application of Nanoparticles
At present, as nanotechnology has bloomed, the amount of knowledge and research put into nanoparticles has steeply raised. But only a few of them actually make it up to clinical trials. Most of them only halt at in vivo and in vitro stages. Each individual nanoformulation has particular challenges in their clinical translation, but most NPs face similar challenges that can be divided into biological, technological, and study-design related.
Biological challenges include lack of routes of administration, tempering biodistribution, the channel of NPs across the biological barriers, their degradation, and toxicity [186]. NPs are usually injected via intravenous injections directly into the blood, which takes away NPs, making it challenging to stay and interact with the target site. As a result, a high concentration drug is used, which might not provide desired therapeutic effects [187]. However, magnetic NPs can be used to overcome this as many in vivo and in vitro studies have proved the usage of 3D magnetic fields to control the movement of NPs against blood flow. But, the effect of magnetic fields on the human body, crosstalk between magnetic fields, and a large number of NPs has to be researched upon.
Controlling the biological fate of NPs is very hard and needs a lot of focus. Even though NPs are made up of biosafety materials and are modulated accordingly to increase the retention time and half-life, there runs a risk of lung, liver and kidney damage. Some factors that govern toxicity are surface area, particle size and shape, solubility, and agglomeration [188]. NPs have shown greater deposition in the lung with inflammatory, oxidative and cytotoxic effects [189]. Studies reveal that healthy cells often suffer from free radicals generated by NPs [190]. Fabricating NPs with more biocompatible substances like chitosan and materials that disintegrate after near infrared light irradiation may be potential solutions.
Another tricky challenge is avoiding the “mononuclear phagocytic system (MPS).” In biological fluids, NPs adsorb proteins to produce PC, which attacks MPS to uptake NPs. To escape this, NPs have been coated with materials that prevent the formation of the protein corona. However, they have not shown any significant results. Designing NPs that target “macrophages” and using those as new drug vehicles can be pitched to overcome this problem. Currently, preventing macrophage recruitment, depleting and reprograming TAMs, and obstructing “CD47-SIRPα pathways” are commonly used strategies [191].
Technological challenges of NPs include scale-up synthesis, equal optimization, and performance predictions. These are very crucial in safeguarding the clinical success of NPs. Most of the NPs that are used in vivo and in vitro studies are usually produced in minor batches, and scale-up for huge quantities is not constantly feasible given instrumentation and other reasons. The lead clinical candidates that prove to be the best in animal models are not systematically designed optimized. To overcome this, we can use certain methods that can test numerous nanoformulation and by selective iterations selecting a single optimized formulation [192,193,194]. However, such hits shouldn’t be introduced directly in human testing. Predicting nanoparticle efficacy and performance is hard and replicating the in vivo results in human trials is a herculean task. Computational or theoretical modeling along with experimental results can be designed to imitate physiological tissue and surrounding. For instance, organs-on-chips are being actively studied and can improve NP predictions of efficacy and performance.
Study-design challenges like study size, intent, and timing of NP therapies during the therapy impact significantly during clinical studies. Most of the studies revolve around “cell and animal models” that may not provide comprehensible results in human trials. Therefore, the usage of a single model is tough to imitate natural reactions in the human body. In addition, “models of cancer metastasis” should be actively researched as metastasis is one of the significant properties of cancer. Moreover, N = 1 clinical studies will be required if we focus on personalized medicine. This needs to count in many factors such as genetic, environmental, and past medical history. [195, 196]. Another major challenge is that NPs are never used as first-line therapies. Although we have effectively approved nanoformulations, they are usually saved for further treatment if disease progression is found in the clinical trial scenario. Most of the patients have either had progressed on multiple lines of therapies or have gained drug resistance. These situations often skew the clinical trial results and lessen the chance of NP treatment to benefit those who are likely still treatable.
Conclusion and Future Perspective
Nanotechnology has shown a promising new era of cancer treatment by delivering small molecules for cancer detection, diagnosis, and therapy. Cancer therapies based on the exceptional features of NPs are being vastly used in the clinical setting of several cancer types. NP-based DDS is linked with enhanced pharmacokinetics, biocompatibility, tumor targeting, and stability compared to conventional drugs. Moreover, NPs provide an excellent platform for combination therapy which helps in overcoming MDR. With increasing research, several types of NPs, such as polymeric NPs, metallic NPs, and hybrid NPs, have shown improved efficacy of drug delivery. Researchers must be well attentive to the features of the nominated nanoplatforms and the properties of therapeutic agents. However, there are certain limitations like deficiency of in vitro models that precisely replicate in vivo stage, immunotoxicity, the long-term toxicity, and neurotoxicity. Although “nanovaccines” and “artificial APCs” have proved improved efficacy compared to conventional immunotherapy, the clinical efficacy is substandard. The safety and tolerance of these new modalities should to be inspected. Additionally, developing “immunomodulatory factor-loaded NPs” may advance the efficiency of vaccines for immunotherapy.
This is an emerging area, and it is anticipated that with growth in proteomics research on the “mechanism of cancer origin, MDR, occurrence,” more NP-based drugs can be exploited. Compared to the mammoth amount of investigations, only a few NP-based drugs are actually in use, a few others in clinical trials, and most in the exploratory stage. For rational nanotechnology design, more efforts must be reserved in “understanding toxicity, cellular and physiological factors that regulate NP-based drug delivery, EPR, and PC mechanism” in the human body. Based on the evidence cited above, we presuppose that the revolution in clinical translation for NP-based cancer therapy will be attained with nanotechnology and cancer therapy development.
Availability of Data and Materials
Not applicable.
Nanomateriais
- Os cinco principais problemas e desafios para 5G
- Demonstração de um biossensor flexível à base de grafeno para detecção sensível e rápida de células cancerosas do ovário
- Nanopartículas multifuncionais de ouro para aplicações diagnósticas e terapêuticas aprimoradas:uma revisão
- Avanços e desafios dos nanomateriais fluorescentes para aplicações biomédicas e de síntese
- Nanopartículas de albumina carregadas de resveratrol com circulação sanguínea prolongada e biocompatibilidade aprimorada para terapia de tumor pancreático direcionada altamente eficaz
- Novel Biocompatible Au Nanostars @ PEG Nanopartículas para imagens In Vivo CT e propriedades de depuração renal
- Síntese e desempenho in vitro de nanopartículas de ferro-platina revestidas com polipirrole para terapia fototérmica e imagem fotoacústica
- Nanomontagens de ácido 5-aminolevulínico-esqualeno para fotodetecção e terapia de tumor:estudos in vitro
- Influência de Mg Doping em Nanopartículas de ZnO para Avaliação Fotocatalítica Aprimorada e Análise Antibacteriana
- Compreendendo os benefícios e desafios da fabricação híbrida



