Síntese e desempenho in vitro de nanopartículas de ferro-platina revestidas com polipirrole para terapia fototérmica e imagem fotoacústica
Resumo
A nanoplataforma multifuncional para a combinação de terapia baseada em fotos e imagem fotoacústica (PAI) para o tratamento do câncer recentemente atraiu muita atenção para o desenvolvimento da nanotecnologia. Neste estudo, desenvolvemos nanopartículas de ferro-platina (FePt NPs) com revestimento de polipirrol (PPy) como novos agentes para terapia fototérmica combinada (PTT) e PAI. Os NPs FePt revestidos com PPy obtidos (FePt @ PPy NPs) mostraram excelente biocompatibilidade, estabilidade fototérmica e alta absorbância no infravermelho próximo (NIR) para a combinação de PTT e PAI. A investigação in vitro demonstrou experimentalmente a eficácia dos NPs FePt @ PPy em matar células cancerosas com irradiação a laser NIR. Além disso, o teste fantasma do PAI usado em conjunto com os NPs FePt @ PPy mostrou um forte sinal fotoacústico. Assim, os novos NPs FePt @ PPy podem ser considerados nanopartículas multifuncionais promissoras para futuras aplicações de diagnóstico e tratamento baseado em fotos.
Histórico
Na última década, muitas novas estratégias terapêuticas foram introduzidas para a terapia do câncer. Nesses casos, a terapia fototérmica (PTT) ganhou atenção considerável por causa de suas vantagens, incluindo alta especificidade, seletividade espaço-temporal precisa e efeitos colaterais limitados [1, 2]. O PTT utiliza fotoabsorventes da região do infravermelho próximo (NIR) para gerar calor para a ablação térmica de células cancerosas após irradiação com laser NIR [2]. Aproveitando a vantagem de usar a irradiação a laser com o mesmo comprimento de onda, os fotoabsorventes NIR podem ser usados para terapia fototérmica guiada por imagem fotoacústica (PAI) [3, 4].
Recentemente, nanopartículas de ferro-platina (FePt NPs) surgiram como agentes eficazes para imagens de modalidade dupla de TC / RM [5]. Os NPs FePt exibem uma eficiência fototérmica mais alta do que as nanopartículas de ouro na região NIR [6]. Um sinal fotoacústico mais forte gerado pelo uso de NPs FePt, em comparação com nanopartículas de ouro, também foi demonstrado recentemente [7]. A modificação de superfície com polímero é uma técnica bem conhecida para aumentar a biocompatibilidade e o desempenho das nanopartículas para o tratamento do câncer. Apesar de suas propriedades promissoras, tem havido alguns esforços de pesquisa sobre a modificação da superfície de NPs de FePt para a aplicação biomédica [8, 9].
A alta eficiência da transformação luz-calor dos agentes em nanoescala é o fator mais importante para o PTT [10]. Assim, o material selecionado para a modificação da superfície de FePt NPs não deve ter nenhum efeito negativo na transformação de luz em calor do núcleo FePt NP. O polipirrol (PPy), que tem uma forte excitação na região NIR, recebeu considerável importância em aplicações biomédicas devido às suas características inerentes superiores, incluindo estabilidade fototérmica, baixo custo e biocompatibilidade [11, 12]. Estudos recentes relataram o PPy como um agente de alto desempenho para o tratamento do câncer PTT [11, 13] e PAI de tecido profundo [12]. No presente trabalho, desenvolvemos FePt NPs revestidos com PPy (FePt @ PPy NPs) como novos agentes para a combinação de PTT e PAI. Nossa expectativa ao usar o polímero PPy para revestir NPs de FePt é avançar o efeito fototérmico e a biocompatibilidade dos NPs de FePt.
As nanopartículas resultantes mostraram excelente biocompatibilidade, estabilidade fototérmica e forte efeito fototérmico. O estudo de ensaio MTT revelou que os NPs FePt @ PPy exibiram uma terapia eficaz contra o câncer. Além disso, o teste fantasma do PAI em conjunto com os NPs FePt @ PPy mostrou um forte sinal fotoacústico (PA) que é muito promissor para outras aplicações do PAI.
Métodos
Material
Acetilacetonato de platina (Pt (acac) 2 , 97%) foi comprado da Acros Organics e usado conforme recebido. Ferro pentacarbonil (Fe (CO) 5 , 99%), hexadecano-1,2-diol (90%), oleil amina (80-90%), ácido oleico (70%), dioctiléter (90%), 1-octadeceno (90%), 3- mercaptopropiônico (3-MPA, 97%), pirrol (Py, grau de reagente, 98%), álcool polivinílico (PVA, Mw:9000-10.000), persulfato de amônio ((NH 4 ) 2 S 2 O 8 , 98%), dodecil sulfato de sódio (SDS), ferrocianeto de potássio, ácido clorídrico e brometo de 3- (4,5-dimetiltiazol-2-il) -2,5-difeniltetrazólio (MTT) foram adquiridos da Sigma-Aldrich e usados conforme recebido durante os experimentos. Reagentes de coloração celular incluindo azul de tripano, iodeto de propídio (PI) e Hoechst 33342 também foram adquiridos na Sigma-Aldrich. Meio Eagle modificado por Dulbecco (DMEM), soro fetal bovino (FBS), penicilina, estreptomicina, 1 × tripsina e solução salina tamponada com fosfato (PBS) foram adquiridos da HyClone (South Logan, UT, EUA). Água destilada (DI) foi usada para todos os experimentos.
Síntese de NPs FePt @ PPy
A síntese de NPs FePt @ PPy foi realizada através de três etapas que foram descritas no Esquema 1.
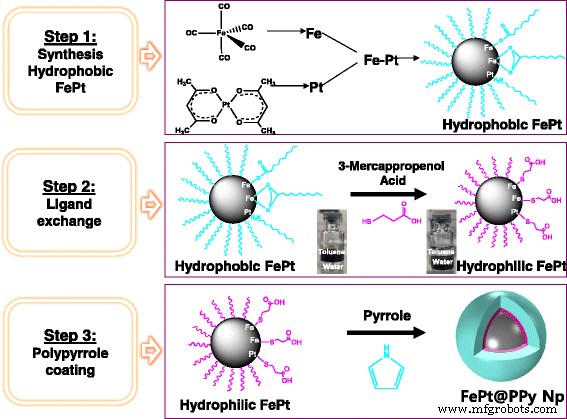
Representação esquemática da síntese de FePt @ PPy NPs
Etapa 1 - Síntese de NPs FePt hidrofóbicos
A síntese de NPs FePt hidrofóbicos foi feita de acordo com o esquema relatado [5]. Em suma, 97 mg Pt (acac) 2 , 4 mL de éter dioctil, 66 μL Fe (CO) 5 , 195 mg 1,2-hexadecandiol, 100 μL oleil amina e 100 μL de ácido oleico foram carregados em um frasco de fundo redondo de três gargalos de 50 mL. A mistura de reação foi aquecida a 240 ° C com uma taxa de aquecimento de 15 ° C / min sob gás argônio. Após 30 min, o produto foi resfriado à temperatura ambiente. Os FePt NPs foram coletados por centrifugação (15.000 rpm, 30 min) e lavados várias vezes com hexano. A solução final de nanopartículas foi armazenada em hexano.
Etapa 2 - Troca de ligandos
Os ligantes na superfície de FePt NPs hidrofóbicos foram trocados com ácido 3-mercaptopropiônico (3-MPA), conforme relatado em artigos [14]. Além disso, 1 mL de 3-MPA e 1 mL de ciclohexanona foram carregados em um tubo de centrífuga e, em seguida, 0,5 mL de FePt NPs hidrofóbicos dispersos em hexano (~ 10 mg) foram adicionados à solução acima e agitados usando um vórtice. Após 30 min, os NPs FePt começaram a precipitar e todas as nanopartículas precipitaram após 1 h. Os FePt NPs hidrofílicos foram coletados por centrifugação (3500 rpm, 5 min). O produto foi lavado com ciclohexanona, etanol e acetona, respectivamente. Finalmente, os NPs FePt hidrofílicos diluídos em DI com a adição de NaOH.
Etapa 3 - Revestimento de NPs FePt hidrofílicos com PPy
Cinco miligramas de FePt NPs hidrofílicos foram dissolvidos em 200 mL de barker contendo 60 mL de DI e foram sonicados continuamente por 10 min. Em seguida, 6 mL de SDS 40 mM foram adicionados à solução acima. Em seguida, 1 g de PVA que foi completamente dissolvido em água quente foi adicionado à solução acima. A mistura resultante foi então agitada a 500 rpm. A seguir, 10 mL de 6-mM (NH 4 ) 2 S 2 O 8 foi adicionado à solução agitada. Após 1 h de equilíbrio, 6 mL de Py 100 mM foram adicionados à solução acima. Após vários minutos, a solução gradualmente tornou-se preta. Após 2 h de polimerização, as nanopartículas resultantes foram separadas por centrifugação (12.000 rpm, 30 min) e foram lavadas várias vezes com água quente para remover as impurezas. Os NPs FePt @ PPy obtidos foram ressuspensos com PBS por ultra-som por 3 min.
Caracterização
A morfologia das nanopartículas foi observada usando microscopia eletrônica de transmissão de emissão de campo (FETEM; JEM-2100F, JEOL, Japão). A composição atômica foi analisada por espectroscopia de dispersão de energia (EDS). Os grupos funcionais químicos das nanopartículas foram analisados usando um espectroscopia de infravermelho com transformada de Fourier (FTIR) (espectrofotômetro Perkin Elmer 1320 FTIR). O diâmetro das nanopartículas foi determinado pelo método de espalhamento dinâmico de luz usando espectrofotômetro de espalhamento de luz eletroforético (ELS-8000, OTSUKA Electronics Co. Ltd., Japão). Os espectros de UV-Vis-NIR foram medidos usando espectroscopia de UV-Vis-NIR (espectrofotômetro Thermo Biomate 5). A irradiação a laser foi realizada usando um laser de 808 nm com potência ajustável (onda contínua, potência máxima =5 W, Hi-TechOptoelectronics Co., Pequim, China).
Teste fototérmico
Para medir o desempenho fototérmico de NPs preparados, uma suspensão (1 mL) contendo os NPs FePt @ PPy com concentrações específicas (20, 30, 50, 70, 100 e 120 μg / mL) foi adicionada a um 12 poços placa. Em seguida, cada poço foi exposto por um laser de 808 nm a uma densidade de potência de 1 W / cm 2 por 5 min. Além disso, o aumento da temperatura de FePt @ PPy NPs irradiados em diferentes densidades de potência do laser de 808 nm também foi registrado. Resumidamente, a solução FePt @ PPy NP de 50 μg / mL foi irradiada pelo laser NIR na densidade de potência desejada de 0,5, 1 e 1,5 W / cm 2 por 6 min. A temperatura foi registrada por um termômetro (MASTECH, CA, EUA) via fibra térmica.
Teste de fotoestabilidade
Os NPs FePt @ PPy de 50 μg / mL foram expostos ao laser de 808 nm a uma densidade de potência de 1 W / cm 2 até que a temperatura mais alta fosse atingida, e então, foi permitido retornar à temperatura ambiente desligando o laser. Os ciclos de aquecimento e resfriamento foram repetidos seis vezes. O espectro de UV-Vis da amostra irradiada foi registrado para comparar com a amostra irradiada.
Teste de armazenamento de longo prazo
A suspensão aquosa de FePt @ PPy NPs na concentração de 120 μg / ml foi armazenada a 4 ° C por 30 dias para avaliar sua estabilidade em armazenamento de longo prazo. Para a comparação, os espectros de absorção de UV-Vis e o tamanho das partículas de NPs FePt @ PPy foram observados para o primeiro dia e o último dia. Além disso, FePt @ PPy NPs em diferentes meios, incluindo DI, meio DMEM mais FBS e PBS foram armazenados a 4 ° C por 30 dias para avaliar a estabilidade dos FePt @ PPy NPs preparados.
Ensaio de citotoxicidade de NPs FePt-PPy
Um ensaio MTT padrão [15] foi usado para quantificar a citotoxicidade celular. As células de câncer de mama MDA-MB-231 foram usadas como células de câncer modelo para testar a biocompatibilidade de NPs FePt @ PPy. As células cancerosas tratadas com FePt NP foram usadas como controle. A linha celular MDA-MB-231 foi cultivada em meio DMEM suplementado com 10% de FBS e 1% de antibióticos em uma atmosfera umidificada a 37 ° C e 5% de CO 2 . As células MDA-MB-231 foram semeadas em microplacas de 96 poços a uma densidade de 1 × 10 4 células / poço. Após 24 h, os meios DMEM contendo FePt @ PPy NPs (ou FePt NPs) com diferentes concentrações (0, 20, 30, 50, 70, 100 e 120 μg / mL) foram adicionados às placas de células, e as células tratadas foram em seguida, incubado por 48 h. Observe que a quantidade de FePt é a mesma para as duas nanopartículas testadas, incluindo FePt NPs e FePt-PPy NPs. Em seguida, 100 μL de MTT dissolvido em PBS a 0,5 mg / mL foi adicionado a cada poço e as placas de células foram incubadas por mais 4 h. A enzima desidrogenase, que está presente na mitocôndria das células vivas, converteu o MTT solúvel em formazano roxo insolúvel. Em seguida, 100 μL de DMSO foram adicionados para dissolver o formazan roxo insolúvel. Posteriormente, a absorção do formazan roxo foi registrada a 570 nm usando um espectrofotômetro de leitura de placa para quantificar a porcentagem de viabilidade celular.
Captação celular
A coloração com azul da Prússia foi usada para verificar a absorção celular de NPs FePt @ PPy na célula MDA-MB-231 [16]. As células foram semeadas a uma densidade de 1 × 10 5 células / mL em placas de 12 poços e incubadas por 24 h. Em seguida, 200 μg / mL FePt @ PPy NPs foram adicionados às placas de células e incubados por mais 24 h. Em seguida, as células foram fixadas com formol frio por 15 min. E então, ferrocianeto de potássio a 10% e solução aquosa de ácido clorídrico a 20% (50:50 v / v ) foram adicionados às placas de células e incubados por 1 h. O resultado foi observado em microscopia ótica.
Terapia fototérmica in vitro
O ensaio MTT foi realizado para quantificar a eficácia de FePt @ PPy NPs na capacidade de matar de células de câncer de mama MDA-MB-231. Resumidamente, as células MDA-MB-231 foram cultivadas em uma microplaca de 96 poços a uma densidade de 1 × 10 4 células / poço. No dia seguinte, as soluções de FePt @ PPy NP com concentração específica (0, 10, 20, 30, 50, 70 e 100 μg / mL) foram adicionadas às placas de células e as células tratadas foram incubadas por mais 24 horas . Em seguida, o PBS foi usado para lavar as nanopartículas não ligadas. Posteriormente, as microplacas foram expostas ao laser NIR a uma densidade de potência de 1 W / cm 2 por 4 e 6 min, respectivamente. Para obter os resultados, as etapas a seguir foram conduzidas de acordo com o ensaio de citotoxicidade celular na seção “Ensaio de Citotoxicidade de NPs FePt-PPy”.
A coloração dupla de Hoechst 33342 e PI também foi usada para detectar as células danificadas e mortas como resultado do tratamento fototérmico usando NPs FePt @ PPy. Concretamente, as células MDA-MB-231 foram semeadas em uma placa de 12 poços a uma densidade de 1 × 10 5 células / poço. Após 24 h, as células foram tratadas com os NPs FePt @ PPy (0, 50, 70 e 100 μg / mL) e incubadas continuamente por mais 24 h a 37 ° C. Em seguida, as nanopartículas não ligadas foram removidas lavando suavemente com PBS. Posteriormente, as placas de células foram expostas ao laser NIR a uma densidade de potência de 1 W / cm 2 por 6 min. Em seguida, as placas de cultura de células foram mantidas por 24 horas na incubadora e, em seguida, as células irradiadas foram coradas com Hoechst 33342 e PI. Observe que 1,5 mL Hoechst 33342 (10 μg / mL) foi adicionado na placa de cultura de células e, em seguida, mantido na incubadora por 20 min. Em seguida, as células foram lavadas com PBS três vezes para remover o excesso de mancha. Em seguida, as células foram continuamente coradas com 1,5 mL de PI (10 μg / mL) e incubadas em temperatura ambiente por 5 min. Finalmente, as células foram novamente lavadas com PBS, e as imagens fluorescentes foram capturadas por um microscópio de fluorescência (Leica Microsystems GmbH, Wetzlar, Germany).
Experimento com Animais
Para realizar um teste in vivo das propriedades fototérmicas de FePt @ PPy NPs, uma fêmea de camundongo BALB / c com 6 semanas de idade foi injetada por via subcutânea com 100 μL de 100 μg / mL FePt @ PPy NPs em PBS. Outro camundongo sem injeção foi usado como controle. Posteriormente, a área injetada dos camundongos foi irradiada com um laser de 808 nm a 1 W / cm 2 por 6 min. Os procedimentos experimentais com animais foram aprovados pelo comitê de cuidado e uso de animais da Universidade Nacional de Pukyong e realizados de acordo com os princípios orientadores para o cuidado e uso de animais de laboratório.
Imagem fotoacústica in vitro
Configuração de PAI
O PAI no fantoma foi realizado para avaliar o sinal de PA dos NPs FePt @ PPy. Nosso grupo desenvolveu o sistema PAI não invasivo, conforme relatado no estudo anterior [17]. O diagrama esquemático da configuração do PAI é mostrado na Fig. 11. Um sistema óptico embutido com um laser Nd-YAD Q-switch pulsado (Surelite III, CA, EUA) foi empregado. O laser foi ajustado para comprimento de onda de 808 nm e freqüência de 10 Hz com operação de pulso de 5 ns. A fibra óptica de entrada com comprimento focal de 50 mm (Thorlabs, Newton, NJ, EUA) foi conectada a uma lente plano-convexa. A fibra óptica de saída foi ligada a um transdutor focado (Olympus NDT, EUA) e ajustada ao centro da zona iluminada. Para registrar os sinais de PA, os dados foram digitalizados e armazenados por meio de um sistema DAQ (aquisição de dados) integrado ao sistema a laser. Posteriormente, os dados registrados foram usados para reconstruir imagens 2D do fantoma por um programa LabVIEW.
Preparação da amostra
O fantoma de PVA foi preparado com PVA a 8% para simular o tecido. As células cancerosas MBA-MD-231 pré-semeadas foram tratadas com diferentes concentrações de FePt @ PPy NPs (50, 100 e 200 μg / mL) por 24 h e, em seguida, as células foram colhidas e misturadas com 4% de gelatina no simulador (Fig. 12a). Em seguida, o fantoma foi coberto por uma pequena camada de 4% de gelatina e permitiu a solidificação. Por fim, o fantoma foi fixado na caixa d'água para o processamento do PAI.
Resultados e discussão
Síntese e caracterização de NPs FePt @ PPy
O processo de síntese de FePt NPs é ilustrado no Esquema 1. A análise EDS dessas nanopartículas revelou que a composição atômica final de Fe e Pt são 20 e 80%, respectivamente (Arquivo adicional 1:Figura S1). NPs FePt hidrofóbicos foram modificados com 3-MPA; assim, eles se tornam NPs FePt hidrofílicos com um tamanho médio de 8,3 nm. Os NPs FePt hidrofóbicos se dispersam em hexano devido à presença de ácido oleico e oleilamina na superfície. No entanto, as partículas tornam-se solúveis em água após a troca de ligante. Os espectros de FTIR de FePt NPs hidrofóbicos e FePt NPs hidrofílicos revelaram as bandas características de ligantes de absorção de ácido oleico, oleil amina e 3-MPA na superfície (Fig. 3; Esquema 2) [14, 18]. Os dados de FTIR (Fig. 2) juntamente com a boa solubilidade de FePt NPs hidrofílicos em água (Esquema 1, etapa 2) confirmaram o processo de troca de ligante bem-sucedido.
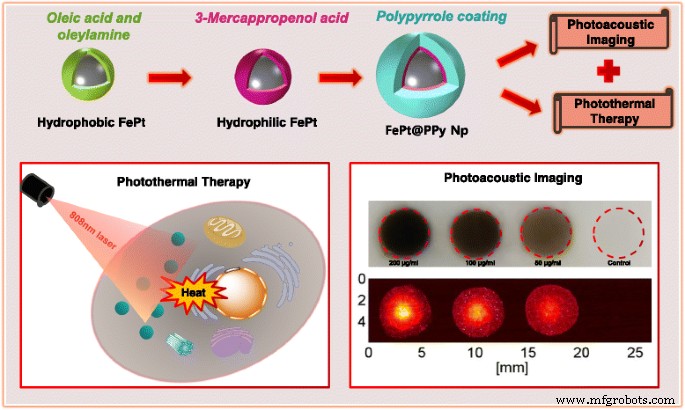
Representação esquemática da síntese e aplicação de FePt @ PPy NPs em terapia fototérmica e imagem fotoacústica
Os FePt NPs foram revestidos com PPy por meio de polimerização por oxidação química usando (NH 4 ) S 2 O 8 como o agente oxidante e PVA como o estabilizador. A camada PPy foi claramente observada por imagem TEM (Fig. 1c) com a espessura de cerca de 10 nm, e o tamanho médio de NPs FePt @ PPy é de 42 nm (Fig. 1d). O FTIR de FePt @ PPy NPs também foi implementado para confirmar o revestimento de PPy NPs examinando as mudanças de frequência de FTIR (Fig. 3c). Os picos característicos de PPy foram bem analisados no relatório anterior [19]. As bandas de vibração FTIR em 1620 e 1446 cm −1 foram atribuídos às vibrações de alongamento C – C e C =C de um anel PPy. A banda em 1236 cm −1 foi atribuído à vibração de alongamento C – N e a banda a 1076 cm −1 indicou a presença de um modo de deformação no plano C – N. Além disso, as bandas em 798 e 600 cm −1 foram atribuídos a vibração de deformação no plano C – H e N – H e vibrações de flexão externa C – H, respectivamente. O FTIR junto com o TEM garante o revestimento bem-sucedido de NPs FePt externos em PPy.
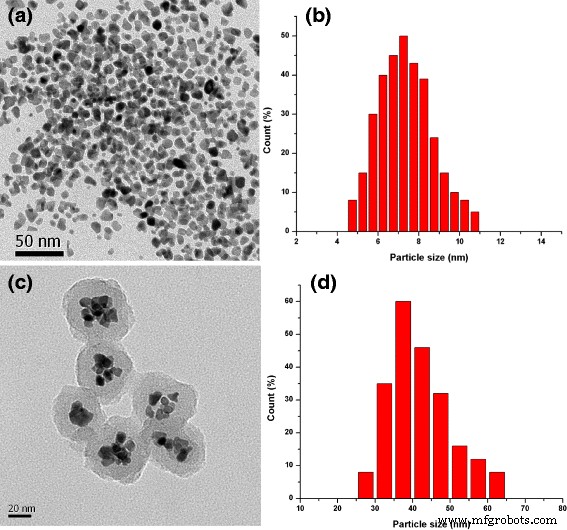
a TEM e b distribuições de tamanho correspondentes de NPs FePt puros. c TEM e d distribuições de tamanho correspondentes de NPs FePt @ PPy
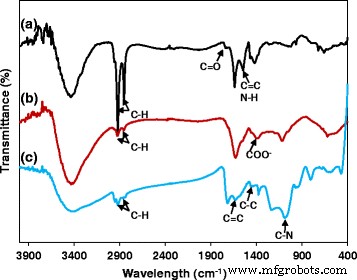
Espectros de FTIR de (a) NPs FePt hidrofóbicos, (b) NPs FePt hidrofílicos e (c) NPs FePt @ PPy
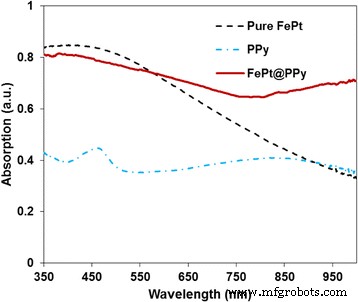
Os espectros de UV-Vis-NIR de NPs FePt, PPy e FePt @ PPy puros
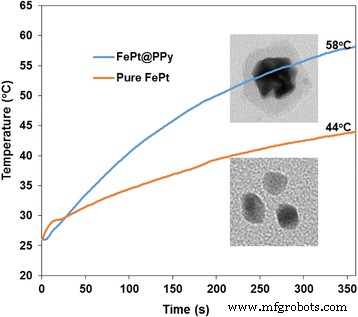
Curva de aquecimento fototérmico de NPs FePt puros e NPs FePt @ PPy com a mesma quantidade de FePt. Todas as soluções foram irradiadas com 1-W / cm 2 Laser de 808 nm por 6 min
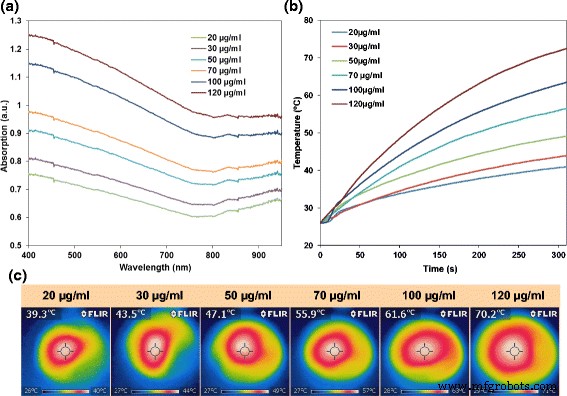
a Espectros UV-Vis-NIR de diferentes concentrações de NPs FePt @ PPy. b O decaimento fototérmico de NPs FePt @ PPy com diferentes concentrações. c As imagens termográficas NIR correspondentes de amostras irradiadas. Todas as soluções foram irradiadas com 1-W / cm 2 Laser de 808 nm por 5 min
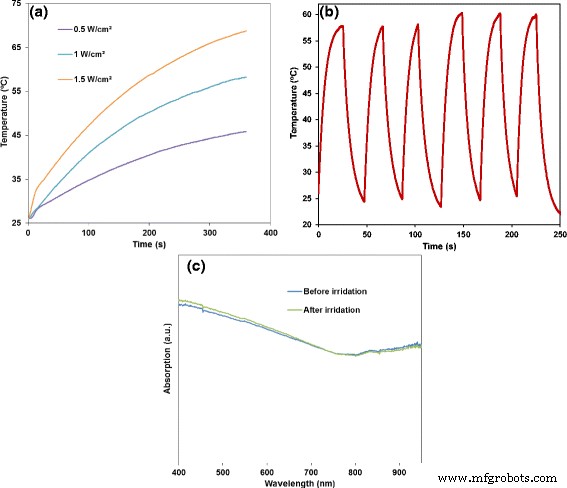
a Comportamento fototérmico de 50 μg / mL de NPs FePt @ PPy mantidos sob um laser de 808 nm em diferentes densidades de potência por 6 min. b O registro de temperatura em tempo real de seis ciclos de aquecimento / resfriamento de 50 μg / mL de NPs FePt @ PPy sob um experimento de laser liga / desliga (1 W / cm 2 ) c Espectros UV-Vis-NIR de NPs FePt @ PPy antes e depois da irradiação
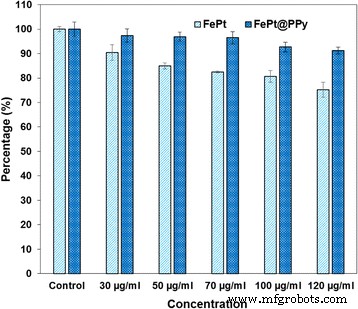
Viabilidade celular (com ensaio de MTT) de células MDA-MB-231 incubadas com NPs FePt e FePt @ PPy com diferentes concentrações por 48 h
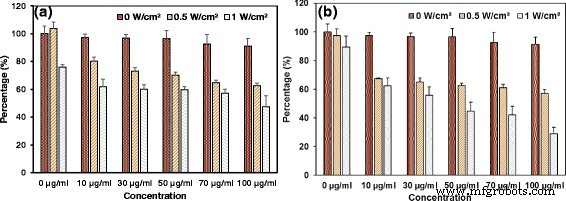
Porcentagem de células vivas das células tratadas com NPs FePt @ PPy sob diferentes densidades de potência do laser e diferentes tempos de irradiação. a A irradiação foi realizada por 4 min. b A irradiação foi realizada por 6 min
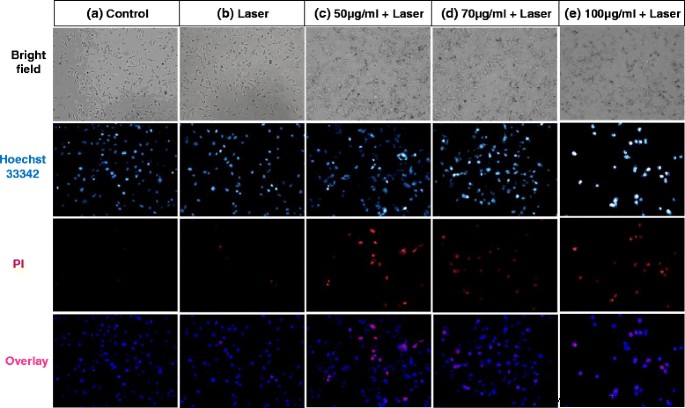
Imagens de campo claro e fluorescência de células MDA-MB-231 em diferentes condições. a Ao controle. b Apenas laser. c 50-μg / mL FePt @ PPy NPs + laser. d 70-μg / mL FePt @ PPy NPs + laser. e 100-μg / mL FePt @ PPy NPs + laser. Todas as soluções foram irradiadas com 1 W / cm 2 Laser de 808 nm por 6 min
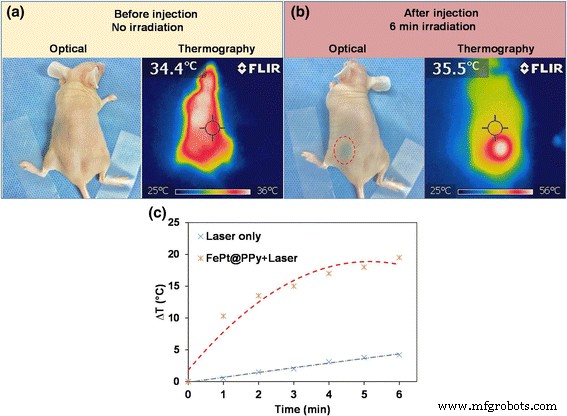
a A imagem óptica e as imagens termográficas NIR correspondentes do mouse nu antes da injeção de NPs FePt @ PPy. b O lado esquerdo:a imagem ótica do mouse nu com injeção subcutânea. O círculo vermelho tracejada indica o local da injeção. O lado direito:a imagem termográfica NIR do camundongo nu após 6 min sob irradiação com um laser de 808 nm (1 W / cm 2 ) Observe que o aquecimento máximo corresponde ao local da injeção. c Mudança de temperatura da superfície da pele no local da injeção e nos camundongos com irradiação no laser de 808 nm (1 W / cm 2 ) por 6 min
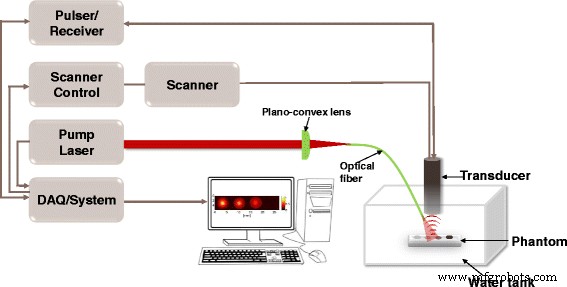
Configuração experimental do sistema PAI
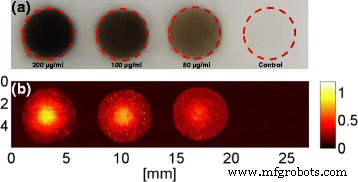
Avaliações nas respostas de PA de NPs FePt @ PPy em várias concentrações: a fantasma e b imagens PA correspondentes
Os espectros de absorção UV-Vis-NIR de NPs FePt, PPy e FePt @ PPy puros são dados na Fig. 3. A forte absorção na região NIR foi observada para as nanopartículas compostas. Os espectros de absorção de FePt e PPy podem, juntos, contribuir para os de FePt @ PPy NPs. As propriedades ópticas das dispersões aquosas FePt @ PPy NP com diferentes concentrações (de 20 a 120 μg / mL) também foram registradas por espectroscopia UV-Vis-NIR. Conforme representado na Fig. 4a, com um aumento da concentração de FePt @ PPy NP, a intensidade de fotoabsorção de toda a região UV-Vis-NIR aumentou.
Desempenho fototérmico de FePt @ PPy NPs
Os comportamentos fototérmicos de NPs FePt e FePt @ PPy puros foram comparados na Fig. 4. NPs FePt e FePt @ PPy puros com a quantidade de FePt fixa foram irradiados por um laser de 808 nm a uma densidade de potência de 1 W / cm 2 . Os NPs FePt @ PPy mostraram excelente comportamento fototérmico em comparação com os NPs FePt puros. Esses dados indicaram que a camada de PPy aumentou a eficácia fototérmica de todo o sistema.
Conforme mostrado nas Figs. 5a, sob a mesma condição de laser NIR (5 min, 1 W / cm 2 ), a temperatura da solução contendo 20 μg / ml FePt @ PPy NPs aumentou de 25 para 39,3 ° C, enquanto aquela contendo 120 μg / ml FePt @ PPy NPs atingiu rapidamente 71 ° C. Além disso, as imagens termográficas (Fig. 5c) indicaram a conversão fototérmica efetiva da amostra contendo NPs FePt @ PPy irradiados com um laser de 808 nm. NPs FePt @ PPy (50 μg / mL) foram expostos à irradiação de laser NIR em diferentes densidades de potência do laser de 0,5, 1,0 e 1,5 W / cm 2 por 6 min, e as temperaturas resultantes foram 41,1, 51,3 e 59,4 ° C, respectivamente. Esses resultados experimentais revelaram que o tempo de exposição, a concentração de nanopartículas e a intensidade da potência do laser são parâmetros importantes que influenciam significativamente o desempenho fototérmico de NPs FePt @ PPy.
Testes de estabilidade fototérmica de FePt @ PPy NPs
Além da forte transdução fototérmica, a fotoestabilidade das nanopartículas é importante no PTT. A solução FePt @ PPy NP de 50 μg / mL foi irradiada com o laser NIR de 808 nm a 1,0 W / cm 2 até a solução atingir a temperatura mais alta, então resfriando naturalmente até a temperatura ambiente desligando o laser. Após seis ciclos de aquecimento e resfriamento, a curva térmica de FePt @ PPy NPs permaneceu quase a mesma para cada ciclo (Fig. 4d). Os espectros de UV-Vis-NIR antes e depois da exposição ao laser são mostrados na Fig. 6c. Nenhuma mudança significativa foi observada para todo o espectro. Os resultados acima indicaram boa estabilidade fototérmica de NPs FePt @ PPy por um longo período de irradiação com laser NIR.
Teste de armazenamento de longo prazo
O tamanho de partícula e o espectro de absorção de UV-Vis-NIR das nanopartículas preparadas foram monitorados durante os 30 dias de armazenamento. Em primeiro lugar, nenhuma agregação foi observada em todas as soluções contendo NPs FePt @ PPy (Arquivo adicional 1:Figura S3a). Em segundo lugar, os NPs FePt @ PPy em meios de cultura de células na concentração de 120 μg / mL não mostraram qualquer mudança significativa em seus espectros de UV-Vis-NIR (arquivo adicional 1:Figura S3b) após os 30 dias de armazenamento. Além disso, o tamanho médio de partícula de FePt @ PPy NPs quase permaneceu inalterado durante o armazenamento de longo prazo (Arquivo adicional 1:Figura S3c). Todos os resultados acima comprovaram evidentemente a estabilidade das nanopartículas preparadas.
Ensaio de citotoxicidade celular in vitro
Para o tratamento do câncer, as nanopartículas devem ter excelente biocompatibilidade. Como mostrado na Fig. 7, as células de câncer de mama MDA-MB-231 foram tratadas com NPs FePt e FePt @ PPy puros com diferentes concentrações e incubadas por 48 h. Nenhuma citotoxicidade significativa dos NPs FePt @ PPy foi observada, mesmo na concentração testada mais alta (120 μg / mL), e a viabilidade celular das células de câncer de mama MDA-MB-231 ainda era superior a 95%. Para os NPs FePt puros, as nanopartículas irradiadas com 120 μg / mL mataram 20% das células cancerosas. Esse resultado indicou que o revestimento da camada de PPy melhorou a biocompatibilidade de FePt NPs, e FePt @ PPy NPs pode ser considerado um material não tóxico.
Captação celular
A coloração com azul da Prússia, que se baseia na reação de ferrocianeto de ferro e potássio em solução ácida, foi realizada para detectar a captação celular de NPs FePt @ PPy. Conforme mostrado no arquivo adicional 1:Figura S2, a maioria das células foram coradas com manchas azuis dentro das células, indicando a absorção celular de NPs FePt @ PPy.
Terapia fototérmica in vitro
O ensaio MTT padrão foi realizado para avaliar a eficácia de FePt @ PPy NPs irradiados na capacidade de matar de células de câncer de mama MDA-MB-231. Primeiro, as células cancerosas foram incubadas com diferentes concentrações de FePt @ PPy NPs por 24 horas e, em seguida, expostas ao laser de 808 nm a 1 W / cm 2 por 4 min. Conforme mostrado na Fig. 8, a porcentagem de viabilidade celular foi gradualmente diminuída quando a concentração das nanopartículas tratadas foi aumentada. Aproximadamente 50% das células morreram em uma concentração de 100 μg / mL de NPs FePt @ PPy irradiados. Para matar mais células cancerosas, o tempo de irradiação foi aumentado para 6 min. Com concentração de 100 μg / mL, foram observadas aproximadamente 70% das células mortas. Uma comparação do desempenho da terapia fototérmica entre o sistema proposto e algumas nanopartículas relatadas foi realizada no arquivo adicional 1:Tabela S1. It is found that the proposed system shows comparable capability in killing cancer cells (i.e., 70% cell death) with quite low nanoparticle concentration (i.e., 100 μg/mL) under relatively weak power density condition (i.e., 1 W/cm 2 ) and short irradiation time (i.e., 6 min).
In addition, by using the fluorescence imaging technique of five groups, we conducted experiments on the cancer cells to consider the killing capability of the prepared nanoparticles:the control groups (only cells), the laser-only group (cells were exposed to the 808-nm laser), the 50-μg/mL FePt@PPy NPs + 808-nm laser (cells were treated with 50-μg/mL of FePt@PPy NPs and exposed to the 808-nm laser), the 70-μg/mL FePt@PPy NPs + 808-nm laser (cells were treated with 50-μg/mL of FePt@PPy NPs and exposed to the 808-nm laser), and the 100-μg/mL FePt@PPy NPs + 808-nm laser (cells were treated with 50-μg/mL of FePt@PPy NPs and exposed to the 808-nm laser).
Double staining of Hoechst 33342 and PI was used to explore the damaged and dead cells. Hoechst 33342 is a DNA dye, which can be permeable in both dead and viable cells [20]. The changes in the size and shape of nuclei of the Hoechst 33342 stained cells can be observed under fluorescence microscopy. With the apoptosis cells, Hoechst 33342 will make the condensed chromatin brighter than that in a normal cell. PI dye also binds to DNA, but it only permeates through the membrane of damaged and dead cells [21]. Thus, double staining can differentiate between dead cells and live cells by each treatment method.
As shown in Fig. 9, the cancer cells exposed to the NIR laser in the presence of the FePt@PPy NPs emit strong fluorescence, whereas the slight fluorescence is emitted by cancer cells in the absence of the nanoparticles. Only a few dead cells with the red nuclei were observed in the control and laser-only group (Fig. 9a, b). In contrast, many cells in the FePt@PPy NPs + 808-nm laser groups died and displayed red nuclei, as observed in Fig. 9c–e. After incubation for 24 h, some dead cells lost the binding ability and were washed out of the cell disk. Therefore, the intensity of cancer cells in the 100-μg/mL of FePt@PPy NPs + 808-nm laser group was less than the others. Conclusively, almost cancer cells which were treated with 100-μg/mL of FePt@PPy NPs was destructed after being exposed to the 808-nm NIR laser at a power density of 1.0 W/cm 2 .
In Vivo Laser Heating Experiment
The potential ability of FePt@PPy NPs for laser-induced heating was finally tested in an animal model. The nude mouse was subcutaneously injected with 100 μL of an aqueous FePt@PPy (100 μg/mL) NPs in PBS. Figure 10a presents the optical and NIR thermographic images of the nude mouse before injection, pointing out the temperature of mouse surface’s skin is about 36 °C. Fig. 10b (left side) shows an optical image of the mouse in which the injection site is indicated by a dashed red circle. The injected area was irradiated with the 808-nm laser at 1 W/cm 2 for 6 min, and the NIR thermographic image of this mouse is shown in Fig. 10b (right side). The temperature of the skin’s surface was continuously monitored with an NIR thermographic camera. The time evolution of the surface temperature during the 6 min irradiation is shown in Fig. 10c, figuring out a temperature increment of the skin about 19 °C. From that, we can see clearly that the injected FePt@PPy NP area with laser irradiation produced a high temperature, as required for tumor ablation. Moreover, the heating area was found to be well localized at the injection site as shown in the NIR thermographic image (Fig. 10b, right side). Conclusively, with the excellent laser-induced heating properties, FePt@PPy could be a novel promising agent for photothermal therapy.
In Vitro Photoacoustic Imaging
The top-view image of the phantom filled with pretreated cancer cells is shown in Fig. 12a. The corresponding PAI acquired at the 808-nm laser from the sample in Fig. 12a is illustrated in Fig. 12b.
PAI is an emerging imaging modality and can be used to assist phototherapy [22]. All the samples containing pretreated cells were clearly visible, whereas the controlled samples with 4% gelatin did not produce any PA signal. The magnitude of the PA signal was increased when the concentration of nanoparticles increased. The ability to image FePt@PPy NPs inside phantom with the PAI system is very promising for image-guided photo-induced cancer therapy. The laser system for PAI, which was used in conjunction with FePt@PPy NPs, also showed the potential for future implementations.
Conclusions
In this study, we developed the photoabsorber FePt@PPy NPs and evaluated their efficiency on in vitro PTT and PAI (Scheme 2). The prepared FePt@PPy NPs showed many good properties for PTT and PAI including excellent biocompatibility, photothermal stability, and high NIR absorbance. Moreover, in vitro investigation confirmed the effectiveness of the FePt@PPy NPs in killing the cancer cells under the NIR laser. So far, the phantom test of PAI used in conjunction with FePt@PPy NPs showed a strong PA signal. Owing to their good properties, the novel FePt@PPy NPs could be considered as promising multifunctional nanoparticles for further applications in PTT and PAI.
Nanomateriais
- Nanopartículas para terapia do câncer:progresso e desafios atuais
- Nanorods de ouro revestidos com BSA para terapia fototérmica NIR-II
- Nanopartículas de albumina carregadas de resveratrol com circulação sanguínea prolongada e biocompatibilidade aprimorada para terapia de tumor pancreático direcionada altamente eficaz
- Síntese hidrotérmica de nanopartículas de In2O3 híbridos gêmeos heteroestruturas de ZnO de disco hexagonal para atividades fotocatalíticas aprimoradas e estabilidade
- Novel Biocompatible Au Nanostars @ PEG Nanopartículas para imagens In Vivo CT e propriedades de depuração renal
- Poliglicerol hiper-ramificado modificado como dispersante para controle de tamanho e estabilização de nanopartículas de ouro em hidrocarbonetos
- Nanomontagens de ácido 5-aminolevulínico-esqualeno para fotodetecção e terapia de tumor:estudos in vitro
- Platycodon saponins from Platycodi Radix (Platycodon grandiflorum) para a síntese verde de nanopartículas de ouro e prata
- Nanobastões de ouro modificados com sílica conjugada com anticorpo para o diagnóstico e terapia fototérmica de Cryptococcus neoformans:um experimento in vitro
- Preparação de Silicalita Hierárquica Porosa-1 Encapsulada NPs e seu desempenho catalítico para redução de 4-nitrofenol



