Óxido de grafeno em um composto com nanopartículas de prata reduz a citotoxicidade de fibroblastos e células endoteliais de uma nanoplataforma antibacteriana
Resumo
Superfícies antibacterianas revestidas com nanomateriais, incluindo nanopartículas de prata, são consideradas agentes antimicrobianos alternativos eficazes que podem ser usados em vez de antibióticos e agentes químicos. No entanto, relatos sobre a toxicidade potencial desses materiais levantam questões sobre a segurança de seu uso em aplicações biomédicas. O objetivo desta pesquisa foi reduzir a citotoxicidade de células humanas de folhas de poliuretano revestidas com nanopartículas de prata complexando nanopartículas de prata com óxido de grafeno. A atividade antimicrobiana de nanopartículas revestidas com nanopartículas de prata, óxido de grafeno e o composto de nanopartículas de prata e óxido de grafeno foi avaliada com Salmonella enteritidis . A citotoxicidade foi analisada pela análise da viabilidade e morfologia de fibroblastos humanos, células endoteliais da veia umbilical humana (HUVECs) e membrana corioalantóide de embrião de galinha. Além disso, o nível de síntese de proteínas inflamatórias foi examinado para fibroblastos cultivados em diferentes nanoplataformas. A nanoplataforma revestida com as nanopartículas de prata e o composto de óxido de grafeno mostrou as propriedades antibacterianas mais fortes, embora as nanoplataformas revestidas apenas com nanopartículas de prata ou óxido de grafeno também resultassem em diminuição de S. enteritidis crescimento. Além disso, uma nanoplataforma revestida com nanopartículas de prata e composto de óxido de grafeno mostrou estimulação imunológica limitada e citotoxicidade significativamente reduzida para fibroblastos, HUVECs e membrana corioalantóide de embrião de galinha em comparação com a nanoplataforma revestida apenas com nanopartículas de prata, devido à maior estabilidade dos nanomateriais no nanocompósito.
Introdução
Materiais com superfícies antibacterianas têm sido amplamente explorados para uso na medicina e na indústria biomédica [1]. Nanomateriais são considerados agentes antimicrobianos alternativos eficazes que podem ser usados no lugar de antibióticos e agentes químicos [2]. Nanopartículas de prata (AgNPs) são mais frequentemente usadas por suas propriedades antibacterianas [3]. No entanto, nanopartículas que mostram atividade antimicrobiana, incluindo AgNPs, especialmente em concentrações mais altas, podem ser tóxicas para as células humanas e possivelmente afetar a saúde humana [4, 5]. Portanto, na indústria biomédica, a aplicação de materiais com superfícies revestidas com nanomateriais levanta questões sobre sua segurança e toxidade.
Uma das maneiras possíveis de minimizar a toxicidade potencial dos nanomateriais é limitar sua mobilidade sem alterar suas propriedades antimicrobianas. Nanomateriais firmemente fixados usados em superfícies antibacterianas que não se destacam do material reduzem sua toxicidade para células humanas [6]. Um dos métodos eficazes de revestimento de superfícies com nanopartículas é a tecnologia ultrassônica [7]. Ondas ultrassônicas levam a alterações estruturais dos nanomateriais, resultando em desaglomeração ou aglomeração, dependendo do nanomaterial [8]. A tecnologia ultrassônica também pode ser usada para a síntese de nanocompósitos de diferentes materiais, incluindo íons metálicos e nanopartículas [9,10,11]. A sonicação tem sido usada para a montagem de diferentes nanomateriais, incluindo a decoração de flocos de óxido de grafeno (GO) com AgNPs e outras nanopartículas [12].
O mecanismo de atividade antibacteriana das nanopartículas varia entre os diferentes tipos de nanopartículas; entretanto, os principais processos responsáveis pelas propriedades antimicrobianas das nanopartículas são os seguintes:interações diretas com os componentes celulares e processos indiretos, incluindo a oxidação dos componentes celulares e a interrupção dos processos oxidorredutivos [3]. A atividade antibacteriana AgNP resulta da ruptura direta da membrana celular bacteriana por AgNPs e os íons Ag + liberados, induzindo a síntese de espécies reativas de oxigênio (ROS), e o colapso do potencial de membrana plasmática, que leva ao esgotamento do ATP intracelular [13 , 14,15]. GO pode ser citotóxico para células bacterianas devido à síntese de ROS e imobilização celular direta na superfície do GO [16, 17], causada pela alta capacidade de adsorção dos nanocompósitos de GO e GO [18, 19].
No entanto, a toxicidade das nanopartículas não foi observada apenas em células bacterianas. Geralmente, as células humanas são menos vulneráveis às nanopartículas do que as bactérias devido à sua escala maior e aos seus mecanismos eficazes de reparo e defesa, mas tem sido observada citotoxicidade, especialmente em altas concentrações. A toxicidade do AgNP em estudos in vitro ocorre em concentrações de uma ordem de magnitude semelhante, embora possam variar substancialmente para sistemas biológicos ou organismos mais complexos [20]. A toxicidade dos AgNPs para organismos multicelulares é freqüentemente menor devido às suas diferenças estruturais e fisiológicas, como tecidos celulares especializados, incluindo células epiteliais [21]. A biocompatibilidade do GO para células humanas depende da concentração e da morfologia da folha. Em concentrações mais altas, o GO pode levar à penetração da membrana plasmática e aumento da síntese de ROS [22,23,24].
Em nossos estudos anteriores, mostramos que as nanoplataformas compostas por nanocompósitos AgNP e GO (Ag-GO) têm uma alta eficiência antimicrobiana para bactérias ( Escherichia coli , Staphylococcus aureus e Staphylococcus epidermidis ) e levedura patogênica ( Candida albicans ), que estava relacionado com o aumento da síntese de ROS e perfuração da membrana plasmática [25]. O Ag-GO apresentou maior atividade antibacteriana do que as nanoplataformas AgNP ou GO, devido à atividade combinada de ambos os nanomateriais. Aqui, formulamos a hipótese de que folhas de poliuretano revestidas com nanocompósito de Ag-GO teriam menor toxicidade para fibroblastos, células endoteliais da veia umbilical humana (HUVECs) e um modelo alternativo in vivo - membrana corioalantóide de embrião de galinha - do que folhas revestidas apenas com AgNPs.
Resultados
AgNPs e GO formaram um nanocompósito em hidrocolóide
A análise do microscópio eletrônico de transmissão (TEM) foi usada para avaliar a morfologia dos nanomateriais e suas interações dentro do compósito Ag-GO (Fig. 1). AgNPs eram nanopartículas esféricas que tinham um tamanho médio de aproximadamente 55 nm. Além disso, as imagens TEM mostraram a adesão de nanopartículas de prata ao GO (Fig. 1e). Estas observações foram posteriormente confirmadas na análise do potencial zeta. O potencial zeta de Ag-GO indicou que o hidrocolóide estava instável imediatamente após a sonicação, mas estabilizou após 24 h (potencial zeta:- 15,68 e - 27,7 mV, respectivamente; Tabela 1). Em contraste, o hidrocolóide AgNP era instável imediatamente após a sonicação e após 24 h, enquanto o hidrocolóide GO era bastante estável e não mudou significativamente após 24 h (potencial zeta:- 31,11 mV e - 28,42 mV, respectivamente). Além disso, a análise de espalhamento dinâmico de luz (DLS) mostrou que o Z O tamanho médio de AgNPs era 93,1 nm, GO era 1485,0 nm e Ag-GO era 1157,0 nm. A distribuição de tamanho de AgNP indicou três picos associados à formação de aglomerado, enquanto a distribuição de tamanho de GO e Ag-GO indicou um pico (Fig. 1b, d, f).
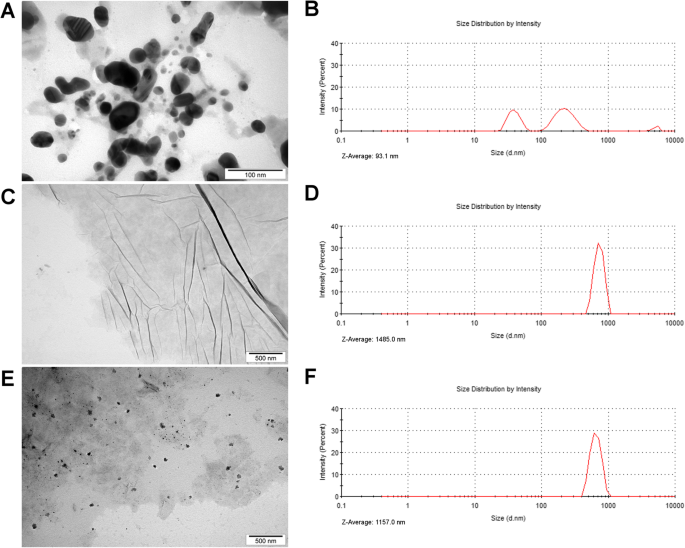
Morfologia das nanopartículas e distribuição de tamanhos. Imagens de microscopia eletrônica de transmissão de a nanopartículas de prata, c óxido de grafeno e e nanopartículas de prata e compósito de óxido de grafeno. Distribuição de tamanho de b nanopartículas de prata, d óxido de grafeno e f nanopartículas de prata e composto de óxido de grafeno
Espectros Raman e espectroscopia de infravermelho com transformada de Fourier (FT-IR) foram usados para caracterizar características estruturais do GO (Fig. 2). A Figura 2a mostra a deconvolução de D, G e D 'de GO. A posição da banda D é 1347 cm - 1 e a banda G 1578 cm - 1 ; a razão ID / IG é 1,34. A análise FT-IR revelou um pico amplo observado em ~ 3500 cm - 1 , que é atribuído principalmente aos grupos água e hidroxila. O pico em torno de 1600 cm - 1 é atribuído a ligações C =C presentes no carbono grafítico. Outros picos observados no espectro FT-IR mostram que GO é rico em grupos contendo ligações C =O (principalmente grupos carboxila), picos em torno de 1720 cm - 1 e 915 cm - 1 , epóxi (C – O – C) com o pico visível em torno de 1200 cm - 1 e ligações C – H (pico em torno de 2.800 cm - 1 )
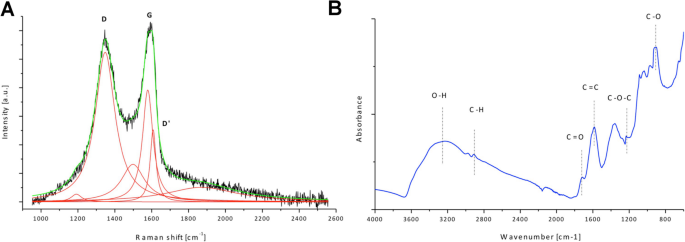
Análise de características estruturais do óxido de grafeno. a Espectro Raman de óxido de grafeno com deconvolução proposta de D, G e D '. b Espectroscopia de infravermelho com transformada de Fourier (ATR, refletância total atenuada) espectro de óxido de grafeno com atribuição de grupos funcionais
AgNP-, GO- e Ag-GO-Coated Foils Reduzido Salmonella enteritidis Crescimento
A atividade antibacteriana das nanoplataformas GO, AgNP e Ag-GO foi testada com S. enteritidis . A incubação de bactérias em folhas revestidas com nanomateriais a 37 ° C por 24 h resultou na diminuição do crescimento (Fig. 3). O mais forte S. enteritidis inibição do crescimento foi observada na nanoplataforma Ag-GO. No entanto, as nanoplataformas AgNP e GO também resultaram em diminuição de S. enteritidis crescimento. Uma comparação das imagens do microscópio eletrônico de varredura (SEM) de bactérias incubadas na nanoplataforma Ag-GO com o grupo de controle mostrou um número reduzido de S. enteritidis células. Além disso, as bactérias aderiram às nanoplataformas e apresentaram alterações morfológicas, indicando o rompimento de sua membrana celular.
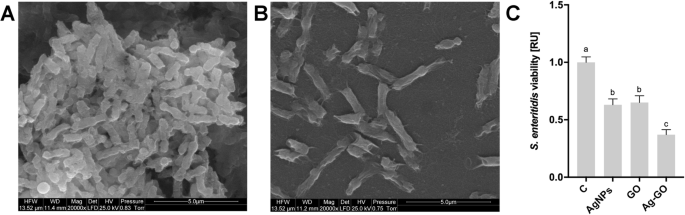
Nanoplataformas revestidas com nanopartículas de prata e óxido de grafeno diminuíram a viabilidade de S. enteritidis. Imagens de microscópio eletrônico de varredura de a controle S. enteritidis bactérias e b S. enteritidis incubado em uma nanopartícula revestida com nanopartículas de prata e óxido de grafeno, após incubação a 37 ° C por 24 h. c Viabilidade de S. enteritidis após incubação na nanoplataforma por 24 h foi avaliada com um ensaio PrestoBlue. Os valores são expressos como média ± desvio padrão ( n =3, cada experiência em triplicado). A significância estatística é indicada por sobrescritos diferentes (ANOVA unilateral; P <0,05). Abreviaturas:C, grupo de controle (folha sem nanopartículas); AgNPs, nanoplataforma revestida com nanopartículas de prata; GO, nanoplataforma revestida com óxido de grafeno; Ag-GO, nanoplataforma revestida com compósito de óxido de grafeno e nanopartículas de prata; RU, unidades relativas
A toxicidade de AgNP é inibida por GO em uma nanoplataforma Ag-GO revestida de composto
A toxicidade das nanoplataformas foi investigada pela incubação direta de fibroblastos e HUVECs por 24 h em nanoplataformas e folhas não revestidas (Fig. 4). Houve diferenças significativas entre a viabilidade de ambos os fibroblastos e HUVECs nas diferentes nanoplataformas ( P =0,0003 e P =0,0156, consequentemente). As nanoplataformas GO não alteraram a viabilidade dos fibroblastos, em comparação com a viabilidade das células incubadas em folhas não revestidas. Da mesma forma, não houve impacto significativo do GO na viabilidade dos HUVECs. No entanto, o revestimento com AgNPs resultou em uma redução de 40–50% da viabilidade de fibroblastos e HUVECs. A viabilidade celular de fibroblastos e HUVECs não foi alterada quando incubados em nanoplataformas revestidas com nanocompósito de Ag-GO, mostrando inibição da toxicidade de AgNP. A morfologia celular em folhas não revestidas mostrou a morfologia típica de fibroblastos cultivados em condições de cultura 2D (Fig. 4a). As células incubadas em folha revestida com AgNP mostraram uma agregação intensiva de células. A morfologia celular nas nanoplataformas revestidas com GO e Ag-GO mostrou uma redução das tendências de aglomeração e disseminação celular.
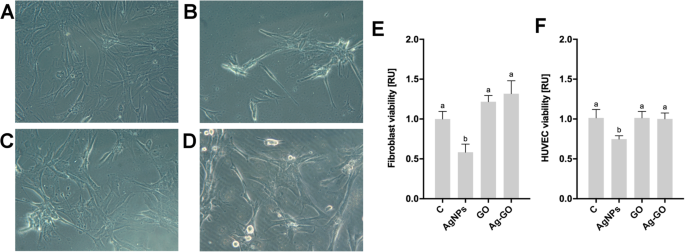
Nanoplataformas revestidas com óxido de grafeno diminuíram a citotoxicidade das nanopartículas de prata . Morfologia de fibroblastos cultivados em a nanoplataformas não revestidas, b nanoplataformas revestidas com nanopartículas de prata, c nanoplataformas revestidas com óxido de grafeno, d nanopartículas de prata e nanoplataformas revestidas com composto de óxido de grafeno. A morfologia foi avaliada por microscopia de luz usando contraste de fase com aumento de 200 ×. Fibroblasto ( e ) e HUVEC ( f ) a viabilidade após 24 h de incubação nas nanoplataformas foi determinada usando um ensaio PrestoBlue. Os valores são expressos como média ± desvio padrão ( n =3, cada experiência em triplicado). A significância estatística é indicada por sobrescritos diferentes (ANOVA unilateral; P <0,05). Abreviaturas:HUVECs, células endoteliais da veia umbilical humana; C, grupo controle (folha sem nanopartículas); AgNPs, nanoplataforma revestida com nanopartículas de prata; GO, nanoplataforma revestida com óxido de grafeno; Ag-GO, nanoplataforma revestida com um composto de óxido de grafeno e nanopartículas de prata; RU, unidades relativas
A toxicidade da nanoplataforma também foi avaliada usando uma membrana corioalantóide de embrião de galinha (Fig. 5). As nanoplataformas foram incubadas diretamente sobre uma membrana corioalantóide, e sua morfologia no local de contato foi examinada após 48 h. AgNPs causaram alterações morfológicas na membrana corioalantóide, enquanto no caso das nanoplataformas GO e Ag-GO, a morfologia foi comparável à do grupo controle (Fig. 5b). A membrana corioalantóide, após incubação na nanoplataforma AgNP, apresentou diminuição do número de vasos capilares, sugerindo toxicidade direta às células endoteliais e mesenquimais.
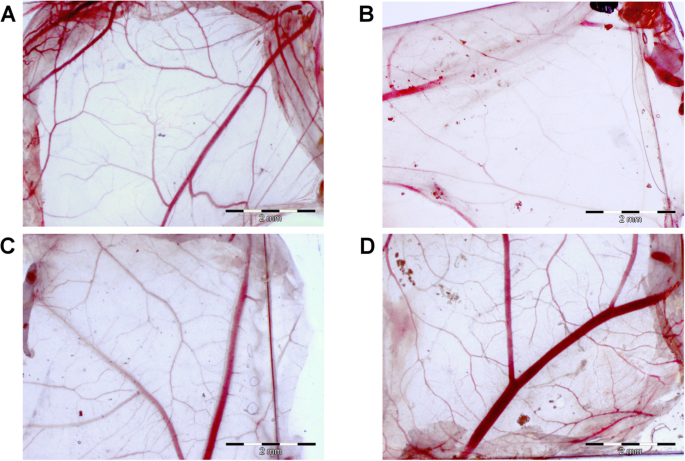
O óxido de grafeno diminuiu as alterações morfológicas da membrana corioalantóide causadas pelas nanopartículas de prata. Morfologia da membrana corioalantóide do embrião de galinha após 48 h de incubação com as nanoplataformas. a Grupo de controle (folha sem nanopartículas), b nanoplataforma revestida com nanopartículas de prata, c nanoplataforma revestida com óxido de grafeno, d nanoplataforma revestida com composto de óxido de grafeno e nanopartículas de prata
AgNPs diminuiu o lançamento de interleucinas 6 e 8
Uma matriz de anticorpos foi usada para analisar o conteúdo do meio celular de 40 proteínas inflamatórias sintetizadas por fibroblastos (Fig. 6). As principais proteínas inflamatórias liberadas pelos fibroblastos foram interleucina 8 (IL-8; Fig. 6, pontos:E5, F5) e interleucina 6 (IL-6; Fig. 6, pontos:E8, F8). As nanoplataformas AgNP e Ag-GO diminuíram significativamente o nível de liberação de IL-8, enquanto a nanoplataforma GO não teve esse efeito. Além disso, as nanoplataformas GO e Ag-GO diminuíram o nível de liberação do fator estimulador de colônias de granulócitos-macrófagos (GM-CSF; Fig. 6, pontos:G5, H5). As nanoplataformas GO e Ag-GO também levaram ao aumento do nível de liberação do fator de necrose tumoral beta (TNF-β; Fig. 6, pontos:A9, B9). Curiosamente, as nanoplataformas AgNP, GO e Ag-GO diminuíram significativamente o nível de liberação de IL-6. O nível de liberação das demais proteínas analisadas não foi alterado. Um mapa de matriz com uma lista de todas as citocinas analisadas está incluído no arquivo adicional 1:Figura S1.
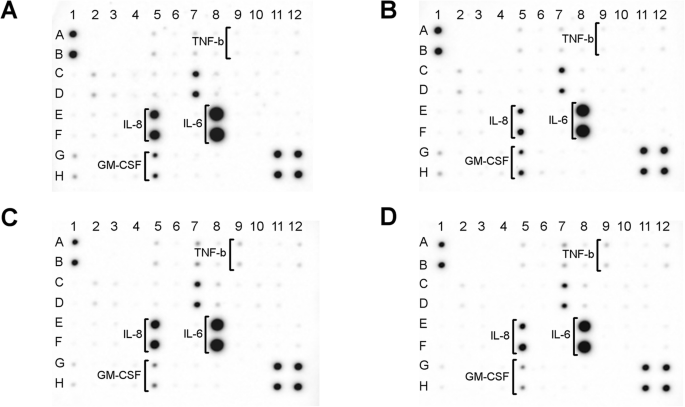
Análise da matriz de anticorpos da liberação de citocinas inflamatórias de fibroblastos após 24 horas de incubação. a Grupo de controle (folha sem nanopartículas), b nanoplataforma revestida com nanopartículas de prata, c nanoplataforma revestida com óxido de grafeno, d Nanoplataforma Ag-GO revestida com composto de óxido de grafeno e nanopartículas de prata. As nanoplataformas AgNP e Ag-GO diminuíram o nível de liberação de IL-8 (pontos:E5, F5). Ambas as nanoplataformas GO e Ag-GO diminuíram a síntese de GM-CSF (pontos:G5, H5). Além disso, as nanoplataformas GO e Ag-GO levaram ao aumento da síntese de TNF-β (pontos:A9, B9). As nanoplataformas AgNP, GO e Ag-GO diminuíram o nível de liberação de IL-6 (pontos:E8, F8). Um mapa de matriz completa está disponível no arquivo adicional 1
Discussão
Em aplicações biomédicas, a segurança dos nanomateriais usados em materiais antimicrobianos é tão importante quanto sua eficiência em matar bactérias. Neste estudo, mostramos que os materiais de revestimento com GO podem diminuir de forma eficiente a toxicidade dos nanomateriais. A folha de poliuretano revestida com AgNPs e GO (Ag-GO) não só aumentou suas propriedades antimicrobianas, mas também diminuiu sua toxicidade em células humanas.
A espectroscopia Raman foi usada para analisar as características estruturais do óxido de grafeno. A banda G no espectro Raman corresponde a sp 2 material hibridizado à base de carbono [26]. O pico D está relacionado a defeito ou distúrbio de rede devido à ligação do grupo funcional de oxigênio [27]. A intensidade da banda D está associada ao tamanho do sp 2 domínios no plano [26]. As bandas adicionais D 'surgem dos defeitos presentes na estrutura grafítica do material de carbono. A razão ID / IG (calculada a partir da intensidade das bandas D e G) pode ser usada para caracterizar a desordem da estrutura grafítica em materiais de carbono. Conforme demonstrado, o GO possui uma estrutura altamente desordenada devido a muitos grupos funcionais na estrutura formada durante a oxidação do pó de grafite [28].
O espectro FT-IR do óxido de grafeno coletado no modo ATR revelou que GO tem muitos grupos funcionais presentes na estrutura, incluindo grupos carboxila e epóxi, picos em torno de 1720 cm - 1 e 915 cm - 1 , epóxi (C – O – C) com o pico visível em torno de 1200 cm - 1 e ligações C – H (pico em torno de 2.800 cm - 1 ) A análise FT-IR está em boa concordância com as medições de XPS realizadas para GO, onde também grupos hidroxila, carboxila, epóxi e carbonila foram identificados [29].
O revestimento dos nanomateriais foi realizado com tecnologias ultra-sônicas, que têm se mostrado um método eficaz de revestimento de vários materiais com substâncias antibacterianas e fungicidas, incluindo AgNPs [30, 31]. Ondas ultra-sônicas utilizam fenômenos de cavitação gerando e colapsando bolhas de cavitação, produzindo alta energia e pressão [32]. Nanomateriais acelerados a altas velocidades colidem com o material revestido e são depositados na superfície [33]. No entanto, a efetividade da deposição de nanomateriais pode ser aumentada não apenas usando um método de revestimento adequado, mas também fazendo compósitos com nanomateriais que podem ser mais facilmente fixados à superfície. GO é um nanomaterial favorável para a criação de compostos estáveis com diferentes nanomateriais e superfícies. Devido à sua estrutura única, com átomos de carbono em um padrão hexagonal com numerosos grupos funcionais contendo oxigênio nas proximidades, incluindo grupos carboxila e hidroxila, o GO é propenso a formar ligações covalentes ou interações eletrostáticas [34]. Normalmente, os compostos de nanopartículas GO são sintetizados pela fixação de íons metálicos ou nanopartículas metálicas às superfícies GO por meio de interações eletrostáticas ou covalentes. Além disso, a redução de íons metálicos e / ou GO é realizada para formar ligações covalentes [35]. Compósitos Ag-GO foram feitos usando ultra-som pela redução in situ de Ag + [36, 37], bem como pela deposição de AgNPs [12]. Em nosso relatório anterior, mostramos que métodos ultrassônicos podem ser usados para sintetizar nanoplataformas revestidas com Ag-GO em folhas de poliuretano [25]. No entanto, a sonicação não só levou ao revestimento de folhas de poliuretano com nanomateriais, mas também à formação de um composto Ag-GO. A formação do compósito Ag-GO, antes mesmo do revestimento das folhas, pode ter resultado na maior estabilidade dos AgNPs após o revestimento.
Em nossos estudos, fibroblastos e HUVECs foram usados para estudos de citotoxicidade seguidos por análise de membrana corioalantóide de embrião de galinha. Os fibroblastos da pele são considerados um bom modelo para estudos de irritação da pele em comparação com a análise in vivo [38], enquanto as células endoteliais, incluindo a citotoxicidade de HUVEC, são frequentemente estudadas devido ao provável contato direto das nanopartículas em aplicações biomédicas e à sensibilidade dessas células às nanopartículas [ 39, 40]. A membrana corioalantóide de embrião de galinha é um modelo alternativo in vivo para modelos de roedores para vários estudos de toxicologia, incluindo toxicologia de material e estudos toxicológicos agudos [41, 42].
Fibroblastos e HUVECs tiveram maior viabilidade quando cultivados em Ag-GO do que em nanoplataformas revestidas com AgNP. Além disso, a nanoplataforma AgNP causou alterações morfológicas na membrana corioalantóide, enquanto no caso das nanoplataformas GO e Ag-GO, a morfologia celular foi comparável ao grupo controle. A diminuição da toxicidade na nanoplataforma Ag-GO pode resultar dos efeitos combinados de uma maior estabilidade de AgNPs no complexo com GO e uma melhor deposição de AgNPs na nanoplataforma. A toxicidade das células animais é frequentemente mais grave após as nanopartículas terem entrado na célula por penetração direta ou endocitose [43]. A endocitose das nanopartículas depende do tamanho e da forma. Partículas e compostos maiores são absorvidos em uma extensão menor do que partículas que têm aproximadamente 45 nm de tamanho [44]. A relação mais notável entre a endocitose e a forma ou tamanho dos nanomateriais é característica dos nanotubos de parede de carbono. Nanotubos com comprimento inferior a 1 µm penetram efetivamente na membrana plasmática através da difusão direta, enquanto a fagocitose ou as vias de endocitose internalizam nanotubos mais longos e aglomerados [45]. Recentemente, o nanocompósito Ag-GO mostrou ser internalizado por macrófagos J774, aproximadamente 60% menos do que os AgNPs. No entanto, como o Ag-GO induziu mais ROS, a toxicidade geral para as células foi maior [46]. Além disso, a análise cinética da internalização dependente da forma das nanopartículas mostra que as nanopartículas de tamanho esférico são geralmente internalizadas muito mais rápido do que as partículas planas [47]. Além disso, a toxicidade das nanopartículas para células humanas é geralmente dependente do tamanho, em que partículas menores apresentam propriedades citotóxicas mais fortes. Em estudos sobre a citotoxicidade dependente do tamanho de AgNPs para RAW, 264,7 macrófagos e nanopartículas de fibroblastos L929 tiveram menor viabilidade após o tratamento com AgNPs de 20 nm do que após o tratamento com nanopartículas maiores (80, 113 nm) [13]. Portanto, o tamanho aumentado dos compósitos Ag-GO e a capacidade diminuída das células de captar nanopartículas resultantes da deposição estável na superfície podem ser a razão para a maior viabilidade observada de HUVECs e fibroblastos cultivados na nanoplataforma Ag-GO.
As nanoplataformas AgNP e Ag-GO diminuíram significativamente o nível de liberação de IL-8 pelos fibroblastos. As nanoplataformas GO e Ag-GO levaram a uma maior liberação de TNF-β. Além disso, as nanoplataformas AgNP, GO e Ag-GO diminuíram a liberação de IL-6. Curiosamente, alterações na síntese de proteínas pró-inflamatórias por fibroblastos foram relacionadas à incubação de células em nanoplataformas revestidas com AgNPs ou GO. Os níveis de síntese das células incubadas em Ag-GO não diferiram daqueles incubados em nanoplataformas revestidas com apenas um desses nanomateriais, sugerindo que a atividade biológica não se alterou após a síntese do compósito. Os fibroblastos são importantes nos processos inflamatórios e de remodelação, iniciando respostas inflamatórias e precipitando na passagem da inflamação aguda para o reparo do tecido [48, 49]. Portanto, a análise da secreção de fibroblastos de citocinas inflamatórias é importante para predizer a resposta imunológica às nanoplataformas. Tanto a IL-6 quanto a IL-8 são uma das principais citocinas inflamatórias que, após síntese pelos fibroblastos, levam à ativação da resposta imunológica [50, 51]. O nível de síntese de queratinócitos epidérmicos humanos de IL-6 diminui após o tratamento com AgNPs [52]. Da mesma forma, a inibição da liberação de IL-6 por AgNPs foi demonstrada em células Jurcat e envolve a via MAPK. AgNPs também diminuem os níveis de síntese do fator de necrose tumoral alfa (TNF-α) [53]. O TNF-α e, muito semelhantes em estrutura e função, o TNF-β são citocinas inflamatórias importantes durante a fase de inflamação aguda. Embora as células imunes sejam as principais responsáveis pela liberação dessas proteínas durante a fase aguda da inflamação, os fibroblastos e diferentes células estão envolvidos na síntese de citocinas inflamatórias durante o processo inicial de cicatrização de feridas [54]. A atividade para induzir TNF-α após o tratamento com GO foi demonstrada usando macrófagos RAW264.7 [55], o que sugere estimulação imunológica. No entanto, em nossos estudos, os níveis de liberação da maioria das proteínas pró-inflamatórias analisadas não foram alterados depois que as células foram cultivadas nas nanoplataformas GO e Ag-GO. Portanto, essas análises sugerem que ambas as nanoplataformas GO e Ag-GO possuem boa biocompatibilidade e não devem levar a fortes reações imunológicas.
Conclusões
Em conclusão, os resultados apresentados mostram que as nanoplataformas revestidas com um composto Ag-GO mostraram maior inibição do crescimento de S. enteritidis do que as nanoplataformas revestidas com AgNP e GO. Além disso, o composto Ag-GO reduziu significativamente a citotoxicidade para fibroblastos, HUVECs e membrana corioalantóide de embrião de galinha, em comparação com nanoplataformas revestidas com AgNPs. A viabilidade celular de fibroblastos e HUVECs não foi alterada quando incubados em nanoplataformas revestidas com nanocompósito de Ag-GO, mostrando inibição da toxicidade de AgNP. Esses resultados, juntamente com a baixa estimulação imunológica, sugerem que o GO pode ser utilizado para redução da citotoxicidade de diferentes nanomateriais em nanocompósitos. Além disso, os resultados sugerem que a nanoplataforma Ag-GO pode ser considerada para uso em aplicações biomédicas. No entanto, estudos adicionais são necessários para avaliar a nanoplataforma Ag-GO para aplicações específicas, incluindo curativos para feridas.
Materiais e métodos
Preparação e caracterização de nanoplataformas revestidas com nanomateriais
Nanoplataformas feitas de folhas de poliuretano revestidas com nanopartículas foram preparadas conforme descrito anteriormente [25]. Folhas de poliuretano quadradas (15 × 15 mm, 0,05 mm de espessura) foram cobertas com suspensões de AgNPs (HydroSilver1000, Amepox, Łódź, Polônia) sintetizados por reação de redução química na presença de álcool polivinílico desenvolvido por Amepox e / ou GO sintetizado por método modificado de Hummers. Dez gramas de pó de grafite foram misturados com 230 ml de ácido sulfúrico concentrado (98%) (Sigma-Aldrich Co., St. Louis, MO, EUA) a uma temperatura abaixo de 10 ° C. Posteriormente, 4,7 g de nitrato de sódio (Sigma-Aldrich) e 30 g de permanganato de potássio (Sigma-Aldrich) foram adicionados à mistura de grafite, mantendo a temperatura abaixo de 10 ° C. Em seguida, a mistura foi aquecida a 30 ° C e agitada durante 2 h. Posteriormente, foram adicionados 100 ml de água e a mistura foi tratada com 10 ml de peróxido de hidrogênio. GO foi purificado por filtração e lavado com água desionizada até o pH do filtrado atingir 6,5. Suspensões de GO, AgNPs e o composto de AgNPs e GO (Ag-GO) foram preparadas em água deionizada. Durante o revestimento, as concentrações de nanomateriais foram as seguintes:GO, 200 mg / l; AgNPs, 100 mg / l; Ag-GO, 200 mg / l; e AgNPs, 100 mg / l. O revestimento das nanopartículas foi realizado usando uma corneta ultrassônica (corneta de Ti, Ø13 mm, 60% de eficiência, 20 kHz; Sonics &Materials, Inc., Newtown, CT, EUA) a uma temperatura de 30 ± 1 ° C. As amostras cobertas foram lavadas em água desionizada e secas em condições estéreis. A caracterização de nanoplataforma com um microscópio eletrônico de varredura (MEV), microscópio de força atômica (AFM) e microscópio de força lateral (LFM) foi relatada anteriormente, mostrando nanoplataformas quase inteiramente cobertas por nanomateriais [25].
Os nanomateriais usados para obter as nanoplataformas foram fotografados usando um microscópio eletrônico de transmissão (TEM). As imagens TEM foram adquiridas usando um microscópio JEM-1220 (JEOL, Tóquio, Japão) a 80 kV com uma câmera Morada de 11 megapixels (Olympus Corporation, Tóquio, Japão). As amostras foram preparadas colocando gotículas de hidrocolóides em grades de cobre revestidas com formvar (Agar Scientific, Stansted, Reino Unido), que foram deixadas secar ao ar antes das observações.
Os espectros Raman foram coletados usando um espectrômetro Renishaw inVia com uma fonte de laser de 532 nm (Wotton-under-Edge, Reino Unido). Para evitar o aquecimento da amostra, a potência do laser foi mantida baixa (0,3 mW, calibrado na amostra). O modo de mapeamento Raman foi usado com uma área de varredura de aproximadamente 10 × 10 μm, contendo 25 espectros). Cada espectro consiste em duas bandas principais, uma banda G (~ 1578 cm - 1 ) e banda D (~ 1347 cm - 1 ), foi ajustado usando a forma de linha Lorentziana. As medições de FT-IR foram realizadas usando um espectrômetro Nicolet iS10 (Thermo Fisher Scientific, Waltham, EUA) no modo de refletância total atenuada em um cristal de diamante. A suspensão de óxido de grafeno foi seca na superfície de polietileno à temperatura ambiente para criar uma folha fina GO. O espectro foi coletado no intervalo de 400–4000 cm - 1 .
Zeta potential measurements of GO (20 mg/l), AgNPs (10 mg/l) and Ag-GO (GO 20 mg/l and AgNPs 10 mg/l) were carried out with a Nano-ZS90 Zetasizer (Malvern Instruments, Malvern, UK) at 25 °C, using the Smoluchowski approximation. Nanomaterials were sonicated for 30 min and zeta potential was immediately measured. Subsequently, nanomaterials were left for 24 h at room temperature and the zeta potential was measured again. Each measurement was repeated at least seven times after 60 s of stabilisation at 25 °C.
The hydrodynamic diameter of nanoparticles in water and their size distribution were measured with dynamic light scattering (DLS) using a Nano-ZS90 Zetasizer (Malvern). Similar to for the zeta potential analysis, GO (20 mg/l), AgNPs (10 mg/l) and Ag-GO (GO 20 mg/l and AgNPs 10 mg/l) were sonicated for 30 min and left for 24 h at room temperature. Each sample was measured at least seven times at 25 °C.
Bacterial Cultivation
Salmonella enteritidis subspecies enterica serovar Enteritidis (ATCC 13076) was obtained from LGC Standards (Łomianki, Poland). The bacteria were grown on tryptic soy agar (Merck Millipore, Darmstadt, Germany). The bacteria, grown on agar plates, were harvested by gently washing the plates with sterile distilled saline solution. To calculate the number of bacteria in the cell suspension, the optical density of the suspensions at 600 nm (OD600) was measured using a spectrophotometer (Helios Epsilon, Unicam, Milwaukee, WI, USA). A calibration curve was prepared by performing serial tenfold dilutions of bacterial suspensions of a known optical density, up to 10 − 5 . After 24 h of incubation at 37 °C, the number of formed colonies was enumerated and the number of colony-forming units (CFU) of the original bacterial suspension was calculated.
Bacteria Viability Assay
Viability was evaluated using a PrestoBlue Cell Viability Assay (Thermo Fisher Scientific). Bacteria were cultured onto foils coated with GO, AgNPs and Ag-GO, located on inserts inserted into six-well plates (200 μl MH broth with 5 × 10 3 CFU per foil) and incubated for 24 h. Subsequently, 90 μl of each sample was transferred to 96-well plates and 10 μl of PrestoBlue reagent was added to each well and incubated for an additional 2 h at 37 °C. The optical density of each well was recorded at 570 nm using a microplate reader (Infinite M200, Tecan, Durham, NC, USA). Bacteria viability was expressed as the relative value after substitution of the absorbance from the blank samples. Experiments were repeated three times.
Scanning Electron Microscopy Analysis
Bacteria were incubated on foils with Ag-GO and a sterile cover glass. Bacteria cultures (100 μl, 10 6 CFU/ml) were incubated on foils and a cover glass for 24 h at 37 °C. Todas as amostras foram secas e cobertas com ouro. Cells were fixed with 2.5% glutaraldehyde in phosphate-buffered saline (PBS, pH 7.2) and contrasted with 1% osmium tetroxide (Sigma-Aldrich) and 1% carbohydrazide (Sigma-Aldrich). Subsequently, cells were dehydrated in increasing concentrations of hexylene glycol (Sigma-Aldrich). Drying was performed using a Polaron CPD 7501 critical point dryer (Quorum Technologies, Laughton, UK). Finally, the samples were imaged with a SEM (FEI Quanta 200, Tokyo, Japan) at an acceleration voltage of 15 kV.
Human Cell Lines
Human umbilical vein endothelial cells (HUVECs; catalogue number:C0035C) and human fibroblasts (catalogue number:C0135C) were obtained from Thermo Fisher Scientific. HUVECs were maintained on low-serum Medium 200 basal media supplemented with Large Vessel Endothelial Supplement (Thermo Fisher Scientific) and 1% penicillin/streptomycin (Thermo Fisher Scientific), whereas fibroblasts were cultured in low-serum Medium 106 (Thermo Fisher Scientific) supplemented with Low Serum Growth Supplement (Thermo Fisher Scientific) and 1× penicillin/streptomycin (Thermo Fisher Scientific). Cells were maintained at 37 °C in a humidified atmosphere of 5% CO2 /95% air.
To analyse biological interactions, the nanoplatforms were put into six-well plates. After detachment from the cell culture flask, HUVECs or fibroblasts were placed directly on the nanoplatform with 100 μl of growth media. To avoid the media drying during incubations, plates were kept in humidity chambers.
Analysis of Nanoplatform Toxicity to HUVECs and Fibroblasts
To analyse HUVEC and fibroblast viability on the nanoplatforms, cells were cultured in the droplet directly on the nanoplatforms or uncoated foil (1 × 10 4 cells in 100 μl growth media). After 24 h of incubation, cell viability was analysed using a PrestoBlue assay (Thermo Fisher Scientific). PrestoBlue reagent was incubated with assessed cells for 2 h in a cell culture incubator. Subsequently, 50 μl of growth media with PrestoBlue reagent was transferred to a 96-well plate where fluorescence (excitation λ = 560 nm, emission λ = 590 nm) was analysed using a Tecan Infinite 200 microplate reader (Tecan, Durham, USA). Cell viability was expressed as the relative value after substitution of the fluorescence from blank samples. Experiments were repeated three times.
Fibroblast morphology was observed using an inverted optical microscope (Olympus Corporation) using phase contrast. Fibroblasts were seeded in 35-mm diameter Petri dishes directly on the nanoplatforms (1 × 10 4 cells in 100 μl growth media). Images were taken after 24 h of incubation.
Chorioallantoic Membrane Assay
Fertilised eggs from Ross 308 hens were obtained from a certified hatchery and kept for 4 days at 12 °C. The eggs were cleaned, sterilised with UVC light and divided into four groups (4 × 20 eggs). Embryos were incubated at standard conditions (temperature 37 °C, humidity 60% and turned once per hour). At 8 days of embryonic development, small holes (1 cm 2 ) were made in the shell above the air space, the inner membrane was gently striped off and the nanoplatforms were placed on the chicken embryo chorioallantoic membrane. Subsequently, chicken embryos were incubated for the next 48 h, when nanoplatforms were cut out with the chorioallantoic membrane that was directly below the nanoplatform. The chorioallantoic membrane on the nanoplatforms was imaged using a stereoscopic microscope (SZX10, Olympus Corporation).
Antibody Array Analysis
An analysis of inflammation cytokines in fibroblast growth medium was performed using an antibody array (Abcam, Cambridge, UK; catalogue number ab134003). Fibroblast cells (1 × 10 4 ) were incubated on nanoplatforms coated with AgNPs, GO, Ag-GO and uncoated foil with 100 μl of media. After 24 h, 80 μl of growth medium was collected. For each experimental group, the growth medium from six foils was used for analysis. Pooled growth medium from the six experiments was centrifuged (1600 rpm for 5 min), and 500 μl of growth media was diluted in 500 μl of PBS. Therefore, 1 ml of diluted growth media was used per each analysed membrane. The assay was performed in accordance with the manufacturer’s instructions. Diluted growth media was incubated with the membranes for 24 h at 4 °C. Subsequently, antibodies conjugated with biotins were added and incubated for the next 24 h at 4 °C. In the next step, the membranes were incubated with streptavidin conjugated with horseradish peroxidase for 2 h at room temperature. Membranes were visualised after the addition of the provided horseradish peroxidase substrate using a ChemiDoc imaging system (Bio-Rad, Hercules, USA).
Statistical Analysis
Data were analysed using one-way analysis of variance with GraphPad Prism 8 (GraphPad Software, San Diego, CA, USA). Differences between groups were tested with Tukey’s HSD post hoc tests. Results are shown as means with standard deviations. Differences at P < 0.05 were considered significant.
Disponibilidade de dados e materiais
The datasets used and/or analysed during the current study are available from the corresponding author on reasonable request.
Abreviações
- Ag-GO:
-
Composite of silver nanoparticles and graphene oxide
- AgNPs:
-
Silver nanoparticles
- CFU:
-
Colony-forming units
- DLS:
-
Espalhamento de luz dinâmico
- FT-IR:
-
Espectroscopia de infravermelho com transformada de Fourier
- GM-CSF:
-
Granulocyte-macrophage colony-stimulating factor
- GO:
-
Óxido de grafeno
- HUVECs:
-
Human umbilical vein endothelial cells
- IL-6:
-
Interleukin 6
- IL-8:
-
Interleukin 8
- SEM:
-
Microscópio eletrônico de varredura
- TEM:
-
Microscopia eletrônica de transmissão
- TNF-α:
-
Tumour necrosis factor alpha
- TNF-β:
-
Tumour necrosis factor beta
Nanomateriais
- Preparação de nanopartículas de mPEG-ICA carregadas com ICA e sua aplicação no tratamento de dano celular H9c2 induzido por LPS
- Síntese biogênica, caracterização e avaliação do potencial antibacteriano de nanopartículas de óxido de cobre contra Escherichia coli
- Síntese fácil de compósito CuSCN colorido e condutor revestido com nanopartículas de CuS
- Células endoteliais de segmentação com nanopartículas de GaN / Fe multifuncionais
- Biossegurança e capacidade antibacteriana do grafeno e do óxido de grafeno in vitro e in vivo
- Promoção do crescimento celular SH-SY5Y por nanopartículas de ouro modificadas com 6-mercaptopurina e um peptídeo penetrador de neurônio
- Adepto verde na síntese e estabilização de nanopartículas de cobre:atividades catalíticas, antibacterianas, citotoxicidade e antioxidantes
- Platycodon saponins from Platycodi Radix (Platycodon grandiflorum) para a síntese verde de nanopartículas de ouro e prata
- Nanocompósitos à base de óxido de grafeno decorados com nanopartículas de prata como agente antibacteriano
- Síntese Verde de Nanopartículas de Metal e Óxido de Metal e Seu Efeito na Alga Unicelular Chlamydomonas reinhardtii



