Gene direcionado silenciando o efeito fototérmico sinergizado BRAF inibe o crescimento de células de hepatoma usando o novo nanossistema GAL-GNR-siBRAF
Resumo
O câncer de fígado é uma das doenças malignas mais comuns em todo o mundo. Os inibidores da RAF quinase são eficazes no tratamento do carcinoma hepatocelular (CHC); portanto, a inibição da via BRAF / MEK / ERK tornou-se uma nova estratégia terapêutica para uma nova terapia de CHC. No entanto, os sistemas de entrega específicos direcionados para tumores ainda são um obstáculo significativo para as aplicações clínicas. A galactose (GAL) pode ter como alvo o receptor de asialoglicoproteína (ASGPR), que é altamente expresso nas células cancerosas do fígado. Neste estudo, nós projetamos um novo nanomaterial multifuncional GAL-GNR-siBRAF que consiste em três partes, GAL como a porção direcionada ao câncer de fígado, nanobastões dourados (GNR) oferecendo capacidade fototérmica sob luz infravermelha próxima e siRNA especificamente silenciando BRAF (siBRAF ) O nanocarreador GAL-GNR-siBRAF apresentou alta capacidade de carregamento de siRNA e inibiu a degradação do siRNA no soro. Comparado com nanobastões de ouro nus, GAL-GNR-siBRAF possuía menor biotoxicidade e maior eficácia de silenciamento de genes. O tratamento com GAL-GNR-siBRAF diminuiu significativamente a expressão de BRAF e prejudicou a proliferação, migração e invasão de células cancerosas do fígado. Além disso, os efeitos fototérmicos combinatórios e o knockdown de BRAF por GAL-GNR-siBRAF efetivamente deram origem à morte de células tumorais. Portanto, nosso estudo desenvolveu um novo tipo de nanomaterial multifuncional GAL-GNR-siBRAF direcionado para o tratamento de câncer de fígado, que fornece ideias para o desenvolvimento de novos métodos de tratamento clínico.
Introdução
O carcinoma hepatocelular (CHC) é um grande problema de saúde global [1]. É o sexto câncer mais comum no mundo e a terceira principal causa de morte relacionada ao câncer [2, 3]. A maioria dos casos de CHC ocorre na Ásia Oriental e na África Subsaariana. No entanto, a incidência tem aumentado em alguns países desenvolvidos, incluindo França, Grã-Bretanha, Japão e Estados Unidos [4]. O tratamento padrão para o CHC precoce é a ressecção cirúrgica do tumor. Após a cirurgia, a taxa de sobrevida em 5 anos pode variar de 89 a 93% [5]. Infelizmente, apenas uma pequena porcentagem de pacientes com CHC (cerca de 20-30%) são diagnosticados em um estágio inicial; a maioria dos pacientes com CHC (> 70%) é encontrada em uma cena avançada e não pode ser submetida à ressecção cirúrgica. Outras opções de tratamento incluem transplante de fígado, quimioembolização arterial transcateter (TACE) e quimioterapia sistêmica [6]. No entanto, o transplante de fígado é limitado pelo fornecimento, e a embolização TACE incompleta pode levar à falha do tratamento, com efeitos colaterais significativos da quimioterapia sistêmica e prognóstico geral desfavorável. Portanto, novos métodos de tratamento para o carcinoma hepatocelular são altamente exigentes clinicamente [7].
A via de sinalização RAS / RAF desempenha um papel essencial no desenvolvimento do câncer de fígado, e BRAF é um dos genes essenciais associados ao câncer nessa via. Alterações genéticas nesses genes geralmente resultam em dois distúrbios em cascata. A ativação anormal da via de sinalização RAS / RAF está associada a um mau prognóstico em pacientes com câncer [8]. BRAF é o gene mutado com mais frequência na família RAF, e o direcionamento da via RAS / RAF é uma nova estratégia terapêutica para o tratamento do CHC [8,9,10]. Uma vez que o inibidor da RAF quinase, sorafenibe, demonstrou ser útil no tratamento do CHC, portanto, as mutações de BRAF se tornaram o alvo preferido para a terapia com CHC [8]. Mais especificamente, as mutações BRAF tornaram-se um alvo desejável para o tratamento de CHC avançado, uma vez que o desenvolvimento clínico do inibidor da quinase RAF sorafenibe foi encontrado no tratamento de CHC na Ásia, Europa e EUA [11]. Em comparação com o placebo, o sorafenibe aumentou a sobrevida global, prolongando a sobrevida global mediana de pacientes com CHC avançado [12,13,14]. No entanto, o sorafenibe tem baixa capacidade de direcionamento ao tumor, o que pode levar a efeitos colaterais adversos, como hipertensão, queda de cabelo e náusea [15]. Drogas que têm como alvo o câncer de fígado com alta especificidade e bloqueiam a RAF ainda precisam ser mais exploradas.
O receptor de asialoglicoproteína (ASGPR), também conhecido como receptor de galactose do fígado, é uma lectina do tipo C expressa na superfície sinusoidal dos hepatócitos [16]. ASGPR é considerado um alvo essencial para nanoestruturas hepáticas porque desempenha um papel importante na ligação, internalização e eliminação de substâncias com resíduos terminais de galactose [17]. Vários monossacarídeos (galactose, manose, lactose, N-acetilgalactosamina e ácido siálico) foram relatados para interagir com ASGPR em vários graus, e galactose mostrou maior afinidade para ASGPR [18]. Porque ASGPR é fortemente exposto à superfície das células do parênquima hepático [19], o receptor tem uma forte afinidade para galactose e pró-drogas galactosiladas ou sistemas de entrega direcionados ao fígado. Nanopartículas de galactose [20], micelas de galactose [21] e lipossomas de galactose [22] foram identificados como sistemas de fármacos de direcionamento hepático, que têm como alvo específico células carcinoides hepatocelulares.
Nanobastões de ouro (GNR) são nanopartículas de ouro em forma de bastão que apresentam vantagens significativas como nanocarreadores [23]. Os nanobastões de ouro (GNR) têm excelente biocompatibilidade e podem ser usados para entrega estável de siRNA [24]; eles têm uma grande área de superfície específica, o que permite a modificação flexível de adaptadores direcionados a tumores específicos [25]; A ressonância plasmônica de superfície localizada (LSPR) tem alta eficiência de conversão fototérmica sob irradiação de luz infravermelha e se tornou um excelente material antitumoral fototérmico [26]. A eficiência fototérmica máxima pode ser alcançada ajustando a razão de aspecto dos nanobastões de ouro (GNR). A toxicidade in vitro e in vivo das nanopartículas de ouro depende de seu tamanho, carga superficial e revestimento superficial [27]. No entanto, o brometo de cetiltrimetilamônio (CTAB) é um agente ativo essencial na síntese de nanobastões de ouro, que apresenta citotoxicidade aparente e limita as aplicações biológicas [28].
Interferência de RNA (RNAi) tornou-se uma abordagem promissora para o tratamento do câncer porque efetivamente nocauteia ou silencia genes alvo por pequenos RNA interferentes (siRNA) [29]. Recentemente, as moléculas de siRNA entraram na fase de testes em humanos e são consideradas formas promissoras para tratar cânceres e tumores de múltiplos genes mutantes [30]. No entanto, a aplicação de siRNA ainda enfrenta enormes desafios, como instabilidade sérica (degradação por nucleases no ambiente extracelular) e efeitos fora do alvo [31]. Além disso, os siRNAs são carregados negativamente, o que os impede de se ligarem a membranas celulares carregadas negativamente [32]. Devido a essas características, é improvável que o siRNA seja entregue diretamente às células. A estabilidade do siRNA pode ser melhorada pela modificação química do siRNA ou pela inserção de carregadores de siRNA em materiais portadores de proteção [33].
Neste estudo, construímos recentemente um nanocarreador multifuncional GAL-GNR-siBRAF. O sistema usa nanobastões de ouro com capacidade ótica de geração de calor como o núcleo interno e GAL externamente modificado (d-galactose) com direcionamento específico de tumores hepáticos. Este sistema reduziu a toxicidade biológica de CTAB na superfície de nanobastões de ouro e mostrou alta capacidade de carga de siRNA e pode ser usado para silenciar o gene BRAF no câncer de fígado de forma eficaz. A aplicação de GAL-GNR-siBRAF atenuou a proliferação, invasão e migração de células de câncer de fígado de forma significativa. Além disso, o GAL-GNR-siBRAF induziu simultaneamente o silenciamento gênico de BRAF e efeitos fototérmicos que alcançaram eficácia sinérgica na capacidade de matar células tumorais, proporcionando uma nova maneira de pensar para o desenvolvimento do tratamento clínico do câncer de fígado.
Material e métodos
Linha celular
A linha celular de carcinoma hepatocelular de ratinho Hepa1-6 foi adquirida a Stem Cell Bank, Chinese Academy of Sciences. As células foram cultivadas em meio DMEM (Life Technologies, Carlsbad, CA) contendo 10% de FBS a 37 ° C com 5% de CO 2 .
Síntese de siRNA BRAF
A sequência para siRNA direcionado ao gene BRAF é 5′-GCUUACUGGAGAGGAGUUACA-3 ′ e foi sintetizada por Dharmacon, Inc. (Lafayette, CO, EUA). O gene de luciferase direcionado disponível comercialmente siGL2 foi usado como um siRNA de controle negativo.
Síntese de CTAB-GNR
Nanobastões de ouro solúveis em água foram sintetizados usando uma via de crescimento mediada por sementes [34]. A solução de sementes foi fabricada da seguinte forma:1 mL de brometo de cetiltrimetilamônio (CTAB) (0,2 M) (Sinopharm) foi suavemente misturado com 1 mL de HAuCl 4 (0,5 mM) (Sinopharm). Agitou a solução a 28 ° C, misturou completamente e adicionou 0,12 mL de NaBH frio 4 (0,01 M) (Sinopharm) até que a solução de sementes obtida se tornasse marrom e permanecesse na reserva. A solução de crescimento foi então sintetizada da seguinte forma:50 mL de CTAB (0,2 M) e 50 mL de HAuCl 4 (1 mM), 2,5 mL AgNO 3 (4 mM) (Sinopharm) foram ligeiramente misturados a 28 ° C. Após mistura moderada completa, 670 μL de ácido ascórbico (0,079 M) foram adicionados quando a cor da solução mudará de amarelo escuro para incolor. Cento e vinte microlitros da solução de semente foram adicionados sob agitação suave a 28 ° C, e a cor tornou-se gradualmente transparente de púrpura a negro púrpura. Após 24 h de agitação à temperatura constante, a solução foi centrifugada a 12.000 rpm por 10 min para remover CTAB adicional e liofilizada a vácuo em pó GNR para uso futuro.
Síntese de MUA-PEI e GAL-PEI-MUA
O ácido mercaptoundecanóico (MUA; 654 mg) foi dissolvido em 30 mL de clorofórmio (CHCl 3 ) e depois incubado com 100 mmol de cloridrato de 1-etil-3- [3-dimetilaminopropil] carbodiimida (EDC) e 100 mmol de N-hidroxissuccinimida (NHS) durante 15 min à temperatura ambiente. Em seguida, 100 mmol de polietilenoimina (PEI) foram adicionados à solução acima. Após 24 h de reação à temperatura ambiente, um volume igual de água desionizada foi usado para extrair o PEI-MUA solúvel em água. O mesmo método foi utilizado para completar a ativação da d-galactose em solução aquosa. Em seguida, um excesso de d-galactose ativada (500 mmol) foi adicionado à solução de PEI-MUA solúvel em água acima, e a reação foi suficientemente realizada à temperatura ambiente por 24 h para obter um GAL-PEI-MUA solúvel em água complexo.
Síntese de GAL-PEI-MUA-GNR (GAL-GNR) e PEI-MUA-GNR (PEI-GNR)
Pó de CTAB-GNR liofilizado (10 mg) foi suspenso em 10 mL de complexos PEI-MUA ou GAL-PEI-MUA solúveis em água. CTAB foi substituído por ligação Au – S quando agitado em temperatura ambiente por 24 h. A solução foi centrifugada a 12.000 rpm durante 15 min para remover o sobrenadante em excesso e o precipitado foi lavado três vezes com água destilada. Os pós de PEI-GNR ou GAL-GNR foram preparados por liofilização, pesados e dissolvidos em água não ribozimada e, em seguida, o efeito de ressonância plasmática foi observado por analisador de enzima multifuncional (Spectra Max M5e, MD, EUA).
Microscopia Eletrônica de Transmissão
O GNR ou GAL-GNR foi suspenso em água destilada, e a ressuspensão foi colocada em uma grade de cobre. Depois que as amostras na malha de cobre foram completamente secas ao ar por 30 min, a malha de cobre foi fotografada usando um microscópio eletrônico de transmissão (LIBRA 120, Carl Zeiss, Alemanha).
Análise ultravioleta-visível
O GNR, PEI-GNR ou GAL-GNR foi suspenso em água destilada. O efeito de ressonância plasmônica de superfície de nanomateriais na faixa de comprimento de onda de 600 a 900 nm foi examinado usando um leitor de microplacas multifuncional (SpectraMax M5e, MD, EUA).
Análise do Potencial Zeta e Diâmetro Hidrodinâmico
O GNR, PEI-GNR ou GAL-GNR foi suspenso em água destilada e, em seguida, o potencial zeta e o diâmetro hidrodinâmico do nanomaterial foram medidos em um Zetasizer Nano ZS.
Análise de Ressonância Magnética Nuclear
O pó liofilizado GAL-GNR foi dissolvido em água pesada (99%, Sigma) para fazer uma suspensão homogênea e a suspensão foi então transferida para um tubo de amostra de NMR. A composição de GAL-GNR foi determinada por ressonância magnética nuclear (NMR) (Bruker, 600mhz, Alemanha).
Ensaio de deslocamento de gel
GAL-GNR e siBRAF foram misturados de acordo com a proporção de massa (0:1, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1). Após incubação à temperatura ambiente durante 30 min, o tampão de carregamento de DNA foi adicionado à mistura. Todas as amostras foram adicionadas a gel de agarose a 2% contendo Goldview a 0,01% (Bioshop, EUA) e depois submetidas à eletroforese a 90 V por 30 min. O grau de envolvimento do siBRAF foi visualizado no sistema de imagem de gel.
Estabilidade de siRNA no soro
A mistura de GAL-GNR-siBRAF (6:1) foi incubada em soro murino fresco a 37 ° C por 0 h, 3 h, 6 h, 12 h, 24 h e 48 h, respectivamente. O grupo siBRAF nu mais soro murino fresco foram tratados nas mesmas condições. Um volume igual de 2% de dodecil sulfato de sódio (SDS) foi adicionado à solução GAL-GNR-siBRAF. Após incubação por 30 min à temperatura ambiente, tampão de carregamento de DNA foi adicionado, e todas as amostras foram carregadas em um gel de agarose a 2% (contendo Goldview a 0,02% (Bioshop, EUA)) e submetidas à eletroforese a 90 V por 30 min. O brilho da tira do siBRAF foi visualizado em um sistema de imagem em gel.
Ensaio de inibição competitiva de GAL-GNR-siBRAF
2 × 10 5 As células Hepa1-6 foram cultivadas em microplacas de 12 poços durante a noite. Em seguida, as células foram pré-tratadas com ácido lactobiônico por 12 h e, em seguida, transfectadas com GAL-GNR - siBRAF (marcado com Cy3) por 30 min. A intensidade da fluorescência intracelular foi determinada por microscópio de fluorescência (barra de escala =200 μm).
Capacidade de entrega de GAL-GNR-siBRAF direcionada ao câncer de fígado
Um micrograma de siBRAF cy3-etiquetado foi incubado com PEI-GNR (30 μg / mL), GAL-GNR (30 μg / mL) por 20 min em temperatura ambiente e, em seguida, adicionado à mídia de células Hepa1-6. Após incubação por 30 min, as células foram lavadas com FBS 50% por três vezes, e a intensidade de fluorescência nas células foi medida em um microscópio de fluorescência.
Efeitos fototérmicos
Vinte, 40, 60, 80 e 100 μg de GAL-GNR e 100 μg de GNR pó liofilizado foram completamente dissolvidos em 1 mL de água destilada. A solução foi adicionada a uma placa de 24 poços e continuamente irradiada com fonte de laser infravermelho próximo de 803 nm (2 W / cm 2 ) por 15 min. A temperatura de cada grupo foi registrada com um termômetro infravermelho a cada 0,5 min nos primeiros 5 min e, em seguida, a temperatura foi marcada a cada 1 min.
Ensaio MTT
Duzentos microlitros de células (3,5 × 10 4 / mL) foi cultivado em microplacas de 96 poços por 24 h e, em seguida, cultivado com diferentes concentrações de GNR ou GAL-GNR (0, 15, 30, 45, 60, 75, 90, 105, 120 μg / mL). Após 24 ou 48 horas de incubação, 20 μL de MTT foram adicionados ao sistema de cultura e incubados por mais 4 horas. Os cristais roxos foram dissolvidos em 150 μL de DMSO, seguido de análise espectrofotométrica a 490 nm usando uma referência de 650 nm em um leitor de microplaca (SpectraMax M5e, MD, EUA).
Teste de coloração com Calcein-AM e PI
Células Hepa1-6 (1,5 × 10 5 ) foram mantidos durante a noite em uma placa de 12 poços e tratados com PBS, laser, GAL-GNR-siBRAF (30 μg / mL:1 μg), GAL-GNR-siGL2 (30 μg / mL:1 μg) + laser ou GAL -GNR-siBRAF (30 μg / mL:1 μg) + laser por 4 h, e então irradiado por luz infravermelha próxima (808 nm, 2 W / cm 2 ) por 15 min. A citotoxicidade de GAL-GNR foi detectada por experimentos de coloração com calceína-AM (células vivas) e PI (células mortas). A fluorescência verde da calceína-AM e a fluorescência vermelha do PI foram fotografadas em microscopia de fluorescência.
PCR quantitativo em tempo real
O RNA celular total foi extraído usando Trizol (reagente Trizol, Invitrogen) e usado como molde para a síntese de cDNA. O Q-PCR foi conduzido usando primers forward e reverse gene-specific (0,5 μL × 10 μM cada) no sistema Stratagene Mx3000P qRT-PCR (Agilent Technologies, Lexington, MA, EUA). SYBR green PCR MasterMix (Life Technologies) foi usado de acordo com o esquema do fabricante. O gene doméstico β-actina foi usado como uma referência interna. As sequências do iniciador foram β-actina:5′AGGGAAATCGTGCGTGACATCAAA-3 ′ (direto) e 5′ACTCATCGTACTCCTGCTTGCTGA-3 ′ (reverso); BRAF:5′-CAATTGGCTGGGACACGGACAT-3 ′ (direto) e 5′-TTGACAACGGAAACCCTGGAAAAG-3 ′ (reverso). A diferença da expressão do gene foi calculada e exibida por 2 −∆∆Ct método.
Western Blot
As proteínas totais das células Hepa1-6 foram obtidas por tampão RIPA (Cell signaling, Pickering, Ontario, Canada) e quantificadas por ácido bicinconínico (BCA). A proteína foi separada em 12% SDS-PAGE e transferida para fluoreto de polivinilideno (PVDF). O gene housekeeping β-actina foi usado como uma referência interna para detectar a expressão da proteína BRAF. A banda da proteína e a referência interna da proteína alvo foram detectadas por quimioluminescência ECL.
Teste Scratch
O Hepa1-6 transfectado (1,7 × 10 5 / mL) as células foram semeadas em placas de 12 poços durante a noite. As células que aderiram completamente à placa foram riscadas com uma ponta de pipeta de 10 μL. As células foram lavadas duas vezes com PBS e substituídas por meio contendo 2% de FBS. A média da linha da ferida foi observada ao microscópio após 0, 24 e 48 h. Cada teste de raspagem foi realizado em triplicado.
Ensaio Transwell para migração e invasão
Câmaras transwell de oito micrômetros (Corning Life Science) foram usadas para avaliar a migração e invasão celular. Hepa1-6 suspenso em 200 μL de meio sem soro foi adicionado às câmaras superiores a uma densidade de 1,7 × 10 5 mL de células / poço e, em seguida, 500 μL de meio contendo 12% de FBS foram adicionados à câmara inferior. Após incubação por 24-48 h, as células foram fixadas com solução de paraformaldeído a 4% por 30 min e, em seguida, as células foram coradas com solução de violeta cristal a 1% por 30 min. Por fim, as células foram fotografadas e contadas em microscópio invertido. Para o ensaio de invasão celular, os experimentos de invasão celular requerem revestimento de gel ECM e as etapas restantes são consistentes.
Estatísticas
Todas as experiências foram realizadas em triplicado. Os dados foram expressos como média ± DP e t de Student teste (bicaudal) para determinar a diferença entre os dois métodos. Um teste ANOVA de uma via foi usado para comparação de vários grupos. Os dados foram considerados estatisticamente significativos em p <0,05 (* p <0,05, ** p <0,01, *** p <0,001).
Resultados
Síntese e Caracterização do Nanocarrier GAL-GNR-siBRAF
Projetamos um novo nanocarreador GAL-GNR que é capaz de entregar pequenos RNAs de interferência (siRNA) às células do fígado e manter o efeito fototérmico dos nanobastões de ouro simultaneamente. O procedimento de síntese de GAL-GNR é mostrado no Esquema 1. Este sistema direcionado ao fígado contém três componentes funcionais. Em primeiro lugar, a parte básica do GAL-GNR é um esqueleto GNR, que tem cerca de 30 nm de comprimento e 10 nm de diâmetro, como mostrado na imagem TEM (Fig. 1a) e GNR quimicamente conjugado (GAL-GNR) não mostrou significância mudança dimensional e ainda possuía boa dispersibilidade (Fig. 1b). Os dados do tamanho de partícula mostraram que o tamanho médio do GNR foi 30,23 nm, o que foi consistente com os resultados da microscopia eletrônica, e o tamanho do GAL-GNR (50 nm) e PEI-GNR (42,35 nm) foi maior do que o GNR desde a conjugação de GAL e PEI aumentou a hidratação entre as partículas (Fig. 1c). Em segundo lugar, o CTAB biologicamente tóxico na superfície do GNR foi substituído por MUA-PEI carregado positivamente que pode ser carregado com siRNA carregado negativamente. A medição do potencial zeta mostrou que a carga superficial de GNR aumentou de 35,6 para 42,7 mV ou 41,8 mV quando o GNR foi modificado com PEI ou GAL-PEI respectivamente, indicando que GAL-GNR possuía forte capacidade de ligar siRNA (Fig. 1d). Em terceiro lugar, aplicamos GAL como uma molécula guia para conjugar nanocarreadores GNR, que podem ser usados para homing específico de carcinoma hepatocelular. A espectroscopia de absorção de UV-Vis foi usada para detectar a estrutura do GNR modificado preliminarmente. O comprimento de onda do espectro de absorção inicial de GNR não modificado era de 763 nm; um deslocamento de 7 nm no comprimento de onda foi observado inicialmente com a modificação MUA-PEI, e outro deslocamento de 8 nm foi observado no final da síntese, quando a modificação de GNR com GAL foi bem-sucedida (Fig. 1e). A fim de confirmar GAL no nano-sistema, imagem de NMR foi usada para analisar os grupos químicos. Os resultados mostraram que o sinal H da galactose foi encontrado apenas no espectro GAL-GNR no espectro de hidrogênio NMR, que era δ:3,60, 3,65, 3,70, 3,78, 3,90, 4,53. Os espectros de NMR confirmaram a estrutura química do GAL, no qual o GAL foi conjugado com sucesso à superfície GNR (Fig. 1f).
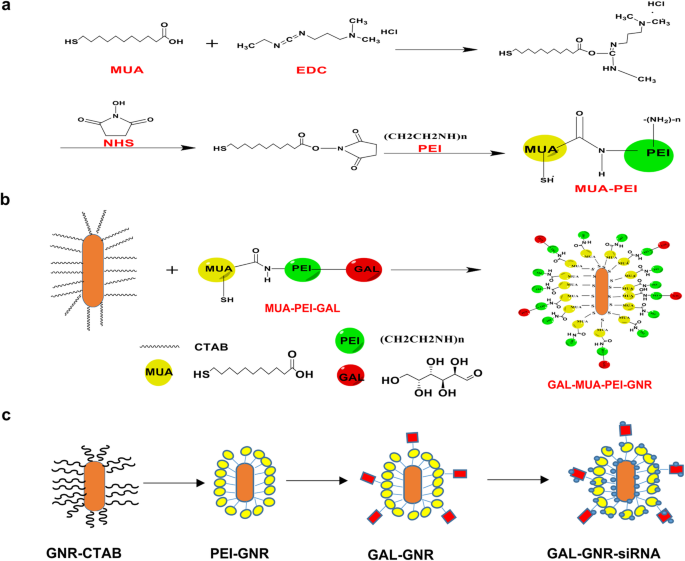
Procedimento sintético GAL-GNR. a O processo sintético de MUA-PEI. b Ativação de d-galactose e reação química com MUA-PEI. c O produto sintético final de GAL-GNR
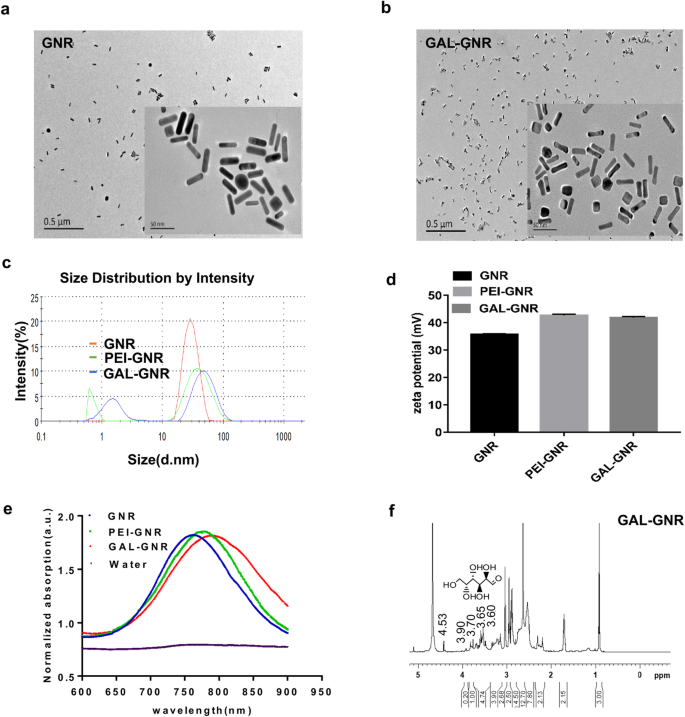
Caracterização de GNR e GAL-GNR. a Micrografia TEM de GNR (escala =0,5 μm / 50 nm). b Micrografia TEM de GAL-GNR (escala =0,5 μm / 50 nm). c Análise do tamanho de partícula de diferentes GNR modificados. d Análise do potencial Zeta de diferentes GNR modificados (GAL-GNR). e Espectros de absorção de UV-Vis normalizados de diferentes GNR modificados e água. f Espectro de absorbância de NMR de GAL-GNR
Capacidade de encapsulamento de siRNA e estabilidade de GAL-GNR
O nano-esqueleto GAL-GNR foi modificado por PEI carregado positivamente, que pode ser combinado com siRNA carregado negativamente por meio de interação eletrostática. Usamos o ensaio de deslocamento de gel para avaliar a capacidade de ligação de siRNA de GAL-GNR. O siRNA livre pode se mover ao longo da passagem do gel enquanto o siRNA ligado é desacelerado ou totalmente parado. Além disso, o siRNA ligado não se ligará mais efetivamente ao brometo e, portanto, a intensidade da fluorescência diminuirá em conformidade. O resultado da eletroforese em gel mostrou que a proporção ideal para saturar GAL-GNR com siBRAF é 6:1 (p / p) (Fig. 2a).
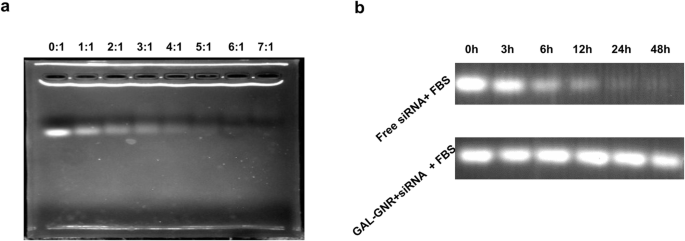
Ensaios de deslocamento de gel. a capacidade de carregamento de siRNA de GAL-GNR. Um micrograma de siRNA foi misturado em volumes iguais com diferentes proporções de massa de GAL-GNR. Após incubação por 30 min, um ensaio de migração de gel foi usado para avaliar a capacidade de carregamento de siRNA de GAL-GNR. b Estabilidade de siRNA em soro de camundongo. Um micrograma de siRNA de BARF foi inoculado com GAL-GNR na proporção de massa de 1:6 e foi subsequentemente adicionado a soro murino fresco. Após a reação de 0, 3, 6, 12, 24 e 48 h a 37 ° C, o siRNA de GAL-GNR-siBARF foi extraído por SDS a 2% e foi visualizado com Brometo de Etídio
O siRNA nu é muito degradável, especialmente in vivo. Uma função importante do sistema de entrega é proteger o siRNA da degradação. Assim, testamos o efeito protetor do nanocarreador GAL-GNR sobre o siRNA em soro fresco, conseqüentemente. Comparado com o siRNA nu, o siRNA ligado foi armazenado no soro por períodos de tempo mais longos. Como mostrado na Fig. 2b, siRNA nu poderia existir no soro por até 12 h, enquanto o siRNA ligado ainda era abundante após 48 h. O resultado demonstrou que GAL-GNR pode prevenir eficazmente o siRNA de ser degradado no soro, garantindo a entrega direcionada in vivo.
Citotoxicidade de nanomateriais
A baixa toxicidade biológica é outra propriedade importante dos nanomateriais, que permite sua utilização no tratamento do câncer. Para avaliar a biocompatibilidade desta nova nanoestrutura de GAL-GNR, testamos sua citotoxicidade. Conforme mostrado na Fig. 3, as células mortas de Hepa1-6 no grupo tratado com GNR não modificado foram observadas inicialmente em uma concentração baixa de 30 μg / mL. Após incubação com 75 μg / mL de GNR por 24 h, a taxa de morte celular foi de 56,09%, e a mortalidade aumentou para 75,5% após incubação por 48 h. Pelo contrário, a modificação GAL reduziu significativamente a citotoxicidade. Após incubar GAL-GNR por 48 h, mais de 80% das células ainda estavam vivas, mesmo em alta concentração (105 μg / mL). Esses dados sugeriram que o nanocarreador GAL-GNR apresentou alta biocompatibilidade em relação ao GNR, garantindo segurança de aplicação.
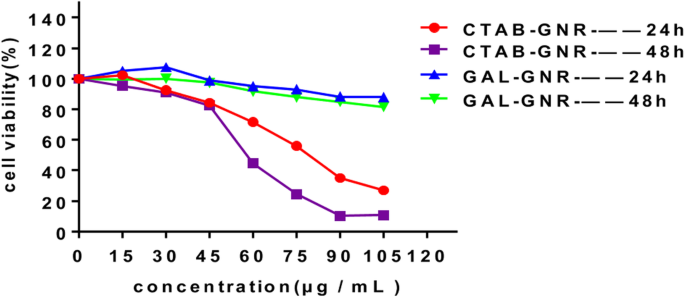
Toxicidade de GAL-GNR. As células Hepa1-6 foram tratadas com GNR (CTAB-GNR) ou GAL-GNR por 24 ou 48 h nas concentrações indicadas. A viabilidade celular foi medida pelo ensaio MTT ( n =5)
Entrega de siRNA direcionada a células de hepatoma e silenciamento de genes de BRAF in vitro
A capacidade de entregar siRNA em células cancerosas é uma das funções mais importantes dos nanomateriais. Para investigar o potencial de GAL-GNR na entrega de siRNA, detectamos a eficácia do silenciamento de genes usando siBRAF carregado por GAL-GNR em células Hepa1-6. Em comparação com o grupo em branco, a expressão de BRAF em células transfectadas GAL-GNR-siGL2 (controle negativo) não tem alteração, enquanto as células transfectadas com GAL-GNR-siBRAF tiveram uma diminuição significativa (Fig. 4a). Além disso, o efeito silenciador foi dose-dependente, o que se correlacionou com o aumento da concentração de GAL-GNR. Os resultados de qPCR demonstraram que a concentração transfectada ideal de GAL-GNR-siBRAF foi de 30 μg / mL, e a eficiência de silenciamento pode chegar a 90,29% que foi semelhante ao grupo da lipofectamina 2000 (controle positivo). O resultado do western blot foi consistente com qPCR, e a expressão da proteína de BRAF foi regulada para baixo após 48 h de transfecção (Fig. 4b).
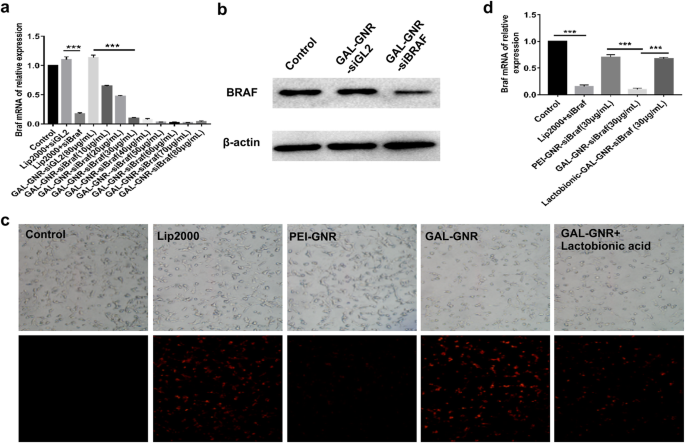
Entrega de siRNA direcionada a células de hepatoma e silenciamento de gene de BRAF in vitro. a O mRNA da expressão de BRAF após transfecção com GAL-GNR-siBRAF. As células Hepa1-6 foram transfectadas com várias concentrações de GA-GNR carregando a mesma quantidade de siRNA de BRAF (1 μg) por 24 h. A expressão do mRNA BRAF foi determinada por qPCR. A barra de erro representa o desvio padrão de três experimentos (*** p <0,001). b A expressão da proteína de BRAF em Hepa1-6 após transfecção com GAL-GNR-siBRAF. As células Hepa1-6 foram transfectadas com GAL-GNR-siBRAF, GAL-GNR-siGL2 ou PBS durante 48 h, os níveis de BRAF e β-actina foram determinados por Western blot. c e d Capacidade de entrega direcionada ao câncer de fígado de GAL-GNR-siBRAF. Um micrograma de siBRAF cy3-etiquetado foi incubado com lip2000, PEI-GNR (30 μg / mL), GAL-GNR (30 μg / mL) por 20 min em temperatura ambiente e, em seguida, adicionado à mídia de células Hepa1-6. Para o ensaio de inibição competitiva, as células Hepa1-6 foram pré-tratadas com ácido lactobiônico durante a noite. A intensidade de fluorescência intracelular foi observada sob o microscópio de fluorescência (barra de escala =200 μm), e as expressões de mRNA de BRAF foram quantificadas por q-PCR. A barra de erro representa o desvio padrão de três experimentos (* p <0,05)
O ácido lactobiônico é semelhante ao GAL na estrutura, que pode ser combinada competitivamente com o receptor de asialoglicoproteína (ASGPR), que é expresso na superfície da membrana celular do carcinoma hepatocelular [35]. Para confirmar a eficiência de direcionamento específico de GAL-GNR, células Hepa1-6 foram pré-incubadas com ácido lactobiônico e, em seguida, transfectadas com GAL-GNR-siBRAF. As células não tratadas foram usadas como controle em branco, e o reagente de transfecção clássico lipofectamina 2000 foi usado como controle positivo. Como mostrado na Fig. 4c, a intensidade de fluorescência vermelha de células transfectadas com GAL-GNR foi semelhante ao grupo de controle positivo, enquanto a intensidade de fluorescência de células transfectadas com PEI-GNR é significativamente reduzida. Por outro lado, as células transfectadas com GAL-GNR-siBRAF sozinho foram observadas fluorescência vermelha mais forte de Cy3 do que células Hepa1-6 pré-tratadas com ácido lactobiônico (Fig. 4c), e o resultado de qPCR foi consistente com os resultados de fluorescência vermelha ( Fig. 4d). Estes resultados ilustraram ainda que GAL promoveu efetivamente a endocitose de siRNA por células Hepa1-6 e pode ser aplicado como porção direcionada de HCC.
O impacto de GAL-GNR-siBRAF na proliferação, migração e invasão de células Hepa1-6
BRAF desempenha um papel importante na via MAPK, que é responsável por regular a proliferação, migração e invasão celular [36]. Para avaliar o impacto de GAL-GNR-siBRAF em células de carcinoma hepatocelular, analisamos a proliferação celular por ensaios de MTT primeiro. Como mostrado na Fig. 5a, a proliferação de células hepa1-6 transfectadas com GAL-GNR-siBRAF foi significativamente diminuída em comparação com GAL-GNR-siGL2 (controle negativo) ou células tratadas com PBS. Em seguida, investigamos o efeito de GAL-GNR-siBRAF na migração celular por ensaios de scratch e transwell. Em comparação com as células de controle negativo, a capacidade de migração das células Hepa1-6 que transfectaram com GAL-GNR-siBRAF foi evidentemente reduzida (Fig. 5b-d).
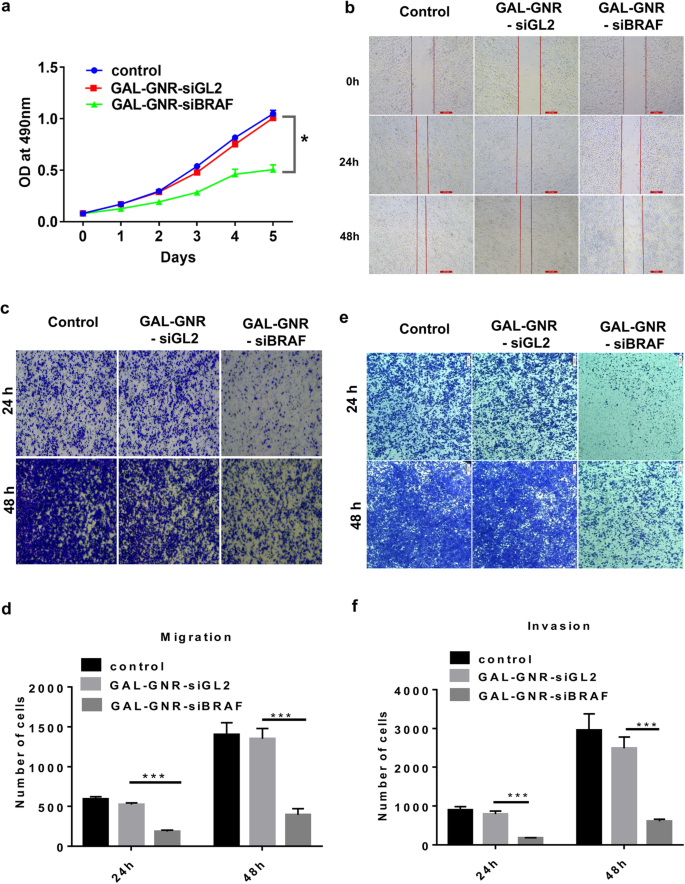
The impact of silencing BRAF gene on Hepa1-6 cells by GAL-GNR-siBRAF. a Proliferation of Hepa1-6 Cells. Hepa1-6 cells were transfected with GAL-GNR-siBRAF, GAL-GNR-siGL2, or PBS, and the cell proliferation was measured by MTT assay (n =5). The error bar represents the standard deviation of three experiments (*p <0,05). b Scratch test of Hepa1-6 cells. Hepa1-6 cells were transfected for 24 h as described above and then scraped with a 10 μL tip. The cell scratch images were taken at different time points (scale bar =200 μm). c e e Migration and invasion of Hepa1-6 cells. Hepa1-6 cells were transfected for 24 h as described above. Cell migration and invasion ability was determined by transwell assay, and imagines were taken at different time points (scale bar =200 μm). d e f Columnar statistical analysis of cell migration and invasive capacity (***p <0.001)
To further investigate the potential of GAL-GNR-siBRAF on the invasion, transwell assays were performed. The results showed that hepa1-6 cells transfected with GAL-GNR-siBRAF haven significantly decreased the invasion of Hepal-6, as compared with GAL-GNR-siGL2 or PBS (Fig. 5e and f). The above results implied that knockdown of BRAF gene using GAL-GNR-siBRAF complexes can effectively reduce migration and invasion of hepatocellular carcinoma cells.
Combination Treatment with Photothermal Effect and Gene Silencing of GAL-GNR-siBRAF
Our previous studies have demonstrated that gold nanomaterials can generate thermal energy under near infrared radiation [37]; this phenomenon is called photothermal effect due to LSPR properties of the GNR. Our results showed that, with the increase of GAL-GNR concentration, the heat production capacity of GAL-GNR was enhanced. When the concentration of GAL-GNR is 100 μg/mL, the temperature quickly rises from 24 to over 60 °C. In addition, there was no significant difference in heat production capacity between GNR and GAL-GNR (Fig. 6a).
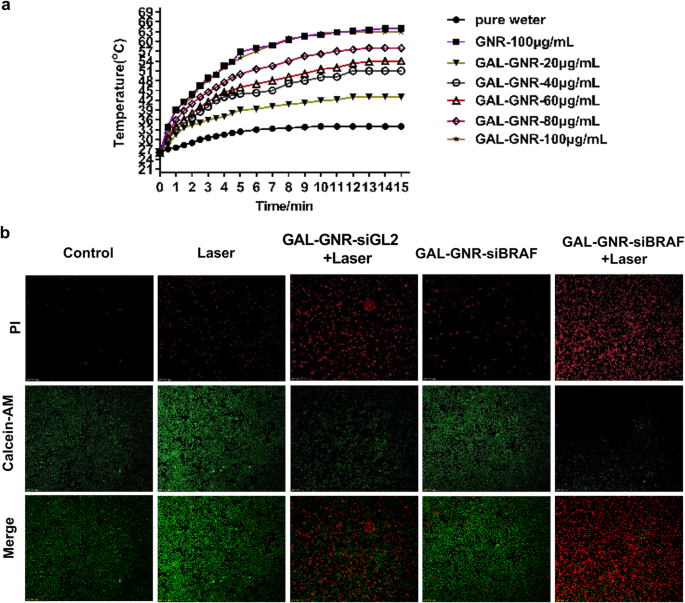
Photothermal effect induced by GAL-GNR and combination treatment of photothermal effect and gene silencing on liver cancer cells. a 803 nm near-infrared laser source (2 W/cm 2 ) was used to irradiate the solution of GNR, GAL-GNR, or distilled water (blank control) for 15 min. The temperature was detected by infrared thermometer at different time point. b Hepa1-6 cells were treated with PBS, laser, GAL-GNR-siBRAF, GAL-GNR-siGL2 + Laser, or GAL-GNR-siBRAF + Laser, respectively. Green fluorescence of calcein AM (live cells) and red fluorescence of PI (dead cells) were observed under fluorescence microscope
The novel nano-system GAL-GNR-siBRAF possesses three individual characteristics:specific targeting of liver cancer, siRNA-based gene silencing of BRAF, and GNR-offered photothermal effects. Thus, we further study the synergistic therapeutic effect of GAL-GNR-siBRAF in anti-tumor treatment. Hepa1-6 cells without GAL-GNR kept higher viability even under near infrared radiation, suggesting laser itself had no significant effect on tumor cells. Once the laser irradiation was carried out on the basis of GAL-GNR-siGL2 treatment, the photothermal effect showed powerful killing ability on Hepa1-6 cells. Although BRAF gene silencing alone induced cell death, the effect was not conclusive. The treatment of cells with the nano-material GAL-GNR-siGL2 plus laser irradiation resulted in much stronger cell-killing ability than BRAF gene silencing individual (Fig. 6b). These data indicates that the BRAF gene silencing and photothermal effect can synergistically increase the potential of killing tumor cells.
Discussion
Difficulties in tumor-targeted delivery are major obstacles in the clinical treatment of tumors. This study demonstrated for the first time that we have developed a novel multifunctional nanocarrier GAL-GNR-siBRAF, and it was provided with many advantages. The modified GAL-GNR not only possessed good biocompatibility but also maintained the LSPR phenomena of GNR skeleton and still has excellent photothermal conversion ability. GNR modified with GAL can home hepatocellular carcinoma cells through ASGPR, which has great potential in targeted molecular therapy of hepatocellular carcinoma. Further studies showed that BRAF gene silencing inhibited the proliferation, migration, and invasion of hepatoma cells. It is worth noting that GAL-GNR-siBRAF shows a stronger cell killing ability in the combination of photothermal effect and gene silencing of BRAF.
RNA interference (RNAi) has attracted much attention due to its crucial role in gene expression and regulation. Using siRNA to knock down sequence-specific genes in cancer cells for gene therapy is an effective and specific targeted gene therapy, and which has become a new therapeutic tool for many diseases including cancer [29, 31]. However, low stability in serum and poor cell uptake limit siRNA in clinical application [38]. On the other hand, siRNA possess negative charge that prevents it from binding negatively charged cell membranes, and siRNA itself is unlikely to be delivered directly into cells [32, 39]. In addition, there are problems associated with low transfection efficiency and poor cell internalization in siRNA therapy [40]. These barriers impede the delivery of siRNA to target cells. To enhance siRNA stability and to strengthen gene silencing efficacy, we synthesized a novel nanocarrier, GAL-GNR-siBRAF, which includes three components (Scheme 1). This nanocarrier has low molecular size (about 30-nm longitude and 10-nm diameter) and good dispersibility (Fig. 1). Additionally, GAL-GNR-siBRAF could effectively load large amount of siRNA at low concentration (Fig. 2a) and protect siRNA degradation from RNase in serum; the siRNA was evidenced by stability for at least two days at 37 °C in the presence of fresh murine serum (Fig. 2b).
Good biocompatibility is essential for nanomaterials used in the field of biotherapy. CTAB is an essential active reagent in the synthesis of gold nanorods although it has apparent cytotoxicity that limits its biological application [41]. In order to reduce the cytotoxicity of the material, we manipulated the GNR by external modification of positive charge PEI and targeting adaptor GAL (d-galactose). Our results showed that, compared with unfunctionalized GNR, GAL-modified GNR has a better biocompatibility. The cell viabilities maintained over 80% even at very high concentrations (105 μg/mL) of GAL-GNR for 48 h (Fig. 3). In addition, the small molecular size and cylindrical shape of the nanorod facilitate its penetration through the cell membrane into the cell [37, 38, 42]. This phenomenon is particularly evident in targeted therapy of cancer cells. Nano-construct modified with the galactose-targeting moieties resulted in high accumulation of GAL-GNR-siBRAF in tumor cells, inducing effective downregulation of BRAF gene expression (Fig. 4). Moreover, according to the competitive inhibition experiments, we found that GAL-GNR entered cells mainly through ASGPR surface receptors of Hepa1-6 cells (Fig. 4c).
It was reported that HCC with high expression of BRAF and RAF1 tends to have rapid proliferation and growth [41, 43, 44]. B-Raf and Raf1 mainly act on the downstream of ERK/MAPK pathway, regulating nuclear factors through cascade amplification. Activation of this pathway accelerates the proliferation and differentiation of HCC cells abnormally [41, 44, 45]. RAF gene can also promote the expression of matrix metalloproteinases (MMPs), which can change the adhesion of tumor cells, degrade extracellular matrix (ECM) and basement membrane, and promote the invasion and metastasis of tumors [44, 45]. BRAF kinase regulates the RAS-RAF-MEK-ERK pathway, which promotes tumor cell proliferation, invasion and metastasis, and allows cell death through apoptosis [5, 46, 47]. In previous work, we found that BRAF gene was highly expressed in Hepa1-6 cells (data were not shown). It is speculated that the knock down of BRAF expression in Hepa1-6 will block the RAS-RAF-MEK-ERK pathway and lead biological changes of Hepa1-6. To verify our hypothesis, we transfected hepatocellular carcinoma cells with GAL-GNR-siBRAF and found that it can restrain the cell proliferation, migration, and invasion significantly (Fig. 5), providing a new strategy for clinical treatment of hepatocellular carcinoma.
Another important advantage of GNR is that it possesses local surface plasmon resonance (LSPR), which can convert absorbed light energy into heat energy under near infrared light irradiation, thereby killing and destroying cells [42]. Then, we explored the light-to-heat conversion ability of GAL-GNR, and the results showed that the modified GAL-GNR can induce heat energy effectively under the irradiation of near infrared light (Fig. 6a). Next, we further investigated the synergistic effects of GAL-GNR-siBRAF. Whereas BRAF gene silencing showed limited cytotoxicity, the treatment of GAL-GNR-siGL2 + laser had a much stronger killing ability on tumor cells. At the same time, the combination of photothermal hyperthermia and BRAF gene silencing could cause more than 85% cell death (Fig. 6b) which indicates that the synergy of GAL-GNR-siBRAF and photothermal effects could be an ideal strategy to inhibit liver cancer.
Conclusion
This study showed that GAL-GNR-siBRAF overcome the obstacle of siRNA degradation, effectively increased the stability of siRNA in serum in vitro. In addition, GAL-GNR-siBRAF can target deliver siRNA to hepatocellular carcinoma cells and knockdown the expression of BRAF and inhibit the cell proliferation, invasion, and migration significantly. More importantly, GAL-GNR-siBRAF, as a new multifunctional nanocarrier, can greatly enhance the ability of killing tumor cells when combined with near-infrared light. In conclusion, GAL-GNR-siBRAF has great potential in treatment of hepatocellular carcinoma and provides new ideas for clinical application of liver cancer.
Disponibilidade de dados e materiais
All data generated and materials used in this study are included in the manuscript and corresponding additional files.
Abreviações
- GAL:
-
d-galactose
- GNR:
-
Golden nanorods
- siBRAF:
-
Small interfering RNA specific for BRAF
- HCC:
-
Carcinoma hepatocelular
- ASGPR:
-
Asialoglycoprotein receptor
- TACE:
-
Transcatheter arterial chemoembolization
- LSPR:
-
Ressonância de plasmon de superfície localizada
- CTAB:
-
cetyltrimethylammonium bromide
- MUA:
-
Mercaptoundecanoic acid
- EDC:
-
1-ethyl-3-[3-dimethylaminopropyl] carbodiimide hydrochloride
- NHS:
-
N-hydroxysuccinimide
- PEI:
-
Polyethyleneimine
- TEM:
-
Microscopia eletrônica de transmissão
- NMR:
-
Ressonância magnética nuclear
- FBS:
-
Soro fetal bovino
- DMSO:
-
Dimethyl Sulfoxide
- BCA:
-
Bicinchoninic acid
- PVDF:
-
Fluoreto de polivinilideno
Nanomateriais
- Preparação de nanopartículas de mPEG-ICA carregadas com ICA e sua aplicação no tratamento de dano celular H9c2 induzido por LPS
- Nanopartículas lipídicas de PLGA rastreadas com 131I como transportadores de administração de drogas para o tratamento quimioterápico direcionado do melanoma
- Um novo método sem solvente orgânico para nanofármaco direcionado para eficácia anticâncer aprimorada
- Efeito do tratamento de recozimento in situ na mobilidade e morfologia de transistores de efeito de campo orgânico baseados em TIPS-Pentaceno
- Efeito do eletrodo ITO pulverizado em ângulo oblíquo nas estruturas de células solares de MAPbI3 perovskita
- Promoção do crescimento celular SH-SY5Y por nanopartículas de ouro modificadas com 6-mercaptopurina e um peptídeo penetrador de neurônio
- Toxicidade de nanopartículas de CoFe2O4 revestidas com PEG com efeito de tratamento da curcumina
- Crescimento direto de diodo emissor de luz amarela à base de nitreto III-nanowire em quartzo amorfo usando camada intermediária de Ti fino
- Nanopartículas de ouro de formato redondo:efeito do tamanho da partícula e da concentração no crescimento da raiz de Arabidopsis thaliana
- Absorção de luz efetiva usando grades de pirâmide dupla-face para célula solar de silício de filme fino



