Heterojunção 2D / 2D do esquema R Ti3C2 MXene / MoS2 Nanofolhas para desempenho fotocatalítico aprimorado
Resumo
A combinação de materiais bidimensionais (2D) e semicondutores é considerada uma forma eficaz de fabricar fotocatalisadores para resolver a poluição ambiental e a crise energética. Neste trabalho, a nova heterojunção 2D / 2D do esquema R Ti 3 C 2 MXene / MoS 2 nanofolhas são sintetizadas com sucesso por reação hidrotérmica. A atividade fotocatalítica do Ti 3 C 2 MXene / MoS 2 compósitos é avaliado por degradação fotocatalítica e reação de evolução de hidrogênio. Especialmente, 0,5% em peso de Ti 3 C 2 MXene / MoS 2 amostra exibe degradação ideal de laranja de metila (MO) e H 2 taxa de evolução de 97,4% e H 2 taxa de evolução de 380,2 μmol h −1 g −1 , respectivamente, que é atribuído à capacidade de absorção óptica aprimorada e área de superfície específica aumentada. Além disso, Ti 3 C 2 MXene acoplado com MoS 2 nanofolhas é favorável para melhorar a resposta da fotocorrente e reduzir a impedância eletroquímica, levando à transferência de elétrons aprimorada do semicondutor excitado e inibição da recombinação de carga. Este trabalho demonstra que Ti 3 C 2 MXene pode ser um portador promissor para construir heterojunção 2D / 2D na degradação fotocatalítica e na reação de evolução de hidrogênio.
Introdução
Nos últimos anos, a Ciência e Tecnologia Industrial vem se desenvolvendo de forma significativa, enquanto os problemas ambientais e a crise energética têm se agravado [1,2,3,4]. Aplicação significativa de óxido de titânio (TiO 2 ) para divisão de água foi relatado desde 1972 [5]. Os pesquisadores têm trabalhado para estender a resposta do TiO 2 à base de compósitos para a região da luz visível e explorar o semicondutor de bandgaps estreitos para lidar melhor com a poluição ambiental e a crise energética [6,7,8,9,10,11,12].
Os catalisadores semicondutores de sulfeto de metal têm sido considerados como transportadores essenciais para resolver a poluição ambiental e as crises de energia devido aos estreitos bandgaps, baixa toxicidade e excelente capacidade catalítica [13, 14]. O intervalo de banda relativamente estreito (Eg =1,8 eV), propriedades ópticas exclusivas e estrutura em camadas de MoS 2 nanofolhas têm atraído cada vez mais atenção [15,16,17,18]. MoS 2 foi acoplado a vários materiais e semicondutores bidimensionais (2D), como TiO 2 [19], óxido de grafeno (GO) [20], g-C 3 N 4 [21], SnO 2 [12], Bi 2 WO 6 [22], Bi 2 O 2 CO 3 [23], e CdS [24], a fim de melhorar a eficiência da degradação fotocatalítica e produção de hidrogênio. Foi provado que a maior concentração de poluentes orgânicos de laranja de metila (MO) (30 mg / L) pode ser degradada em 60 min sob a irradiação de luz visível por MoS 2 / Nanocompósitos CdS [24].
Desde o relatório inicial em 2011, MXenes, como um membro da família de materiais bidimensionais, tem atraído ampla atenção de pesquisadores [25,26,27]. MXenes podem ser preparados a partir da fase MAX por ataque ácido a camada A com HF ou HCl / LiF, que possui excelentes propriedades eletroquímicas, estabilidade química e numerosas funcionalidades hidrofílicas na superfície (-OH / -O) [28,29,30] . O Ti 3 mais popular C 2 MXene pode ser obtido esfoliando Ti 3 AlC 2 com ácido forte [31]. Sua excelente condutividade e estrutura bidimensional em camadas foram consideradas como materiais de armazenamento de energia para baterias de íons de sódio (SIBs) e capacitores eletroquímicos [31,32,33,34].
Ti 3 C 2 MXene com grupos de superfície oxidada rica favorece a heterojunção formada entre MXene e semicondutores [35,36,37,38]. A heterojunção ajuda a estabelecer um forte contato de interface entre o fotocatalisador e o cocatalisador. Devido ao forte efeito de acoplamento físico e eletrônico, o contato da interface pode aumentar muito a transferência e separação de portadoras foto-induzidas na interface de heterojunção, que é o fator chave para melhorar o desempenho fotocatalítico [39,40,41].
Por exemplo, TiO 2 / Ti 3 C 2 e Ti 3 C 2 / Bi 2 WO 6 os compósitos exibiram CO fotocatalítico excelente 2 atividade de redução, que é atribuída à separação de portadores de carga altamente eficiente e locais de ativação ricos [42, 43]. O desempenho de produção de hidrogênio do g-C 3 N 4 / Ti 3 C 2 o fotocatalisador melhorou significativamente, o que é atribuído à condutividade elétrica superior e transferência de carga altamente eficiente [44]. TiO 2 / Ti 3 C 2 e α-Fe 2 O 3 / Ti 3 C 2 híbridos são provados para promover a eficiência de degradação fotocatalítica de poluentes orgânicos sob luz ultravioleta e luz visível através da construção de heterojunções [45,46,47].
Aqui, heterojunção 2D / 2D do esquema R Ti 3 C 2 MXene / MoS 2 os fotocatalisadores são sintetizados por método hidrotérmico. Atividades fotocatalíticas de Ti 3 C 2 MXene / MoS 2 compósitos são avaliados por degradação fotocatalítica de MO e reação de evolução de hidrogênio (HER) sob irradiação de luz visível. O desempenho fotocatalítico reflete que MoS 2 acoplado com Ti 3 C 2 MXene apresenta maior capacidade de degradação e H 2 taxa de produção do que MoS puro 2 sob a mesma condição. A área de superfície específica ampliada e a capacidade de absorção óptica aprimorada podem ser atribuídas à morfologia do MoS 2 nanofolhas mudam de agachamento para alongamento, o que é induzido por Ti 3 C 2 MXene. Acima de tudo, a forte interação entre MoS 2 e Ti 3 C 2 MXene é benéfico para construir heterojunção 2D / 2D, o que efetivamente promove a separação e transferência de fotoelétrons de vacâncias, aumentando assim a atividade fotocatalítica significativamente.
Método / Seção Experimental
Preparação de fotocatalisadores
Matérias-primas
Ti 3 AlC 2 Pós MAX (> 98% em peso de pureza), ácido fluorídrico, molibdato de amônio ((NH 4 ) 6 Mo 7 O 24 • 4H 2 O), tioureia ((NH 2 ) 2 CS) e laranja de metileno são adquiridos por Shanghai Yuehuan Co., Ltd. (Shanghai, China) e Guoyao Chemical Co., Ltd. (China), respectivamente.
Síntese de Ti 3 C 2 Nanofolhas
Ti 3 AlC 2 pó preto é gravado em soluções de HF 49% à temperatura ambiente por meio de agitação por 26 h para remover a camada de Al. O pó descartado é lavado com água desionizada por centrifugação 7 ~ 8 vezes até que o pH atinja 7. A suspensão de Ti 3 C 2 é sonicado por 6 he então centrifugado por 20 min a 10.000 rpm [48]. Finalmente, a solução é seca para obter o produto final Ti 3 C 2 Nanofolhas MXene.
Preparação hidrotérmica de Ti 3 C 2 MXene / MoS 2 (Denotado como TM) Compostos
Em primeiro lugar, 1,1 g de molibdato de amônio ((NH 4 ) 6 Mo 7 O 24 • 4H 2 O) e 2,2 g de tioureia ((NH 2 ) 2 CS) são dissolvidos em água desionizada sob agitação vigorosa por 60 min para formar uma solução homogênea, que é rotulada como solução A. Em seguida, uma quantidade de Ti 3 C 2 nanofolhas são adicionadas a 20 ml de água desionizada (DI), agitando por 30 min, seguido por ultrassom adicional por 40 min, que é rotulado como solução B. Em seguida, B é misturado em A gota a gota sob ultrassonicação por 30 min. A solução misturada é transferida para uma autoclave revestida com Teflon de 100 mL e mantida a 180 ° C por 7 h. Após resfriamento à temperatura ambiente, os catalisadores pretos obtidos são lavados com água DI por três vezes para remover o agente dispersante e, em seguida, secos a 70 ° C por 10 h em um forno a vácuo. Adicionando o Ti 3 C 2 solução, a razão de massa de Ti 3 C 2 MXene para MoS 2 é definido como 0, 0,1%, 0,3%, 0,5%, 1,0% e 2,0% em peso, respectivamente. As amostras preparadas são rotuladas como TM0, TM0.1, TM0.3, TM0.5, TM1 e TM2, respectivamente.
Degradação fotocatalítica de laranja de metileno
Todos os experimentos de degradação são realizados em um béquer de 100 mL com agitação constante. A laranja de metila é selecionada para avaliar a atividade fotocatalítica das amostras. O teste de degradação fotocatalítica de MO é realizado usando uma lâmpada de iodetos metálicos de 400 W. Em um experimento típico de degradação de MO, 50 mg de Ti 3 C 2 / MoS 2 a amostra é dispersa em 50 mL de solução aquosa de MO (20/30/50 mg / L). Em seguida, a solução com catalisadores é colocada no escuro por 60 min sob forte agitação magnética para estabelecer o equilíbrio de adsorção. As amostras são processadas por ultrassom por 1 min antes de acender a luz, o que torna o catalisador bem disperso na solução. Em certos intervalos de tempo, aproximadamente 3,5 mL de solução mista são extraídos com tratamento por centrifugação por 4 min a 8.000 rpm −1 para remover o pó de catalisador sólido. A mudança no comprimento de onda de 464 nm é determinada pela concentração da solução de MO, que é medida usando um espectrofotômetro UV-visível. A concentração inicial da solução de MO é rotulada como C 0 , e C t refere-se à concentração da solução de MO em um determinado momento, respectivamente. A eficiência de degradação da amostra é refletida pela absorbância relativa C t / C 0 .
Avaliação da produção de hidrogênio fotocatalítico
O fotocatalítico H 2 os testes de evolução são realizados em um frasco de quartzo de 50 mL à temperatura ambiente e pressão atmosférica. Cinco miligramas de amostra de TM são dispersos em 70 mL de solução aquosa contendo 0,35 M de Na 2 S e 0,25 M Na 2 SO 3 , e irradiado por uma lâmpada Xe de 300 W equipada com um filtro de corte de 420 nm. Antes da irradiação, gás (N 2 ) é passado continuamente por 35 min para remover o oxigênio. A produção de H 2 é detectado por cromatografia gasosa (Agilent 7890) equipada com detector TCD.
Caracterização da microestrutura
A análise de fase do Ti 3 C 2 / MoS 2 as amostras são operadas a 40 kV e 40 mA por difratômetro de raios-X (XRD, Cu Kα, Bruker D8 Advance, Alemanha). A micro-morfologia dos compósitos é observada por microscopia eletrônica de varredura por emissão de campo (FESEM, Zeiss Ultra Plus, Zeiss, Alemanha) juntamente com espectrometria de energia dispersiva (EDS). Microscopia eletrônica de transmissão de alta resolução (HRTEM, JEM-2100F, eletrônica japonesa, China) é usada para observar a morfologia e a interface de heterojunção entre MoS 2 e Ti 3 C 2 . Os espectros infravermelhos são registrados por espectroscopia de infravermelho com transformada de Fourier (FTIR, Nexus, Therno Nicolet, EUA) em uma faixa de 400 a 4000 cm −1 . As propriedades ópticas dos pós são realizadas por espectroscópio de refletância difusa UV-Vis (DRS, Lambda 750S, PerkinElmer, EUA) com uma esfera integrada. Os estados químicos dos catalisadores obtidos são estudados por espectroscopia de fotoelétrons de raios-X (XPS, ESCALAB 250Xi, Thermo Fisher Scientific, China).
Medições eletroquímicas
Os testes eletroquímicos são medidos por uma estação eletroquímica 1030 A CHI. Em um experimento típico, 5 mg de amostra TM e 110 μL de solução de Nafion 5% em peso são dispersos em 2,5 mL de 1:4 v / v de etanol e água com sonicação de 9 min para formar uma suspensão homogênea. Posteriormente, 5 μL da tinta são jogados na superfície do eletrodo de carbono vítreo (GCE). Os testes de espectroscopia de impedância eletroquímica (EIS) são realizados na mesma configuração em sobrepotencial n =200 mV de 0,1 a 105 kHz com uma tensão CA de 5 mV.
Resultados e discussão
Cristalino de Ti 3 AlC 2 e Ti 3 C 2 MXene é analisado no intervalo de 2 θ =5 - 70 °, conforme mostrado na Fig. S1. O notável pico de difração de Ti 3 AlC 2 localizado em 2 θ =39 ° desaparece e pico de Ti 3 C 2 MXene 2 θ =9,7 ° muda para ângulos mais baixos, sugerindo que Ti 3 AlC 2 transformou-se em Ti 3 C 2 com sucesso [42]. A Figura 1 revela padrões de XRD de amostras de TM com vários Ti 3 C 2 adições e os principais picos de difração da amostra TM0 foram indexados para MoS puro 2 com constantes de rede a = 3,16 e c = 12,294 Å (JCPDS no. 37-1492), respectivamente [15]. Depois de acoplado com Ti 3 C 2 , os principais picos de difração para (002), (100) e (103) planos de compostos TM exibem intensidade mais ampla e diminuída do que TM0, sugerindo que MoS 2 é suprimido por Ti 3 C 2 efeito limitador do crescimento [49]. Nenhum pico de difração óbvio de Ti 3 C 2 MXene pode ser detectado, o que é atribuído ao baixo Ti 3 C 2 carregamento com boa dispersão nos compósitos.
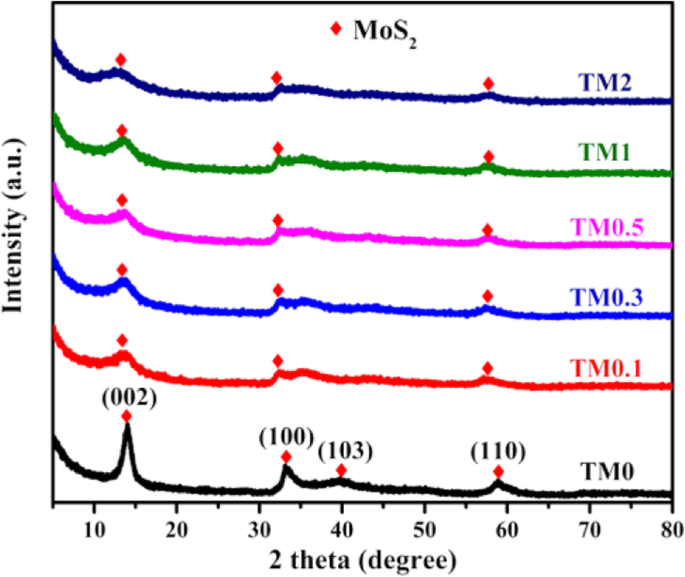
Padrões de XRD de compostos TM0, TM0.1, TM0.3, TM0.5, TM1 e TM2
Imagens morfológicas de Ti 3 C 2 / MoS 2 composto com vários Ti 3 C 2 as quantidades são observadas na Fig. 2. Ela mostra que todas as amostras revelam uma nanosfera semelhante a uma flor com buracos separados aleatoriamente na superfície. E a estrutura semelhante a uma flor dos compostos TM é composta de nanofolhas irregulares com espessura média de cerca de 15 nm.

Imagens FESEM de a TM0, b TM0.1, c TM0.3, d TM0.5, e TM1 e f TM2
A Figura 2a exibe a estrutura microscópica típica de TM0 com diâmetro de cerca de 200-400 nm. A Figura 2b-f fornece imagens FESEM de TM0.1, TM0.3, TM0.5, TM1 e TM2. Pode-se ver que todas as amostras compartilham pena de morfologia semelhante com MoS puro 2 . Camada Ti 3 C 2 MXene tem superfície mais lisa e o MoS semelhante a uma flor 2 enriquecimento de microesferas na borda das lamelas, indicando que a estrutura de Ti 3 C 2 MXene não é destruído durante a síntese hidrotérmica. A Figura S2a revela a heterojunção 2D / 2D com acoplamento íntimo entre (2D) MoS 2 e (2D) Ti 3 C 2 . As imagens de mapeamento EDS correspondentes são obtidas na Fig. S2b-e, que reflete os elementos Mo, Ti e C dispersos uniformemente no composto TM.
A propriedade de absorção óptica dos compósitos TM é analisada pelo espectro UV-Vis DRS, conforme revelado na Fig. 3a. TM0.5 possui a capacidade de absorção óptica mais forte na faixa de luz visível e UV em nítido contraste com TM0. Pode-se notar que em uma determinada faixa, a intensidade de absorção óptica dos compósitos TM é aumentada significativamente com o aumento do Ti 3 C 2 contente. Especialmente, Ti 3 excessivo C 2 reduz o desempenho fotocatalítico das amostras TM, o que é atribuído ao fato de que Ti 3 excessivo C 2 adição impede a absorção de luz de MoS 2 nanofolhas [50].
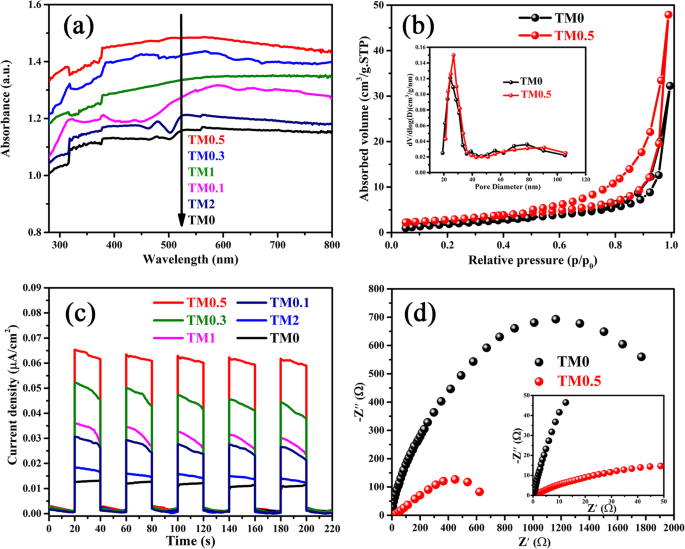
a Espectros de refletância difusa de UV-vis (DRS) de amostras de TM0, TM0.1, TM0.3, TM0.5, TM1 e TM2 sintetizadas. b N 2 isotermas de adsorção-dessorção para os pós TM0 e TM0.5 preparados. c Resposta fotocorrente de TM0, TM0.1, TM0.3, TM0.5, TM1 e TM2. d Espectros de impedância eletroquímica da amostra TM0 e TM0.5
A Figura 3b mostra o N 2 isotermas de adsorção-dessorção de amostras TM0 e TM0.5 e suas curvas de distribuição de tamanho de poro (Fig. 3b inserção). Ambas as amostras são tratadas a 100 ° C por 4 h antes do teste. O tamanho médio dos poros de TM0 e TM0,5 é 24,9 e 29,1 nm. A área de superfície Brunauer-Emmett-Teller das amostras TM0 e TM0.5 é de 8,51 e 10,2 m 2 g −1 , respectivamente, sugerindo que TM0.5 tem uma área de superfície específica maior e N 2 maior capacidade de adsorção do que a amostra TM0.
A eficiência de separação de buracos fotogerados e elétrons é confirmada pela resposta transiente da fotocorrente (curvas I-t), conforme mostrado na Fig. 3c. A amostra TM0.5 exibe maior intensidade de fotocorrente do que TM0, que é atribuída à migração efetiva de fotoelétrons da banda de condução de MoS 2 para Ti 3 C 2 nanofolhas. O comportamento de recombinação / transferência de portadores de carga de amostras TM é explorado por espectros de impedância eletroquímica (EIS), conforme apresentado na Fig. 3d. Entre essas amostras, o maior e o menor tamanho do arco da curva de Nynquist são exibidos pelos fotocatalisadores TM0 e TM0.5, respectivamente, indicando a alta condutividade do Ti 3 C 2 MXene é benéfico para a migração de elétrons. No entanto, um raio maior do arco pode ser observado na amostra TM2 (Fig. S4), o que sugere que Ti 3 muito alto C 2 o carregamento leva ao aumento da impedância de transferência da portadora. Obviamente, a boa concordância dos resultados de I-t e EIS confirma que o conteúdo de Ti 3 C 2 pode afetar a transferência de portadores fotogerados.
A Figura S5 mostra o espectro FT-IR das amostras TM0 e TM0.5. As bandas de absorção em 600, 910, 1100 e 1630 cm −1 são correspondência com o alongamento Mo-S, S-S, Mo-O e -OH, respectivamente [51]. A banda em cerca de 3350 cm −1 está anexado a -CH 2 grupo de vibração de alongamento de água superficial [52]. Comparado com a amostra TM0, todos os picos das amostras TM0.5 exibem uma ligeira mudança, sugerindo que uma forte interação é emergida entre MoS 2 e Ti 3 C 2 nanofolhas.
Imagens HRTEM dos compósitos TM0 e TM0.5 são ainda observadas na Fig. 4a, b. No geral, o grau de sobreposição para MoS 2 nanofolhas e aglomeração para MoS 2 microesfera diminui com Ti 3 C 2 adição aumentando. Em detalhes, para o MoS puro 2 nanofolhas, a sobreposição para o MoS 2 pode ser notado, o que não é benéfico para a absorção da luz visível, conforme mostrado na Fig. 4a. Com o aumento do Ti 3 C 2 além disso, a morfologia de MoS 2 muda gradualmente do estado agachado para o estado de alongamento (Fig. 4b), o que pode revelar a área de superfície específica aumentada e os locais ativos aumentados. O Ti 3 em camadas ultrafinas C 2 nanofolhas estão bem dispersas em solução e em contato próximo com MoS 2 . Isso é favorável para facilitar o MoS 2 nanofolhas se estendem por meio de forte acoplamento físico, que desempenhará um papel importante na transferência de elétrons no processo fotocatalítico. Enquanto, como Ti 3 C 2 o conteúdo aumenta ainda mais para 1 e 2% em peso, um grande número de MoS 2 nanofolhas se sobrepondo e aglomerando aleatoriamente em Ti 3 C 2 substratos, como mostrado na Fig. S6a, b.
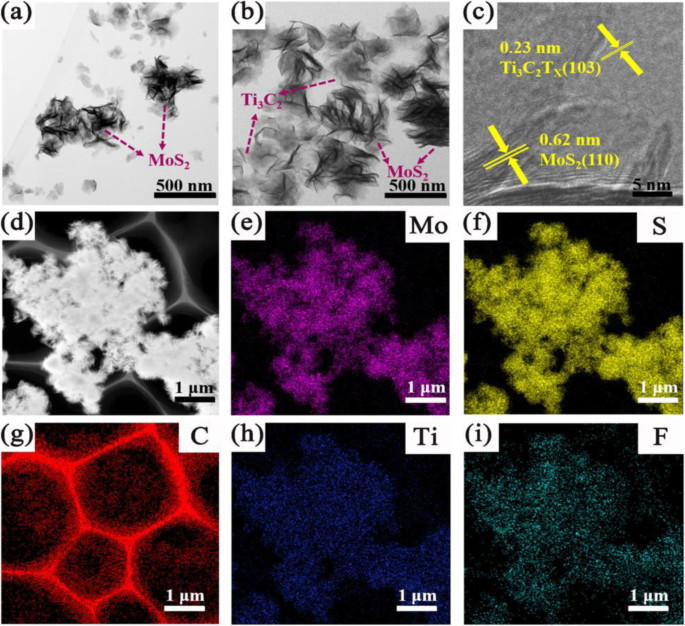
a , b Imagens TEM de amostras TM0 e TM0.5. c Imagem HRTEM de Ti 3 C 2 / MoS 2 . d Uma imagem STEM. e , f , d , h , i Imagens de mapeamento EDS de elementos Mo, S, C, Ti e F da amostra TM0.5
A Figura 4c fornece a estrutura de heterojunção de TM0.5. O espaçamento da rede de 0,23 e 0,62 nm é atribuído ao (103) plano do cristal de Ti 3 C 2 e (110) plano de cristal de MoS 2 , respectivamente [24, 47]. A heterojunção de contato íntimo promove a transferência e separação de portadores fotogerados e orifícios na interface de heterojunção [43]. Mais detalhes da estrutura de heterojunção em amostras de TM podem ser observados na Fig. S6c, d. A microscopia eletrônica de transmissão de varredura (STEM) de TM0.5 é exibida na Fig. 4d, e o mapeamento EDS correspondente de Mo, S, C, Ti e F é dado na Fig. 4e-i. As razões atômicas (Fig. S3) dos elementos C, Ti, Mo e S são 62,68, 3,79, 10,56 e 22,97%, respectivamente. O contorno claro de MoS semelhante a uma flor 2 enxertado em Ti ultrafino 3 C 2 nanofolhas provam que Ti 3 C 2 nanofolhas acopladas a MoS 2 construir heterojunção íntima com sucesso. Todas as evidências de imagens SEM e TEM indicam que os compostos TM foram sintetizados com sucesso.
Para mais confirmação da coexistência de Ti 3 C 2 e MoS 2 no compósito, o XPS é usado para analisar a composição química da superfície e os estados da amostra TM0.5, conforme mostrado na Fig. 5. Todos os elementos (Mo, S, Ti, O, C) são observados nos espectros de pesquisa XPS. Os picos característicos 36,4, 160,6, 226,8, 283,6 e 529,7 eV são indexados como Ti 3p, S 2p, Mo 3d, C 1 s e O 1 s, respectivamente [19]. Na Fig. 5b, três picos nas energias de ligação de 223,86, 226,69 e 229,99 eV são atribuídos a S 2 s, Mo 3d 5/2 e Mo 3d 3/2 , respectivamente, revelando a existência de Mo 3+ em híbridos TM. Conforme mostrado na Fig. 5c, dois picos estão situados em 159,53 e 160,72 eV, de acordo com S 2p. Os picos de C 1 s pertencem a Ti 3 C 2 é exibido nas energias de ligação de 282,38 e 283,57 eV, conforme exibido na Fig. 5d.
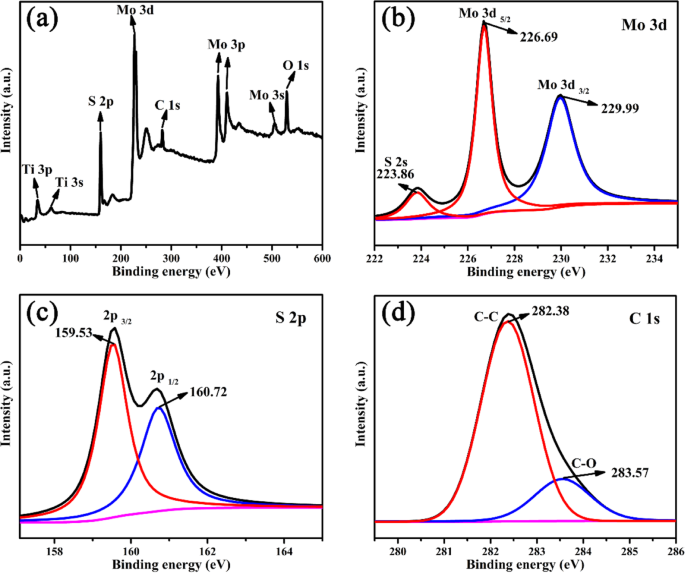
a Espectros de pesquisa XPS e espectros XPS de alta resolução de b Mo 3d, c S 2p, d C 1 s na amostra TM
A Figura 6a, b exibe a atividade fotocatalítica para a degradação de MO em várias amostras de TM sob irradiação de luz visível. O experimento em branco prova que não há mudança óbvia na solução de MO em 90 minutos de reação na ausência de catalisador, como mostrado na Fig. 6a. Acontece que as moléculas de MO provaram ser quimicamente estáveis e difíceis de serem decompostas. O efeito de adsorção é eliminado antes da degradação fotocatalítica, agitando as misturas no escuro por 1 h. Depois de ser tratado no escuro por 60 min, 37 ~ 51% do MO é adsorvido por diferentes compósitos TM. Todas as amostras demonstram fortes habilidades de adsorção física e a amostra TM0.5 mostra grande capacidade de adsorção do que outras devido ao aumento da área de superfície específica. Após a adsorção, experimentos de degradação fotocatalítica subsequentes são realizados com concentração de MO de equilíbrio como concentração inicial.
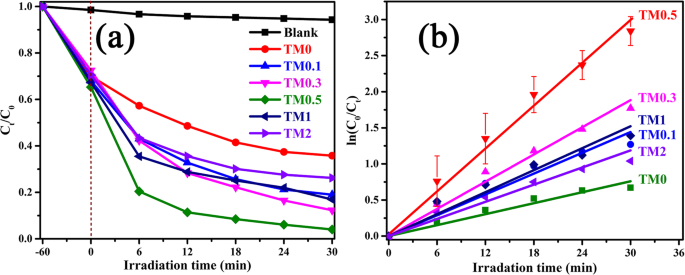
a Desempenho de degradação fotocatalítica. b A constante de taxa correspondente k valores dos compósitos TM0, TM0.1, TM0.3, TM0.5, TM1 e TM2 sob irradiação visível (30 mg / L de solução de MO)
Obviamente, todos os compostos TM exibem maiores habilidades de fotodegradação do que o MoS original 2 sob irradiação de luz visível, sugerindo que uma pequena quantidade de Ti 3 C 2 A adição de MXene pode aumentar a atividade fotocatalítica de MoS 2 . Quando o aumento da adição de MXene de 0 para 0,5% em peso, a degradação total de MO aumenta dramaticamente. O desempenho fotocatalítico mais alto é obtido pela amostra TM0,5 e a solução de MO 97,4% é degradada em 30 min. Aumentando ainda mais o Ti 3 C 2 além de 2% em peso, a capacidade de degradação dos catalisadores de compósitos TM é reduzida. Este fenômeno pode ser atribuído ao fato de que muito Ti 3 C 2 impede a absorção da luz visível pelo MoS 2 nanofolhas, reduzindo a atividade fotocatalítica [53]. A comparação de diferentes TiO 2 Os compósitos à base de para degradação fotocatalítica de MO sob irradiação de luz visível são mostrados na Tabela S1.
Além disso, a cinética de degradação de MO foi ajustada conforme plotada de acordo com a teoria da cinética de pseudo-primeira ordem (ln (C 0 / C t )) =kt, onde k é a constante de taxa de primeira ordem aparente, como mostrado na Fig. 6b. Pode ser obtido que as constantes de taxas cinéticas para TM0, TM0.1, TM0.3, TM0.5, TM1 e TM2 são 0,00135, 0,00308, 0,00454, 0,00836, 0,00401 e 0,0028 min −1 , respectivamente. O valor ideal de k pertence à amostra TM0.5, que é cerca de 6,2 vezes maior que o TM0.
A fim de investigar a atividade fotocatalítica de compósitos TM0.5 sob várias concentrações de MO, a degradação para 20, 30 e 50 mg / L de solução de MO é dada na Fig. S7a. Em geral, a eficiência de degradação da amostra TM0,5 diminui à medida que a concentração da solução de MO aumenta. Como pode ser observado,> 90% da solução de MO de concentração inferior é degradada em 25 min. A Figura S7b, c mostra as mudanças nos espectros de absorção ultravioleta de 30 e 50 mg / L de solução de MO, respectivamente. O forte pico de absorção da solução de MO em 554 nm diminui gradualmente devido ao efeito de fotodegradação do TM0,5. Além disso, a amostra TM0.5 também exibe forte capacidade de degradação (quase 80%) para a degradação de MO (50 mg / L) em 125 min. Os resultados acima comprovam que os fotocatalisadores TM têm perspectivas potenciais para a degradação de poluentes orgânicos de alta concentração.
A estabilidade do fotocatalisador é testada repetindo três vezes na mesma condição. Separação de TM0.5 da solução de mistura por tratamento centrífugo de alta velocidade. A estabilidade das amostras de TM é revelada na Fig. 7a, a atividade fotocatalítica da amostra de TM0.5 não diminui significativamente após 3 reciclagens do processo de fotodegradação, o que demonstra que o fotocatalisador possui estabilidade e sustentabilidade superiores [54]. A estabilidade estrutural dos fotocatalisadores é obtida comparando o XRD antes e depois do uso, como mostrado na Fig. S8.
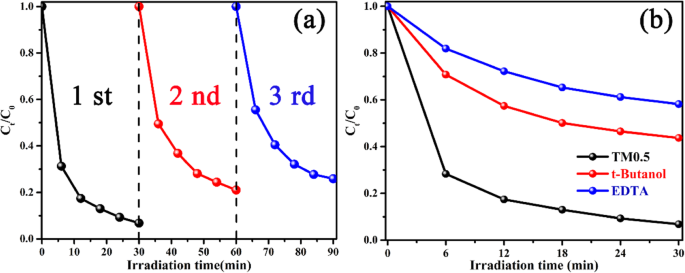
a Reciclagem de experimentos fotocatalíticos de amostra TM0.5 para degradação fotocatalítica de MO, repetindo três vezes sob a mesma condição. b Efeitos de diferentes necrófagos no processo de fotodegradação de MO sob luz visível
O mecanismo potencial de degradação fotocatalítica é obtido por experimentos de captura. Os orifícios fotogerados (h + ) e radicais hidroxila (• OH) desempenham papéis cruciais no processo de degradação fotocatalítica [21]. Trietanolamina (EDTA) e t-Butanol são introduzidos como os eliminadores para extinguir os buracos ativos (h + ) e radicais hidroxila (• OH) sob irradiação de luz visível, respectivamente. Conforme exibido na Fig. 7b, o composto TM0.5 exibe a melhor atividade fotocatalítica quando nenhum eliminador é adicionado. Na presença de EDTA ou t-Butanol, a degradação do MO é notavelmente inibida, sugerindo que os orifícios fotogerados e os radicais hidroxila participam da reação fotocatalítica. Depois de adicionar EDTA, a degradação de MO diminui significativamente (menos de 40%), indicando que os orifícios desempenham um papel fundamental na reação de degradação. Portanto, as principais espécies ativas de degradação fotocatalítica são os orifícios fotogerados (h + ), seguido por radicais hidroxila (• OH).
A heterojunção 2D / 2D do esquema R Ti 3 C 2 MXene / MoS 2 é benéfico para a migração e agregação de elétrons da banda de condução do MoS 2 para os sites ativos de Ti 3 C 2 , acelerando assim o processo de evolução do hidrogênio fotocatalítico. A Figura 8a apresenta uma comparação de H 2 atividades de produção com diferentes amostras de TM sob irradiação de luz visível. O MoS puro 2 (TM0) amostra mostra uma baixa taxa de produção de hidrogênio fotocatalítico (65,4 μmol h −1 g −1 ) devido à rápida recombinação do fototransportador. As taxas de H fotocatalítico 2 a produção aumenta significativamente após o acoplamento com Ti 3 C 2 nanofolhas, indicando que os aceitadores de elétrons de 2D Ti 3 C 2 MXene pode efetivamente aumentar a mobilidade do elétron. O carregamento ideal de Ti 3 C 2 em Ti 3 C 2 MXene / MoS 2 compósitos é de 0,5% em peso, de acordo com H 2 taxa de produção de 380,2 μmol h −1 g −1 . No entanto, as taxas de produção de hidrogênio aumentam com Ti 3 C 2 carregando até 0,5% em peso e, em seguida, diminua em um Ti 3 mais alto C 2 carregando. As taxas de produção de hidrogênio das amostras TM1 e TM2 são 324,7 e 266,3 μmol h −1 g −1 , respectivamente. A redução das taxas de evolução de hidrogênio em Ti 3 mais alto C 2 o carregamento pode ser descrito como o excesso de Ti 3 C 2 MoS de blindagem MXene 2 da luz visível.
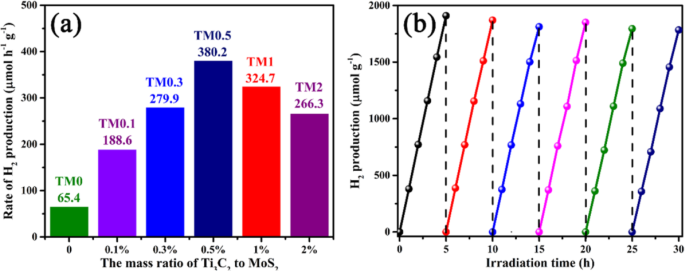
a The photocatalytic hydrogen evolution rate of TM0, TM0.1, TM0.3, TM0.5, TM1 and TM2 samples under visible light irradiation. b The recycling tests of TM0.5 for water splitting process
Furthermore, the recoverability of TM0.5 photocatalyst is further analyzed by cyclic photocatalytic hydrogen production tests. As depicted in Fig. 8b, the H2 production remains stable after 6 cycles with 5 h intermittence reaction under irradiation, which suggests that Ti3 C2 /MoS2 composites have strong stability.
The probable mechanism of photocatalytic reaction over 2D/2D heterojunction of R-scheme Ti3 C2 MXene/MoS2 can be demonstrated in Fig. 9a. The photo-induced electrons arise from the VB of MoS2 and transfer to the corresponding CB under visible irradiation. Photoelectrons can transfer quickly from conduction band (CB) of MoS2 to Ti3 C2 by close-contact heterojunction due to the greater activeness of the EF of Ti3 C2 than the CB potential of MoS2 [55]. In a typical degradation process, a large number of electrons accumulated on the surface of Ti3 C2 MXene reacted with oxygen (O2 ) to produce superoxide radicals (•O2 - ) Meanwhile, the hydroxyl ions (OH − ) and water adsorbed onto the catalyst surface reacted with photogenerated holes to generate hydroxyl radicals (•OH) [46].
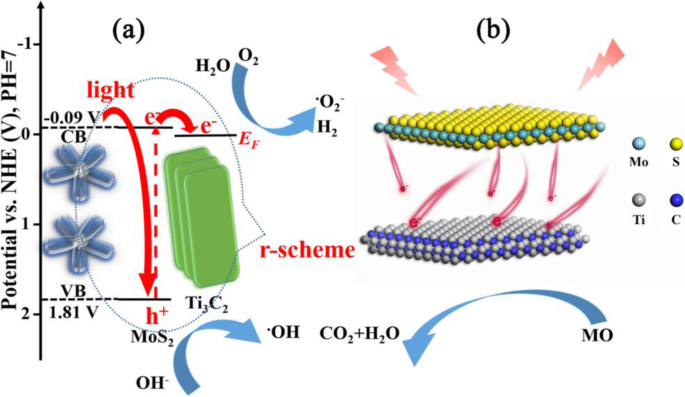
a Energy level structure diagram of MoS2 and Ti3 C2 . b Schematic illustration of photo-induced electron transfer process at the heterojunction interface
The steps of photocatalytic H2 evolution reaction are depicted by Eq. (1)-(3) on the active rites of Ti3 C2 :
$$ {\mathrm{H}}_3{\mathrm{O}}^{+}+{\mathrm{e}}^{-}+\ast \to \mathrm{H}\ast +{\mathrm{H}}_2\mathrm{O} $$ (1) $$ {\mathrm{H}}_3{\mathrm{O}}^{+}+{\mathrm{e}}^{-}+\mathrm{H}\ast \to {\mathrm{H}}_2+{\mathrm{H}}_2\mathrm{O} $$ (2) $$ \mathrm{H}\ast +\mathrm{H}\ast \to {\mathrm{H}}_2 $$ (3)
The active sites can be represented by * in HER process. The surface terminations of Ti3 C2 MXene absorb H3 O + ion and electron to form an H atom, which is called Volmer reaction, as presented in Eq. (1). The H atom combines with an electron from Ti3 C2 and another H3 O + to form a hydrogen molecule, which is known as the Heyrovsky mechanism, as depicted in Eq. (2) A H2 molecule is formed by two H atoms on the active sites, which is called the Tafel mechanism, as displayed in Eq. (3) [44].
The 2D/2D heterojunction of TM samples is illustrated in Fig. 9b. The photogenerated electrons can rapidly migrate from MoS2 to the surface of Ti3 C2 nanosheets due to the electronic transfer channel of 2D/2D heterojunction. The excellent electronic conductivity of 2D Ti3 C2 can effectively extend the separation time and reduce the recombination of photogenerated electron hole pair [56]. Therefore, the photocatalytic activity is enhanced obviously.
Conclusões
In summary, 2D/2D heterojunction of R-scheme Ti3 C2 MXene/MoS2 composites is successfully synthesized by hydrothermal method. The Ti3 C2 MXene/MoS2 photocatalysts display remarkably enhanced photocatalytic activity for the degradation of MO and H2 evolution reaction compared with pristine MoS2 . The 0.5 wt% Ti3 C2 MXene/MoS2 sample reaches an optimum MO degradation of 97.4% after 30 min irradiation and hydrogen evolution rate of 380.2 μmol h −1 g −1 under visible irradiation. The morphology and structure analysis confirm that MoS2 nanosheets are induced by ultrathin Ti3 C2 MXene from crouching to stretching, which may greatly increase the specific surface area and enhance the light absorption ability. More importantly, Ti3 C2 MXene coupled with MoS2 nanosheets can effectively receive and transfer electrons from excited semiconductor, which is beneficial to suppress the charge recombination and improve the interface charge transfer processes. In this work, the constructed novel 2D/2D heterojunction of R-scheme Ti3 C2 MXene/MoS2 demonstrates that Ti3 C2 MXene can become a promising cocatalyst in photocatalytic reaction.
Disponibilidade de dados e materiais
Todos os dados gerados ou analisados durante este estudo estão incluídos neste artigo publicado e seus arquivos de informações complementares.
Abreviações
- XRD:
-
Difração de raios X
- SIBs:
-
Sodium-ion batteries
- ELA:
-
Reação de evolução de hidrogênio
- TM:
-
Ti3 C2 MXene/MoS2
- FESEM:
-
Microscopia eletrônica de varredura por emissão de campo
- EDS:
-
Energy-dispersive spectrometry
- HRTEM:
-
High resolution transmission electron microscopy
- FTIR:
-
Espectroscopia de infravermelho com transformada de Fourier
- DRS:
-
UV-Vis diffuse reflectance spectroscopy
- XPS:
-
espectroscopia de fotoelétrons de raios-X
- EIS:
-
Espectroscopia de impedância eletroquímica
- STEM:
-
Microscopia eletrônica de transmissão de varredura
- EDTA:
-
Triethanolamine
Nanomateriais
- Renesas:Soluções de interface do usuário sem toque com MCUs de teclas de toque capacitivas para controle de gestos 2D / 3D
- Nanofibras e filamentos para entrega aprimorada de drogas
- MoS2 com Espessura Controlada para Evolução Eletrocatalítica de Hidrogênio
- Composto mecânico de LiNi0.8Co0.15Al0.05O2 / nanotubos de carbono com desempenho eletroquímico aprimorado para baterias de íon-lítio
- Cristalização dependente da temperatura de nanoflocos MoS2 em nanofolhas de grafeno para eletrocatálise
- Síntese hidrotérmica de nanopartículas de In2O3 híbridos gêmeos heteroestruturas de ZnO de disco hexagonal para atividades fotocatalíticas aprimoradas e estabilidade
- Efeito Lateral Fotovoltaico Grande em Heterojunção MoS2 / GaAs
- Desempenho fotocatalítico acionado por luz visível de nanocompósitos N-dopados com ZnO / g-C3N4
- Preparação e desempenho fotocatalítico de fotocatalisadores de estrutura oca LiNb3O8
- Um romance fotocatalisador de heterojunção Bi4Ti3O12 / Ag3PO4 com desempenho fotocatalítico aprimorado



