Nanopartículas de albumina sérica bovina com quitosana carregada com curcumina potencialmente aumentaram a fagocitose de Aβ 42 e a polarização de macrófagos modulada na doença de Alzheimer
Resumo
A doença de Alzheimer (DA) é a doença neurodegenerativa mais comum na população idosa. No tratamento da DA, alguns obstáculos, incluindo a dificuldade de penetração da droga através da barreira hematoencefálica (BBB), eliminação inadequada do peptídeo Aβ e a liberação maciça de fatores inflamatórios, devem ser superados com urgência. Para resolver esses problemas, desenvolvemos nanopartículas (NPs) especiais e inovadoras feitas de quitosana (CS) e albumina de soro bovino (BSA) para aumentar a penetração de drogas através da BBB. A curcumina como um agente antiinflamatório potente foi usada para aumentar a fagocitose do peptídeo Aβ. Os resultados demonstraram que os NPs CS-BSA carregados com curcumina aumentaram efetivamente a penetração da droga através da BBB, promoveram a ativação da microglia e aceleraram ainda mais a fagocitose do peptídeo Aβ. Além disso, os NPs CS-BSA carregados com curcumina inibiram a via de sinalização TLR4-MAPK / NF-κB e a polarização de macrófagos M1 ainda mais reduzida. Este estudo sugeriu que os NPs de CS-BSA carregados com curcumina têm o potencial de aumentar a fagocitose de Aβ 42 por meio da modulação da polarização de macrófagos na DA.
Introdução
A doença de Alzheimer (DA) é uma doença neurodegenerativa marcada por um início insidioso e uma progressão no declínio cognitivo. Histopatologicamente, amilóide-β (Aβ) 42 como um peptídeo contendo 42 aminoácidos é agregado em filbrils de β-peptídeo amilóide caracterizados por “placas senis” extracelulares na DA, induzindo assim a apoptose neuronal e a perda de sinapses [1,2,3] . Geralmente, os monômeros Aβ 42 são fisiologicamente solúveis e não tóxicos, enquanto seus oligômeros são mais tóxicos in vitro e in vivo [4, 5]. Portanto, a agregação de Aβ 42 interveniente pela eliminação do monômero Aβ 42 é amplamente considerada como o alvo terapêutico mais apropriado para a DA [6,7,8,9]. É bem conhecido que os peptídeos Aβ podem desencadear a ativação microglial interagindo com vários receptores Toll-like (TLRs), incluindo TLR4, e também promovem a fagocitose dependente de CD14, TLR4 ou TLR2 e a depuração de Aβ 42 [10, 11,12]. Embora a ativação microglial possa promover a eliminação de Aβ 42, as células microgliais - um tipo de macrófago mononuclear - são possivelmente superativadas e polarizadas para o fenótipo M1 (caracterizado pela liberação de fatores solúveis potencialmente neurotóxicos e citocinas pró-inflamatórias), levando assim à morte neuronal e exacerbando o desenvolvimento de DA. Por outro lado, algumas células microgliais são do fenótipo classicamente ativado (M2), caracterizado pela produção de citocinas antiinflamatórias; estes melhoram a disfunção cognitiva na DA [13,14,15,16]. Portanto, a proporção de macrófagos do tipo M1 / M2 pode afetar significativamente a progressão da DA [17, 18]; além disso, a regulação positiva necessária para converter macrófagos pró-inflamatórios M1 em antiinflamatórios M2 irá mostrar um potencial promissor na prevenção e no tratamento da DA.
A curcumina, que se origina de um componente do açafrão-da-índia (Curcumin longa) - um tipo de gengibre - é um agente antiinflamatório potente que pode reduzir a inflamação e pode até desempenhar um papel no tratamento da DA [19]. Nos últimos anos, foi descoberto que a curcumina supostamente possui propriedades anti-amiloidogênicas, antiinflamatórias, antioxidantes e quelantes de metais que podem ter efeitos neuroprotetores potenciais [20, 21]. A curcumina modula a polarização de macrófagos por meio da inibição das vias da proteína quinase ativada por mitogênio do receptor toll-like 4 (TLR4-MAPK) / NF-κB [22,23,24]. No entanto, a fraca estabilidade e biodisponibilidade da curcumina limitam sua aplicação clínica. Além disso, a presença da barreira hematoencefálica (BBB) também impede a penetração da curcumina no tratamento da DA [25,26,27].
Para melhorar o transporte de drogas do sangue para o cérebro, nanopartículas (NPs) com superfície funcionalizada com peptídeos [28] e anticorpos [29] auxiliam na entrega de drogas através da BBB e a eficiência de penetração da BBB de NPs pode ser significativamente aumentada por meio de outros mecanismos de transporte ativos do que a difusão passiva simples [30]. NPs de quitosana (CS) - um nano-carreador para associação com Aβ - pode permear a BBB e não é imunogênico [31]. Além disso, a albumina sérica foi encontrada no plasma circulante do corpo humano em concentrações de 50 g / L de soro, não era tóxica e era bem tolerada pelo sistema imunológico [32, 33]. Também foi relatado que nanopartículas derivadas de albumina de soro bovino (BSA) têm propriedades de liberação sustentada que podem aumentar a meia-vida da droga, diminuindo assim a frequência de administração e aumentando a adesão do paciente [34]. Portanto, usamos CS e BSA como os dois biomateriais para preparar NPs CS-BSA carregados com curcumina para alcançar a melhor penetração BBB. Os efeitos da curcumina na fagocitose de Aβ 42, secreção de citocinas inflamatórias e a regulação das vias TLR4-MAPK / NF-κB foram investigados para confirmar ainda mais o mecanismo molecular da curcumina na polarização de macrófagos.
Materiais
O CS com um grau de desacetilação de 80% e um peso molecular de aproximadamente 400 kDa foi adquirido da Haixin Biological Product Co., Ltd. (Ningbo, República Popular da China). O BSA foi adquirido da Sigma-Aldrich Co. (St. Louis, MO, EUA) e a curcumina foi adquirida da Dalian Meilun Biotechnology Co., Ltd. (Dalian, República Popular da China). FITC-β-amyloid (1-42) foi adquirido da Chinese Peptide Co., Ltd. (Hangzhou, República Popular da China). Os outros produtos químicos adquiridos eram de grau analítico e obtidos da Sigma-Aldrich Co. A linha de células de macrófagos, RAW 264.7 (linha de células de macrófagos de monócitos leucêmicos de camundongo) e a linha de células endoteliais microvasculares do cérebro (hCMEC / D3), que serviu como modelo do BBB humano, foram estabelecidos pelo Instituto de Biologia Celular de Xangai, Academia Chinesa de Ciências de Xangai (República Popular da China). Ambas as células foram mantidas a temperaturas de 37 ° C e com 5% de CO 2 atmosfera, em Dulbecco’s Modified Eagle’s Medium (DMEM) suplementado com 10% (volume / volume) de soro fetal bovino inativado por calor e antibióticos (100 U / mL de penicilina e 100 mg / mL de estreptomicina). Foi relatado que as células RAW 264.7 tratadas com lipopolissacarídeo (LPS) recapitulam aspectos das células microgliais observadas em doenças neurodegenerativas exemplificadas por AD [35, 36]. Portanto, as células da linha celular de macrófagos RAW 264.7 polarizadas para o fenótipo M1 por lipopolissacarídeo (LPS; 1 μg / ml) foram posteriormente aplicadas para simular as células microgliais na DA.
Preparação de NPs CS-BSA carregados com curcumina
De acordo com nosso relatório anterior [37], sob uma interação eletrostática, CS carregados positivamente poderiam se conjugar com BSA carregado negativamente para formar NPs. O método de preparação foi o seguinte:0,1% de ácido acético foi usado para dissolver CS para obter uma solução a 0,5 mg / mL de CS e 100 μL de DMSO contendo 0,05 mg / mL de curcumina foram adicionados à solução de CS para mistura completa sob magnética agitação à temperatura ambiente. Como uma quantidade apropriada de solução de BSA, 1,0 mg / mL foi lentamente gotejado na mistura de CS e curcumina; neste ponto, o fenômeno de opalescência apareceu e os NPs CS-BSA foram posteriormente condensados em partículas sólidas. Além disso, o tamanho, polidispersidade, potencial zeta e morfologia dos NPs foram investigados. A liberação de drogas in vitro de NPs foi estimada usando um método previamente relatado [37]. A eficiência de encapsulação (EE,%) da curcumina em NPs foi calculada usando a equação abaixo.
\ (\ mathrm {EE} \% =\ frac {W _ {\ mathrm {total}} - {W} _ {\ mathrm {grátis}}} {W _ {\ mathrm {total}}} \ vezes 100 \% \ )
W total foi a quantidade de curcumina adicionada inicialmente, W grátis foi a quantidade de curcumina que permaneceu no sobrenadante.
Avaliação da apoptose celular por MTT
Para determinar a segurança de CS-BSA NPs na apoptose celular, um ensaio de MTT foi usado para avaliar a viabilidade celular. De acordo com o protocolo de nosso estudo anterior, diferentes quantidades de NPs CS-BSA em branco foram usadas para tratar células RAW 264,7 (fenótipo M1) e células hCMEC / D3 por 24 h a 37 ° C para análise posterior.
Estudos de penetração usando um modelo BBB in vitro
Uma cultura de transwell em monocamada usando a linha de células endoteliais microvasculares do cérebro, hCMEC / D3, é um modelo BBB comum in vitro que é usado para estudar a distribuição de NPs no cérebro. A mistura de células hCMEC / D3 (em 0,5-1,0 mL do volume total) foi adicionada à inserção na câmara superior de uma placa transwell de 12 poços para cultura de células em monocamada com uma resistência elétrica transendotelial> 300 Ω; PBS a um nível de pH de 7,4 foi adicionado à câmara inferior. A curcumina livre e a suspensão de NPs CS-BSA carregados com curcumina foram colocadas na câmara superior para incubação contínua por 3 h em uma incubadora ajustada a 37 ° C, 5% de CO 2 . Posteriormente, a curcumina livre e os NPs de CS-BSA carregados com curcumina foram transferidos através das células e inseridos na câmara inferior. A quantificação dos NPs penetrados foi detectada por meio de um leitor de microplacas (Synergy-2; BioTek Instruments, Winooski, VT, EUA) verificando a intensidade de fluorescência da curcumina, que é excitada a 425 nm e emitida a 530 nm. A razão de fluorescência relativa (RFR,%), que representa as taxas de penetração de NPs, foi calculada determinando a razão da intensidade de fluorescência dos NPs CS-BSA carregados com curcumina penetrados na câmara inferior àquela da curcumina inicialmente adicionada. carregados NPs CS-BSA na câmara superior. Diferentes inibidores endocíticos, como clorpromazina (que inibe a captação mediada por clatrina) a 10 μg / mL, genisteína (captação mediada por caveolae) a 1 μg / mL, citocalasina D (30 μM, macropinocitose) e 20 μg / mL de sódio azida (um inibidor de energia), foram usados para determinar várias vias endocíticas envolvidas nos vários mecanismos de penetração. A taxa de penetração relativa foi determinada comparando as taxas de penetração de NPs tratados com inibidores com aqueles de NPs tratados com não inibidores.
A absorção celular de NPs CS-BSA carregados com curcumina
A distribuição e localização de CS-BSA NPs carregados com curcumina em células RAW 264.7 (fenótipo M1) foi observada usando microscopia confocal de varredura a laser (FluoView FV10i; Olympus Corporation, Tóquio, Japão). A mistura de células hCMEC / D3 (em 0,5-1,0 mL do volume total) foi adicionada à inserção na câmara superior da placa Transwell de 12 poços para cultura de células em monocamada com uma resistência elétrica transendotelial> 300 Ω. Células RAW 264.7 (fenótipo M1) foram semeadas na câmara inferior. A curcumina livre e uma suspensão de NPs CS-BSA carregados com curcumina foram colocadas na câmara superior para incubação contínua em uma incubadora ajustada a 37 ° C, 5% de CO 2 . Em intervalos predeterminados, as distribuições celulares de curcumina livre e NPs CS-BSA carregados com curcumina em células RAW 264,7 (fenótipo M1) foram observadas detectando a fluorescência verde emitida pela curcumina usando microscopia confocal de varredura a laser.
Detecção da fagocitose de Aβ 42 induzida por curcumina livre e NPs CS-BSA carregados com curcumina
Células RAW 264.7 (fenótipo M1) em meio de crescimento total foram semeadas em uma placa de 12 poços (1 × 10 5 células / poço) e tratados com curcumina livre e NPs CS-BSA carregados com curcumina por 24 h a 37 ° C. Para remover a curcumina não internalizada e os NPs CS-BSA carregados com curcumina, água destilada foi usada para lavar as células em um curto período de tempo duas vezes. Verificou-se que a curcumina e os NPs de CS-BSA carregados com curcumina foram completamente eliminados do meio, e não havia risco óbvio de células de água destilada induzida por baixa osmolaridade porque a morfologia das células lavadas por água destilada estava intacta e não havia explosão de células foi observado. Finalmente, Aβ 42 livre marcado com FITC dissolvido em PBS (pH 7,4) foi adicionado à placa para incubação contínua por 3 h. A fagocitose de Aβ 42 marcado com FITC em células RAW 264,7 (fenótipo M1) foi representada pela detecção da fluorescência verde emitida por FITC. A fagocitose intracelular e a localização de Aβ 42 dentro das células foram ainda estudadas usando microscopia confocal de varredura a laser (FluoView FV10i; Olympus Corporation).
Ensaio de Western blot
Para explorar o possível mecanismo molecular da polarização de macrófagos mediada pela curcumina, examinamos os níveis de expressão de citocinas pró-inflamatórias, como fator de necrose tumoral (TNF) -α e interleucina (IL) -6, e os níveis de fosforilação de ERK, JNK , p38 e NF-κB por Western blotting para efeitos específicos de estudo adicional da curcumina na via de sinalização TLR4-MAPK / NF-κB.
Resultados
A caracterização de NPs CS-BSA carregados com curcumina
As características dos NPs foram investigadas para determinar seu tamanho de partícula, potencial zeta e morfologia usando um Zetasizer (Nano ZS90; Malvern Instruments, Malvern, Reino Unido) e microscópio eletrônico de transmissão (TEM) (Jeol, Tóquio, Japão) em uma tensão de aceleração de 200 kV. Os resultados apresentados na Fig. 1 indicaram que os NPs de CS-BSA apresentaram um tamanho médio a 143,5 nm, um potencial zeta negativo a -10,8 mV e uma polidispersidade a 0,021, respetivamente. Foi observado que os NPs CS-BSA carregados com curcumina eram de forma esférica e monodispersos. A suspensão resultante contendo NPs CS-BSA carregados com curcumina foi centrifugada para obter uma solução sobrenadante para determinar a absorvância da curcumina e para calcular o conteúdo de curcumina livre na solução sobrenadante de acordo com a curva padrão. A eficiência de encapsulação (EE,%) da curcumina em NPs foi avaliada em 95,4%. Em termos do processo de liberação da droga a partir dos NPs, os NPs CS-BSA carregados com curcumina mostraram um padrão de liberação bifásico no meio com um nível de pH de 7,4. Cerca de 11,3% de todos os medicamentos foram liberados nas primeiras 3 horas, indicando que quando os NPs entraram na circulação sanguínea antes de atingir a BBB, a curcumina estava bem protegida e encapsulada no núcleo dos NPs. Além disso, alguns medicamentos vazaram dos NPs e foram liberados no sangue nas primeiras 3 horas. A maioria dos NPs CS-BSA carregados com curcumina pode ser transportada ao redor do BBB e aumentou a concentração da droga ao redor do cérebro.
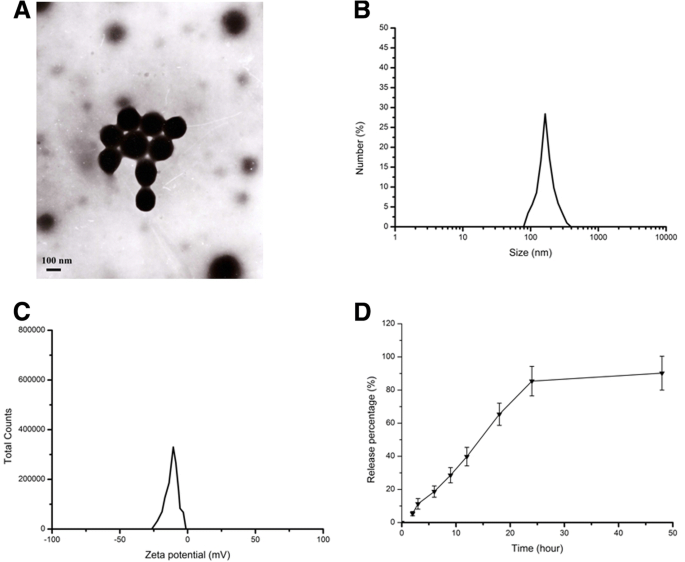
Caracterização de NPs CS-BSA carregados com curcumina. a Imagem TEM de NPs CS-BSA carregados com curcumina. b Análise de espalhamento dinâmico de luz (DLS) das NPs CS-BSA carregadas com curcumina. c Análise do potencial Zeta dos NPs CS-BSA carregados com curcumina. d O perfil de liberação in vitro dos NPs CS-BSA carregados com curcumina obtidos em solução salina tamponada com fosfato com um pH de 7,4 a 37 ° C por 48 h
Estudos de penetração usando um modelo BBB in vitro
As taxas de penetração da curcumina livre e as NPs foram avaliadas pela verificação da intensidade de fluorescência da curcumina na câmara inferior usando um leitor de microplaca (Synergy-2; BioTek Instruments), e foram calculadas pela determinação da razão da intensidade de fluorescência da curcumina penetrada NPs CS-BSA carregados na câmara inferior àqueles dos NPs CS-BSA carregados com curcumina inicialmente adicionados na câmara superior. Os resultados (Fig. 2) mostraram que o processo de penetração da curcumina livre e dos NPs CS-BSA carregados com curcumina seguiram padrões dependentes do tempo, e a taxa de penetração aumentou com o tempo. Isso sugeriu que a taxa de penetração da curcumina livre foi de 12,3% em 1 h, 20,3% em 2 h e 29,8% em 3 h. Em comparação com a curcumina livre, a eficiência de penetração de NPs CS-BSA carregados com curcumina foi aumentada, conforme representado pelas taxas de penetração aumentadas; as taxas de penetração aumentaram para 37,7% em 1h, 45,6% em 2h e 60,2% em 3h. Isso indicou que a curcumina livre pode encontrar dificuldades em penetrar através das células e mostrou baixa permeabilidade à BBB [38, 39]. Esta observação também indicou que os NPs de CS-BSA carregados com curcumina poderiam efetivamente promover a penetração da droga através das células, sugerindo o papel desempenhado por várias vias endocíticas. Um teste de inibição da endocitose mostrou que sendo consistente com os relatórios anteriores [40], a curcumina livre dependia da difusão passiva para a penetração e que não havia variação óbvia na eficiência de penetração da curcumina livre, independentemente de se um inibidor foi adicionado ou não. Por outro lado, a penetração de NPs era dependente de energia, e a proporção relativa de penetração tratada com azida de sódio foi de 55,6%. Além disso, tanto caveolae quanto macropinocitose mediaram principalmente as vias endocíticas de NPs. Em comparação com o tratamento com não inibidores, as taxas de penetração relativas nas células tratadas com genisteína e citocalasina D foram 67,8% e 60,3%, respectivamente.
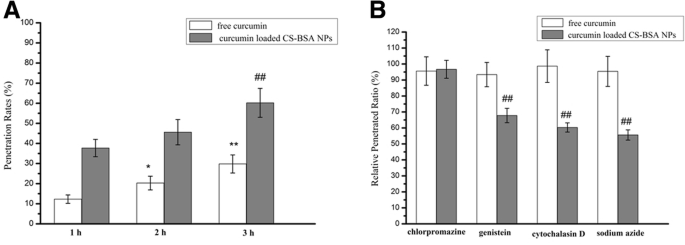
Análise do mecanismo de penetração de curcumina livre e NPs CS-BSA carregados com curcumina através de células hCMEC / D3. a Análise de espectro de fluorescência das taxas de penetração de curcumina livre e NPs CS-BSA carregados com curcumina. Os resultados são expressos como média ± desvio padrão ( n =3). * P <0,05, ** P <0,01 vs as taxas de penetração da curcumina livre em 1 h. ## P <0,01 vs as taxas de penetração de NPs CS-BSA carregados com curcumina em 1 h. b Efeitos de inibidores endocíticos na capacidade de penetração de curcumina livre e NPs de CS-BSA carregados com curcumina. Os resultados são expressos como média ± desvio padrão ( n =3). ## P <0,01 vs razão de penetração relativa de NPs CS-BSA carregados com curcumina tratados com clorpromazina
Avaliação da apoptose celular por MTT
Os efeitos citotóxicos de NPs CS-BSA em branco contra células RAW 264.7 (M1) e hCMEC / D3 foram estimados in vitro por um ensaio de MTT. As células foram tratadas com várias concentrações de NPs CS-BSA que variaram de 0 a 2,0 mg / mL. Um ensaio de viabilidade celular na Fig. 3 mostrou que nenhuma atividade citotóxica óbvia foi observada em células RAW 264.7 e células hCMEC / D3 quando tratadas com NPs CS-BSA em branco [37].
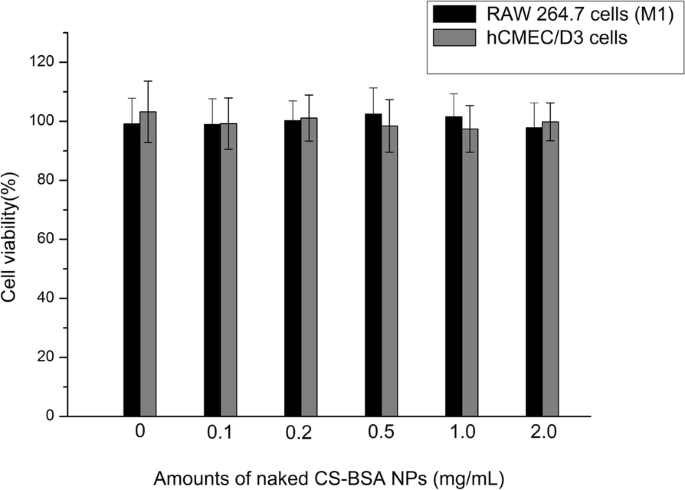
Viabilidade de células RAW 264.7 (M1) e células hCMEC / D3 após incubação com diferentes quantidades de NPs CS-BSA nus por 24 h ( n =3)
Distribuição e captação celular de NPs
Curcumina livre e NPs de CS-BSA carregados com curcumina contendo a mesma quantidade de curcumina a 100 μg / mL foram usados para tratar células RAW 264,7 (M1), e a distribuição e captação celular de curcumina foram observadas por microscopia confocal de varredura a laser (FluoView FV10i; Olympus). Pode ser visto na Fig. 4 que a distribuição intracelular de curcumina livre e NPs CS-BSA carregados com curcumina seguiu um padrão dependente do tempo e que a fluorescência verde da curcumina se acumulou dentro da célula e se dispersou por todo o citoplasma. Com o passar do tempo, a intensidade da fluorescência verde dentro das células foi aumentada. Isso demonstrou que a fluorescência verde emitida pela curcumina livre dentro das células era muito fraca, o que indicava que a maior parte da curcumina livre não foi absorvida pela linha celular de macrófago, RAW 264.7. Como NPs podem ter potencial promissor para entrega intracelular de drogas altamente eficiente [41, 42], foi observado que NPs CS-BSA carregados com curcumina mostraram intensidade de fluorescência aumentada quando comparados com células tratadas com curcumina livre, sugerindo que NPs CS-BSA poderiam melhorar a captação celular de curcumina. Aqui, esta observação indicava que os NPs de CS-BSA poderiam promover efetivamente o acúmulo de droga nas células.
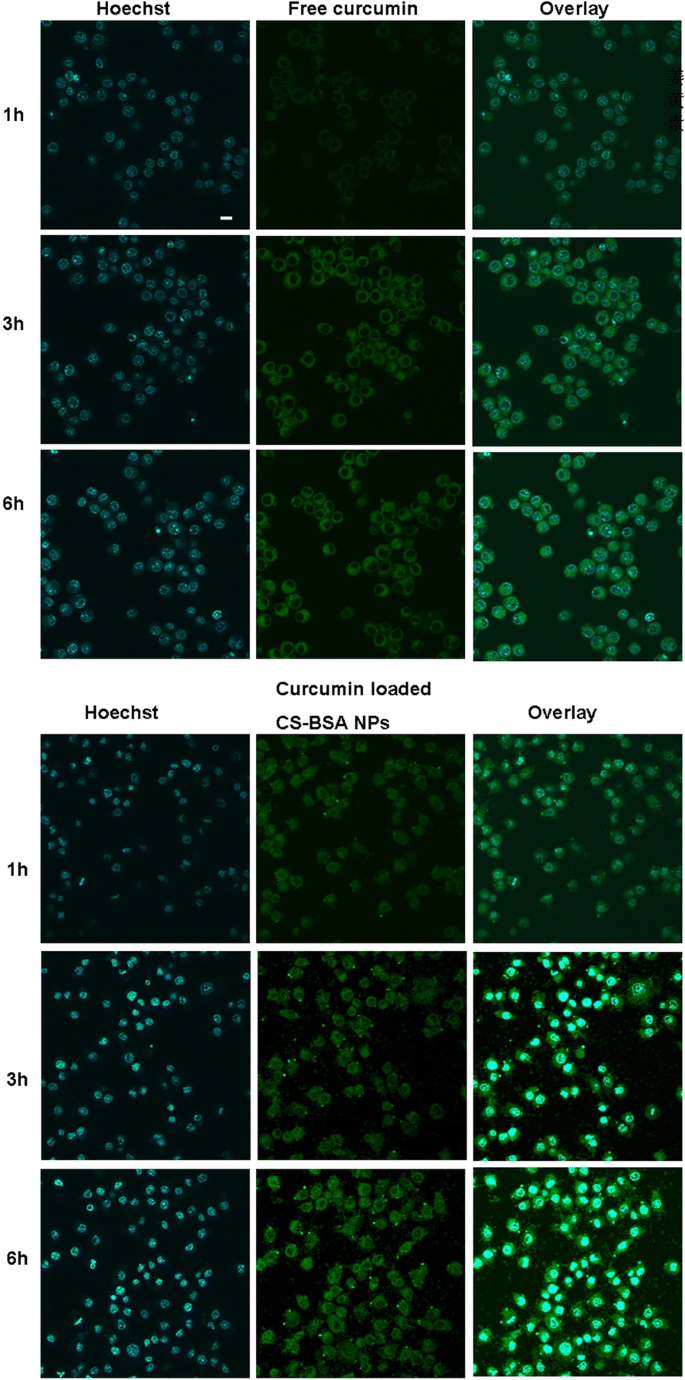
A absorção de curcumina livre e NPs de CS-BSA carregados com curcumina em células RAW 264,7 (M1) por 6 h. A curcumina mostrou cor verde fluorescente e indicou a localização intracelular de curcumina livre e NPs de CS-BSA carregados com curcumina. O núcleo foi corado com Hoechst (azul) durante 15 min a 37 ° C. A barra de escala é de 50 μm e se aplica a todas as partes da figura
Fagocitose de Aβ 42 induzida por curcumina livre e NPs CS-BSA carregados com curcumina
Como mostrado na Fig. 5, a curcumina exibiu fluorescência vermelha em um comprimento de onda de excitação de 550 nm e um comprimento de onda de emissão de 570 nm. Além disso, ele também mostrou fluorescência verde nos comprimentos de onda de excitação e emissão de FITC. Portanto, uma vez que Aβ 42 marcado com curcumina e FITC foram fagocitados em células RAW 264,7 (M1), todos eles mostraram fluorescência verde nos comprimentos de onda de excitação e emissão de FITC. No experimento de co-localização, a fluorescência vermelha e a fluorescência verde (representando a curcumina) foram mescladas e os pontos amarelos representaram a existência intracelular e a localização da curcumina; alguns pontos verdes não foram co-localizados com os pontos fluorescentes vermelhos, representando a existência e fagocitose de Aβ 42 marcado com FITC em células RAW 264,7 (M1). Observou-se que poucas quantidades de Aβ 42 foram fagocitadas pela microglia [43], o que foi comprovado pela observação intracelular de fluorescência verde nas células. Conforme mostrado na imagem de sobreposição na Fig. 5, em comparação com a curcumina livre, mais dos pontos fluorescentes amarelos de curcumina foram acumulados dentro das células, sugerindo que uma grande quantidade de NPs CS-BSA carregados com curcumina, conforme representado por fluorescente amarela intensidade, foram acumuladas nas células devido à interação entre NPs e células RAW 264,7 (M1). Isso induziu maiores concentrações intracelulares de curcumina, levando ao aumento da fagocitose de Aβ 42 [44], representada pela maior intensidade de fluorescência verde. Supunha-se que os NPs de CS-BSA carregados com curcumina induziam a polarização de macrófagos, bem como os efeitos antiinflamatórios e neuroprotetores contribuíam para o aumento da fagocitose.
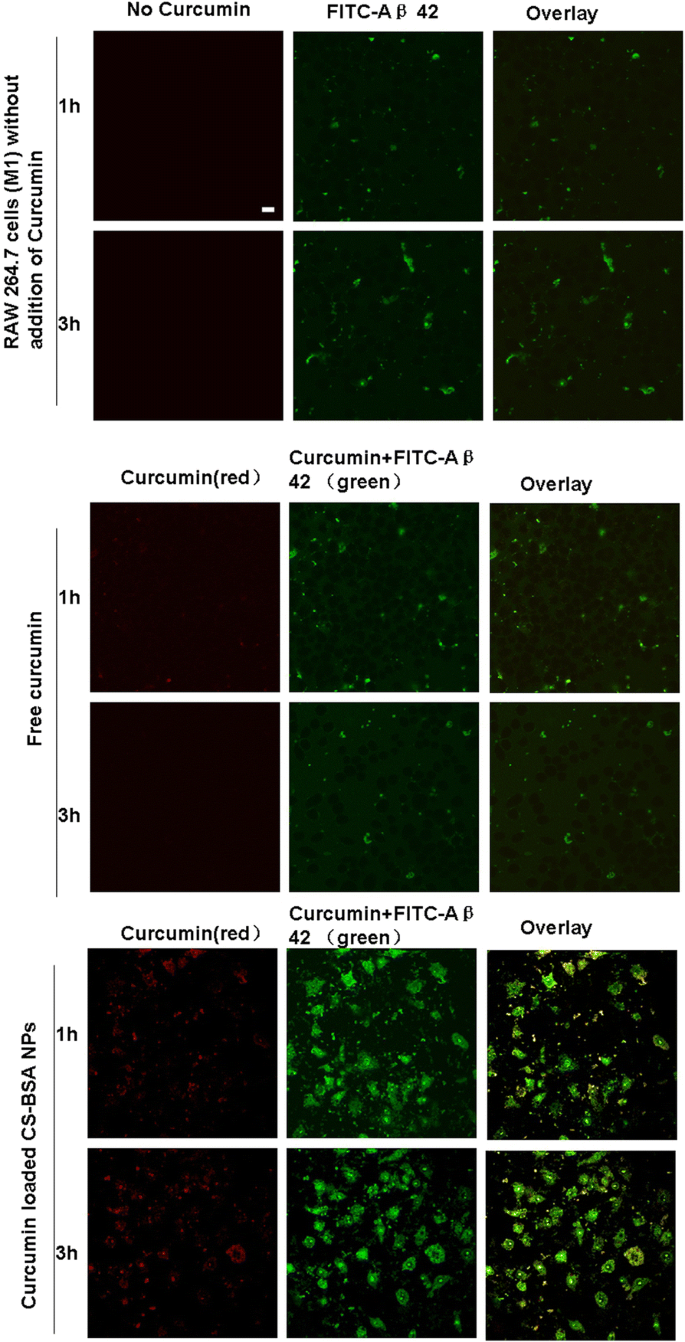
Fagocitose de Aβ 42 induzida por curcumina livre e NPs de CS-BSA carregados com curcumina. A barra de escala é de 50 μm e se aplica a todas as partes da figura
Ensaio de Western blot
Para explorar os possíveis mecanismos moleculares da polarização de macrófagos mediada pela curcumina, examinamos os níveis gerais de TNF-α, IL-6 e TLR4, bem como os níveis de fosforilação de p38, ERK, JNK e IκBα por Western blotting para estudar mais o efeitos específicos da curcumina na via de sinalização TLR4-MAPK / NF-κB.
A Figura 6 mostrou que, quando comparadas com as células RAW 264.7 normais como um grupo de controle, as células RAW 264.7 (fenótipo M1) liberaram mais fatores solúveis potencialmente neurotóxicos e citocinas pró-inflamatórias caracterizadas por níveis de expressão mais elevados de TNF-α e IL-6, levando assim à morte neuronal e exacerbando o desenvolvimento da DA. Em comparação com o controle e a curcumina livre, os NPs CS-BSA carregados com curcumina pareceram inibir a polarização de macrófagos M1 e induziram a expressão mais baixa de TNF-α e IL-6 em células RAW 264.7 (fenótipo M1). Além disso, os NPs de CS-BSA carregados com curcumina também diminuíram a expressão de TLR4, que regulou a polarização de macrófagos M1 e a fosforilação de ERK, JNK, p38 e NF-κB parecia estar reduzida. Isso sugere que os NPs de CS-BSA carregados com curcumina efetivamente promoveram o acúmulo de curcumina - e sua concentração intracelular subsequente - dentro das células, aumentando assim seus efeitos de bloqueio na via de sinalização TLR4-MAPK / NF-κB e inibindo ainda mais a polarização de macrófagos M1.
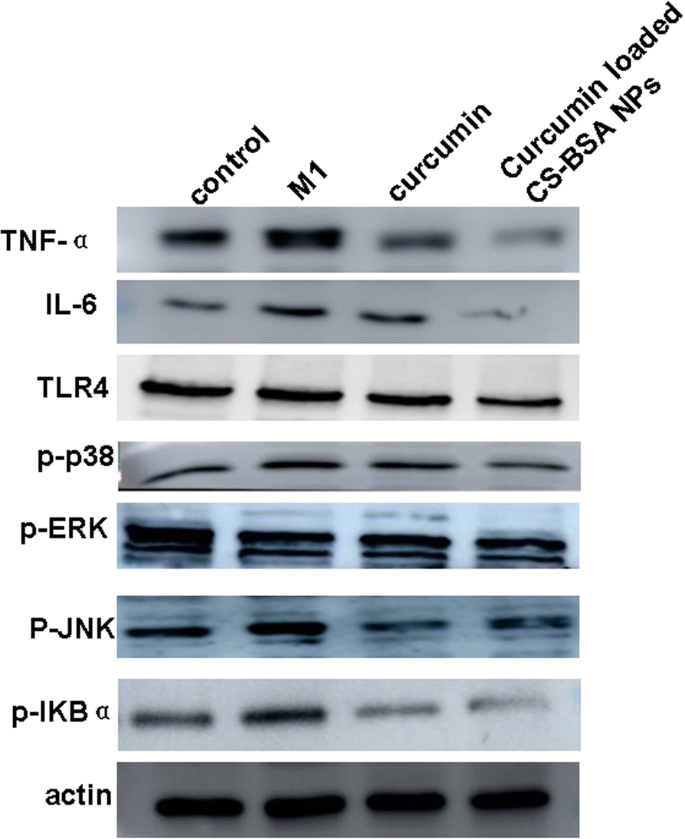
Análises de Western blot dos níveis de expressão de TNF-α, IL-6, TLR4 e fosforilação de ERK, JNK, p38 e fator nuclear (NF) -κB em células RAW 264,7 (fenótipo M1) após tratamentos com curcumina livre e curcumina NPs CS-BSA carregados
Discussão
A DA é uma das doenças neurodegenerativas mais comuns e a principal causa de morte nos países desenvolvidos. No que diz respeito ao tratamento da DA, a capacidade do BBB de prevenir a entrada da maioria das substâncias exógenas no cérebro foi o principal obstáculo para impedir seu uso. Para resolver esse problema, projetamos NPs de CS-BSA para melhorar o transporte de curcumina através do BBB. Os resultados demonstraram que, sendo consistentes com o estudo anterior [45], a curcumina livre dificilmente penetrou nas células e cruzou a BBB, resultando em efeitos de penetração menores. Os NPs de CS-BSA carregados com curcumina poderiam efetivamente promover a penetração da droga através da BBB com a mediação das vias mediadas por caveolae e micropinocitose. A neuroinflamação induzida pela agregação de Aβ é um dos fatores críticos subjacentes aos mecanismos patológicos da DA [46]. Os níveis de Aβ no cérebro são determinados pelo equilíbrio dinâmico entre a geração e a depuração de Aβ; portanto, a remoção de Aβ também é importante na determinação de seu nível no cérebro. A capacidade de fagocitose da microglia apresentou importante significado fisiológico na prevenção da DA. A microglia foi principalmente responsável pela eliminação do alvo Aβ e tendeu a agregar-se predominantemente em torno da zona de deposição de Aβ 42, evitando ainda mais o acúmulo de Aβ 42 por fagocitose [47, 48]. Os resultados mostraram que os efeitos da fagocitose de células RAW 264.7 tratadas com NPs CS-BSA carregadas com curcumina (fenótipo M1) em Aβ 42 foram aumentados e que o acúmulo e deposição de Aβ 42 foram reduzidos, o que pode melhorar o desenvolvimento de AD.
A microglia (fenótipo M1) libera fatores solúveis potencialmente neurotóxicos e citocinas pró-inflamatórias, como TNF-α e IL-6, levando à morte neuronal e exacerbando o desenvolvimento de DA [49]. Verificou-se que a polarização de macrófagos M1 depende da ativação da via de sinalização TLR4-MAPK / NF-κB e que o bloqueio da via de sinalização TLR4-MAPK / NF-κB pode inibir a polarização de macrófagos M1 e promover a polarização de macrófagos do tipo M1 ao tipo M2 [50]. Nossos resultados mostraram que a curcumina como um componente da especiaria indiana, açafrão (Curcumin longa) - um tipo de gengibre - era um agente antiinflamatório potente que poderia reduzir a inflamação e até mesmo desempenhar um papel no tratamento da DA. Os NPs CS-BSA serviram como ferramentas poderosas para a penetração de curcumina com alvo de BBB eficiente. Em comparação com a curcumina livre, os NPs de CS-BSA carregados com curcumina induziram efeitos de fagocitose e uma quantidade maior de Aβ42 foi fagocitada por células RAW 264,7. Além disso, os NPs de CS-BSA carregados com curcumina induziram os níveis de expressão proteica mais baixos de TNF-α, IL-6 e TLR4 do que a curcumina livre, e a fosforilação de ERK, JNK, p38 e NF-κB também foi inibida. Indicou que NPs CS-BSA carregados com curcumina podem aumentar a fagocitose de macrófagos induzida por curcumina ao inibir a polarização de macrófagos M1 através do bloqueio da via de sinalização TLR4-MAPK / NF-κB, promovendo assim os efeitos antiinflamatórios e neuroprotetores da curcumina.
Conclusão
Nossos dados sugerem que a curcumina pode ser usada como um agente terapêutico no tratamento da DA. Os NPs de CS-BSA carregados com curcumina desencadearam a fagocitose induzida por células RAW 264.7 de Aβ 42 pela penetração BBB melhorada de curcumina e maior concentração de droga intracelular. Além disso, os NPs CS-BSA carregados com curcumina induziram efeitos antiinflamatórios e neuroprotetores ao inibir a polarização de macrófagos M1 e bloquear a via de sinalização TLR4-MAPK / NF-κB. Tomados em conjunto, os NPs CS-BSA carregados com curcumina demonstraram seu potencial em melhorar o tratamento da DA.
Abreviações
- AD:
-
Doença de Alzheimer
- BBB:
-
Barreira hematoencefalica
- BSA:
-
Albumina sérica bovina
- CS:
-
Quitosana
- LPS:
-
Lipopolissacarídeo
- NPs:
-
Nanopartículas
- TLRs:
-
Receptores semelhantes a Toll
Nanomateriais
- Nanofibras e filamentos para entrega aprimorada de drogas
- Nanopartículas para terapia do câncer:progresso e desafios atuais
- Preparação e propriedades magnéticas de nanopartículas de espinélio FeMn2O4 dopadas com cobalto
- Preparação e atividade de hidrogenação catalítica aprimorada de nanopartículas de Sb / Palygorskite (PAL)
- Nanopartículas de albumina carregadas de resveratrol com circulação sanguínea prolongada e biocompatibilidade aprimorada para terapia de tumor pancreático direcionada altamente eficaz
- Síntese hidrotérmica de nanopartículas de In2O3 híbridos gêmeos heteroestruturas de ZnO de disco hexagonal para atividades fotocatalíticas aprimoradas e estabilidade
- Efeitos sinérgicos de nanopartículas de Ag / BiV1-xMoxO4 com atividade fotocatalítica aprimorada
- Influência da rigidez elástica e adesão da superfície no salto de nanopartículas
- Avanços recentes em métodos sintéticos e aplicações de nanoestruturas de prata
- Comparação entre o ácido fólico e a funcionalização baseada no peptídeo gH625 de nanopartículas magnéticas Fe3O4 para internalização celular aprimorada



