Nanopartículas carregadas com curcumina com transformação de fase induzida por ultrassom focalizado de baixa intensidade como nanoplataforma teranóstica de câncer de ovário direcionada a tumor e sensível ao pH
Resumo
Nós desenvolvemos uma nanoplataforma simples e versátil usando nanocages de ferritina sensíveis ao pH co-carregados com a droga anticâncer curcumina (Cur) e fluorocarbono perfluorohexano líquido (PFH) dentro do núcleo e molécula de alvejamento de tumor conjugada FA fora da casca referida como FA- FCP. O FA-FCP sintetizado possui diâmetro médio de partícula de 47 nm, com propriedades físico-químicas estáveis e favoráveis em diferentes meios, e alta biocompatibilidade e biossegurança in vivo e in vitro. Nas condições de ultrassom focalizado de baixa intensidade (LIFU) e em pH =5,0, o FA-FCP liberou grande quantidade de fármacos (53,2%) em 24 h. Após 4 min de tratamento LIFU (7 W), FA-FCP forneceu recursos de imagem de ultrassom com contraste aprimorado em pH =5,0. Devido à endocitose mediada pelo receptor de FA, o FA-FCP pode entrar com eficiência nas células e posteriormente se deslocar para os lisossomas. Dezoito horas após a injeção de FA-FCP, o tumor foi estimulado por LIFU, resultando em uma imagem de ultrassom com contraste. Experimentos in vivo e in vitro mostraram que o uso combinado de FA-FCP e LIFU teve efeitos significativos no tratamento do tumor. Com base nos resultados, concluiu-se que o FA-FCP combinado com o LIFU externo e o ambiente ácido endogênico pode ter funções teranósticas poderosas e fornecer um novo tipo de opção teranóstica tumoral integrada e não invasiva.
Introdução
O câncer de ovário é uma doença altamente metastática e letal com uma alta taxa de mortalidade [1, 2]. Como os primeiros sintomas clínicos não são conspícuos, as células tumorais já se tornaram altamente metastáticas quando a maioria dos pacientes é diagnosticada [3]. Os tratamentos comumente usados na clínica são cirurgia citorredutora combinada e quimioterapia, e a taxa de sobrevida de 5 anos de pacientes com doença avançada é muito baixa [4]. Portanto, é urgente o desenvolvimento de novas estratégias para o tratamento e diagnóstico do câncer de ovário para melhorar a sobrevida geral das pacientes. Recentemente, uma nanoplataforma que combina terapia direcionada e funções de diagnóstico por imagem forneceu uma estratégia de tratamento alternativa para o tratamento eficaz de tumores [5,6,7].
Nos últimos anos, a nanoplataforma de resposta acústica (ARN) tem sido amplamente utilizada no tratamento de tumores e na pesquisa diagnóstica [8, 9]. ARN é geralmente projetado como modelos de microbolhas (MBs) ou nanopartículas (NPs) [10,11,12]. Comparado com MBs, NPs têm um tamanho de partícula menor, maior permeabilidade, ciclo farmacocinético mais longo, melhor estabilidade e capacidade de modificação de superfície mais fácil [13]. Diferentes tipos de fluorocarbonos líquidos transformáveis em fase, como perfluoropentano (PFP), perfluorohexano (PFH) e brometo de perfluorooctilo (PFOB), são comumente usados para atingir a responsividade acústica [14,15,16,17,18,19]. Esses fluorocarbonos líquidos podem produzir bolhas, ou mesmo estouros, por meio de efeitos de vaporização de gotículas acústicas (ADV) sob estimulação de ultrassom com foco externo. Esse processo fornece ao ARN recursos aprimorados de contraste de ultrassom. Dentre esses fluorcarbonetos líquidos, o PFP tem baixo ponto de ebulição (29,2 ° C) e está sujeito à gaseificação no corpo, levando à embolia gasosa; O PFOB tem um ponto de ebulição muito alto (144 ° C) e requer ultrassom de intensidade ultra-alta para acionar as mudanças de fase líquido-vapor. Portanto, o PFH é considerado um material de transformação de fase ideal com um ponto de ebulição de 56 ° C. No entanto, o PFH é hidrofóbico e é uma boa ideia encapsulá-lo dentro das nanopartículas para torná-lo solúvel em água. Atualmente, vários materiais, como lipossomas, PLGA, mesoporoso orgânico, polímero orgânico, etc., foram relatados para encapsular fluorocarbonos líquidos [20,21,22,23,24]. Ao mesmo tempo, esses portadores podem ser carregados com drogas anticâncer para permitir que o ARN tenha funções quimioterápicas e para mostrar a capacidade de liberação acústica controlada da droga [16, 19]. Embora essas nanoplataformas acusticamente responsivas tenham sido relatadas para exibir um bom diagnóstico de tumor e capacidades de integração de tratamento, a biocompatibilidade dos nanocarreadores ainda é uma preocupação para a transformação clínica. Nos últimos anos, os nanocages de ferritina livre de ferro têm sido amplamente usados como veículos de entrega de drogas porque são proteínas endógenas e têm sensibilidade significativa ao pH [25,26,27]. Eles podem se decompor em ambientes ácidos e remontar em ambientes alcalinos. Isso torna a ferritina altamente biocompatível e proporciona uma capacidade de carga e liberação controlada de fármaco.
Neste estudo, a ferritina foi usada como um transportador para carregar PFH e curcumina (Cur) e modificar a molécula FA específica do tumor na superfície da proteína para obter uma nanoplataforma multifuncional (FA-FCP). A curcumina é um polifenol natural, que é extraído da cúrcuma e tem efeitos anticancerígenos favoráveis; no entanto, sua solubilidade em água é pobre [28,29,30,31]. FA-FCP melhora a solubilidade em água de PFH e Cur, tem alta estabilidade fisiológica em diferentes meios e tem biocompatibilidade e biossegurança favoráveis in vivo e in vitro. Nas condições de LIFU e em pH =5,0, o FA-FCP libera grande quantidade de medicamentos em 24 h (53,2%). Após 4 min de tratamento LIFU (7 W), FA-FCP em pH =5,0 fornece imagens de ultrassom com contraste. Devido à endocitose mediada por receptor de FA, o FA-FCP pode facilmente entrar nas células e se realocar nos lisossomas. Dezoito horas após a injeção de FA-FCP, o local do tumor foi estimulado por LIFU, e o tumor mostrou imagem de ultrassom com contraste. Experimentos in vivo e in vitro mostraram que FA-FCP tem um efeito significativo no tratamento do tumor. Estes resultados demonstraram que a vantagem do direcionamento não invasivo, mediado por ligante / receptor, transição de fase desencadeada por LIFU, ou mesmo detonação, e liberação precisa de droga tornam o FA-FCP uma nanoplataforma teranóstica de tumor promissora.
Materiais e métodos
Materiais
Ferritina (FRT), ácido fólico (FA) e perfluorohexano (PFH) foram adquiridos na Sigma (St. Louis, MO, EUA). A curcumina (Cur) foi adquirida da Aladdin Industrial Corporation (Shanghai, China). NH 2 -PEG 2000 -FA e NH 2 -PEG 2000 -COOH foram fornecidos por Xi’an Ruixi Biotechnology Co., Ltd (China). 1-etil-3- (3-dimetilaminopropil) carbodiimida (EDC) e N -hidroxisuccinimida (NHS) foram adquiridos da Thermo Fisher Scientific (Waltham, MA, EUA). O Cell Counting Kit-8 (CCK-8) foi obtido de Dojindo Laboratories (Kumamoto, Japão). Meio Eagle modificado por Dulbecco (DMEM), solução salina tamponada com fosfato (PBS), penicilina-estreptomicina, tripsina-EDTA e soro fetal bovino (FBS) foram adquiridos da Gibco (Grand Island, NY, EUA).
Preparação de FA-FCP
A fim de preparar FA-FCP, em primeiro lugar, 10 mg de FRT foram dissolvidos em 10 ml de água. Um total de 10 mg de Cur foi dissolvido em 0,3 ml de DMSO. Os dois tipos de soluções e 1 ml de PFH foram misturados sob condição de pH 5,0 e ultrassonicação em banho de gelo de 30 min. Depois disso, o valor de pH da mistura foi ajustado para 7,4 para obter FRT carregado com Cur e PFH (FCP). Em segundo lugar, a molécula alvo FA foi covalentemente conjugada com FCP através do método da carbodiimida [8]. Em resumo, 5 mg de NH 2 -PEG 2000 -FA foi adicionado à solução de FCP acima com a presença de EDC (5 mg / ml) e NHS (20 mg / ml). Após reação de 3 h à temperatura ambiente com leve agitação, a mistura foi purificada por meio de diálise contra água destilada (MW cut off =12 kDa) por 24 h, resultando em FCP conjugado com FA (FA-FCP). A taxa de carregamento de Cur foi detectada por um espectrofotômetro UV-Vis a 426 nm e calculada como (A a −A b ) / A c , onde A a , A b e A c representam o peso do FA-FCP, FA-FP e FA-FP, respectivamente.
Caracterizações
Os tamanhos e potenciais zeta das nanopartículas foram testados por um Zeta Sizer (Malvern, NanoZS, UK). A morfologia das nanopartículas foi observada por microscopia eletrônica de transmissão (TEM, Hitachi, Japão) e microscopia de força atômica (AFM, Agilent Technologies 5500LS, Chandler, Arizona). A captação celular das nanopartículas foi detectada por microscopia confocal de varredura a laser (LEXT OLS4100, Olympus, Japão) e citometria de fluxo (BD, Franklin Lakes, NJ). Os espectros de absorção foram adquiridos por um espectrofotômetro UV-Vis (UV1800, Shimadzu, Japão).
Cultura de células e modelo animal
A linha de células de câncer de ovário humano SK-OV-3 foi fornecida pelo Instituto de Biologia Celular de Xangai, Academia Chinesa de Ciências. As células foram cultivadas em meio DMEM contendo 10% de soro fetal bovino e 1% de solução de penicilina-estreptomicina em 5% de CO 2 a 37 ° C.
Ratinhos nus Balb / c (fêmeas, cerca de 5 semanas) foram fornecidos por Vital River Laboratory Animal Technology Co., Ltd. (Pequim, China). Para modelo de tumor SK-OV-3, 1 × 10 6 as células foram injetadas na região posterior direita de camundongos por via subcutânea. Todos os procedimentos experimentais foram realizados de acordo com as diretrizes para o cuidado e uso de animais de laboratório da Sichuan Academy of Medical Sciences e foram aprovados pelo Comitê de Ética da Sichuan Academy of Medical Sciences.
Liberação de Cur disparada por pH / LIFU
A solução aquosa de FA-FCP foi dividida em quatro porções e carregada em um saco de diálise (MW 5000). Eles foram então dialisados em 10 ml de solução de PBS com um pH de 5,0 e 7,4, respectivamente. Após 3 h, a solução aquosa foi tratada com ou sem LIFU (7 W, 5 min) (ciclo de trabalho de 50%, modo de onda de pulso e o procedimento a seguir mantido consistente). Em um ponto de tempo específico, 1 ml de dialisante foi removido e um volume igual e solução em branco de pH igual foi adicionado. O dialisado foi retirado e medido por um espectrômetro UV-Vis, e a concentração de Cur foi calculada.
Propriedades ADV e função de imagem dos EUA de FA-FCP
FA-FCP na condição de pH =5,0 e 7,4 foram irradiados com diferentes potências de LIFU (5, 6, 7 W) e por diferentes totais de tempo (3, 4 e 5 min) no modelo de gel de agarose, então as imagens de US foram observado por equipamento dos EUA (Esaote Mylab 90, Itália) com a frequência de 5–12 MHz e índice mecânico (MI) de 0,06. A intensidade dos EUA da região de interesse na imagem dos EUA foi analisada pelo software ImageJ.
Capacidade de segmentação de FA-FCP
Para demonstrar a capacidade de direcionamento de FA-FCP in vitro, FITC foi usado para marcar as nanopartículas. Resumidamente, 1 mg de FITC foi dissolvido em 1 ml de DMSO e depois misturado com FCP e FA-FCP durante 30 min com agitação suave. Em seguida, a solução misturada foi dialisada durante a noite em água desionizada para remover FITC e DMSO livres para obter nanopartículas marcadas com FITC. As células foram cultivadas por 24 h e, em seguida, as nanopartículas marcadas com FITC foram adicionadas às placas de cultura para incubação de 3 h. Em seguida, as células foram lavadas com PBS por três vezes e, em seguida, coradas com DAPI por 5 min, lysotracker red por 10 min, fixadas com paraformaldeído 4% por 15 min. Finalmente, as células foram observadas por um microscópio confocal de varredura a laser. Os sinais estatísticos de fluorescência dentro das células foram medidos e analisados por citometria de fluxo.
Circulação sanguínea e acúmulo tumoral de FA-FCP
Cur livre e FA-FCP (com a mesma concentração de Cur) foram injetados por via intravenosa em camundongos normais. E então, o sangue de camundongo em vários grupos foi coletado em diferentes pontos no tempo do plexo orbital e foi dissolvido em tampão de lise. A concentração de Cur no sangue nesses grupos tratados foi determinada por espectros de absorvância de Cur de cada amostra de sangue solubilizada usando um espectrômetro UV-Vis e foi definida como a porcentagem da dose injetada por grama de tecido (ID% / g).
O conteúdo de FA-FCP no tumor foi realizado em camundongos com tumor. Após 0, 1, 6, 12, 18 e 24 h de injeção intravenosa de FA-FCP, os tecidos tumorais foram coletados, pesados e digeridos em solução de água régia por 24 h. A concentração de Cur no sangue nesses grupos tratados foi determinada pelos espectros de absorvância de Cur de cada tecido tumoral solubilizado por um espectrômetro UV-Vis e foi definida como a porcentagem da dose injetada por grama de tecido (ID% / g).
Eficácia anticâncer In Vitro e In Vivo
Para eficácia anticâncer in vitro, as células foram tratadas com PBS, Cur, FA-FCP, FCP + LIFU e FA-FCP + LIFU (na mesma dose de Cur de 5 mg / kg) por 3 h, e então foram irradiadas por LIFU ( 5 min, 7 W). As células tratadas foram incubadas por mais 21 h. Depois disso, a viabilidade das células tratadas foi detectada pelo ensaio CCK-8.
Para eficácia anticâncer in vivo, camundongos com tumor foram divididos aleatoriamente em cinco grupos ( n =6) e então foram injetados por via intravenosa com solução salina (controle), Cur livre, FA-FCP, FCP + LIFU e FA-FCP + LIFU, respectivamente. Durante 24 dias de tratamento, o volume do tumor e o peso corporal dos camundongos foram monitorados a cada 3 dias. O tamanho do tumor foi detectado por um paquímetro. O volume do tumor =comprimento × largura 2 / 2. A alteração do crescimento do tumor foi mostrada pelos volumes relativos do tumor que foram calculados como V / V 0 , onde V 0 representa o volume inicial do tumor.
Avaliação de biossegurança
As células SK-OV-3 foram semeadas em uma placa de 96 poços na densidade de 1 × 10 4 células / poço e podem anexar por 24 h. Várias concentrações (0, 20, 40, 100, 200 e 500 μg / ml) de FA-FRT-PFH foram cultivadas com células SK-OV-3. Após tratamento de 24 horas, as células foram tratadas com meio DMEM contendo 10% de CCK-8 por 20 minutos em uma incubadora. A absorbância das células em comprimento de onda de 450 nm foi detectada por um Multimode Plate Reader (Thermo Scientific) para caracterizar a viabilidade celular. Além disso, os principais órgãos, incluindo coração, fígado, baço, pulmão e rim de camundongos saudáveis, 25 dias após a injeção de FA-FCP, foram coletados e analisados por coloração com hematoxilina e eosina. As imagens de coloração HE foram observadas em microscopia óptica.
Análise estatística
Todos os dados foram apresentados como média ± desvio padrão. Os dados estatísticos foram processados no software SPSS 22.0. O t do aluno teste foi realizado para determinar a significância estatística entre os dois grupos. P <0,05 representa uma diferença significativa.
Resultados e discussão
Preparação e caracterizações de FA-FCP
O Esquema 1 ilustra a síntese de FA-FCP e sua aplicação em imagens de ultrassom tumoral (US) e quimioterapia combinacional US in vitro e in vivo . O agente teranóstico multifuncional FA-FCP foi preparado por meio de um método de automontagem simples e biocompatível. As imagens TEM e AFM do FA-FCP mostram uma estrutura esférica (Fig. 1a, inserção e arquivo adicional 1:Figura S1). A análise DLS mostrou que FA-FCP tinha aproximadamente 47 nm em diâmetro médio e -37 mV em potencial zeta médio na água (Fig. 1a eb). Após 4 semanas em água, solução salina tamponada com fosfato (PBS), solução salina e FBS, FA-FCP exibiu estabilidade no tamanho (Fig. 1c), indicando que o FA-FCP preparado tinha estabilidade fisiológica favorável, provavelmente devido ao revestimento de PEG e a natureza do FRT [32]. O espectro UV-vis-NIR de FA-FCP exibiu o pico de absorção de Cur, demonstrando a existência de Cur em FA-FCP. A taxa de carregamento de Cur foi 125,8 ± 2,1%.
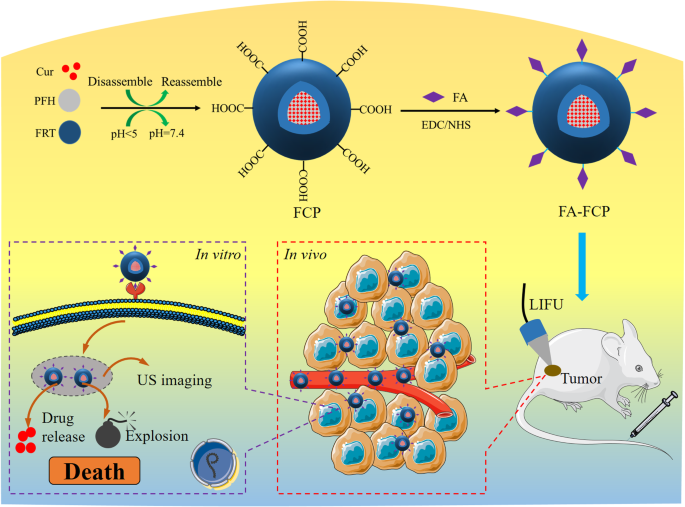
Representação esquemática do método de montagem, processo de síntese e aplicação teranóstica do FA-FCP.
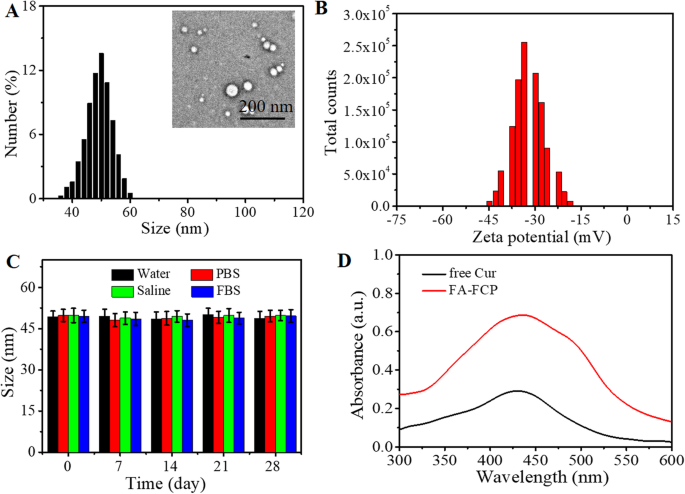
A caracterização de FA-FCP. a Distribuição de tamanho de FA-FCP. Inserido é a imagem TEM de FA-FCP. b Potencial Zeta de FA-FCP. c Mudança de tamanho de FA-FCP em água, solução salina tampão de fosfato (PBS), solução salina e soro fetal bovino (FBS) em 28 dias. d A curva de absorção de UV-Vis-NIR de Cur livre (50 μg / ml) e FA-FCP (40 μg / ml).
A Figura 2 mostra o perfil de liberação de Cur de FA-FCP sob diferentes condições de pH com ou sem LIFU. Sem irradiação LIFU, Cur liberado em pH =5,0 foi de cerca de 30% ao longo de 24 h, o que foi significativamente maior do que em pH =7,4 (5,3%). No entanto, sob LIFU (7 W, 4 min), Cur liberado em ambas as condições de pH =5,0 e pH =7,4 mostrou um aumento acentuado. No entanto, em comparação com o Cur liberado em pH =7,4, o Cur liberado em pH =5,0 (50%) foi obviamente maior em 24 h. Este recurso torna o FA-FCP muito útil no microambiente tumoral. A excelente liberação da droga é atribuída a (1) FRT sob condição ácida poderia desmontar e abrir o nanocage para liberar o Cur carregado; (2) LIFU induziu a transição de fase instantânea que permitiu Cur escapar da casca porosa expandida de forma constante.
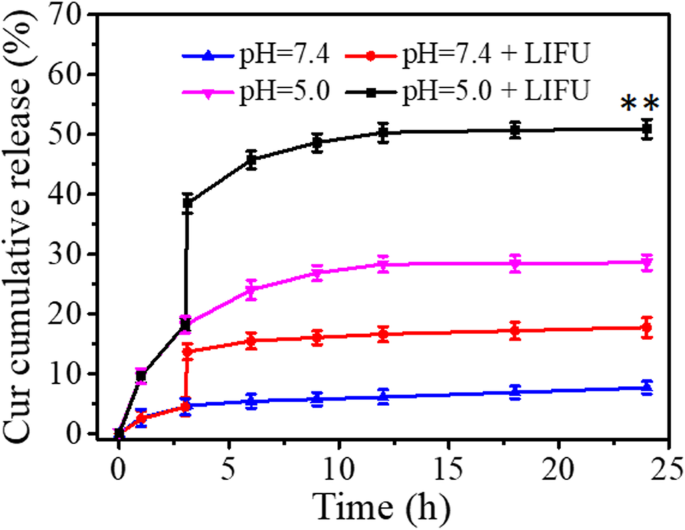
Liberação cumulativa da droga de FA-FCP em PBS (pH =5,0 / 7,4) a 37 ° C com ou sem LIFU após 3 h. ** p <0,01, em comparação com os outros grupos
Efeito ADV In Vitro do FA-FCP
O FA-FCP foi exposto a LIFU com uma potência de 5, 6 e 7 W, respectivamente, e uma duração de 3-5 min em pH =7,4 ou 5,0 para avaliar a melhor condição de potência e duração de LIFU e valor de pH . A intensidade dos EUA representa o efeito ADV. De acordo com imagens de US (Fig. 3a eb) e valores médios de tons de cinza em imagens de US (Fig. 3c e d), o efeito ADV exibiu uma tendência dependente de tempo / potência em pH =7,4, que atingiu um pico em um parâmetro de 7 W por 5 min. No entanto, em pH =5,0, o efeito ADV atingiu o pico em um parâmetro de 7 W por 4 min. Quando o parâmetro era inferior a 5 W por 3 min, havia bolhas disparadas insuficientes para otimizar as imagens de US; no entanto, uma vez que o parâmetro excedeu 7 W por 4 min, a maioria das bolhas geradas colapsou e gradualmente desapareceu. Os resultados acima indicaram que uma certa estimulação foi essencial para despertar o efeito ADV do FA-FCP, que era uma potência de 7 W e uma duração de 4 min em pH =5,0.
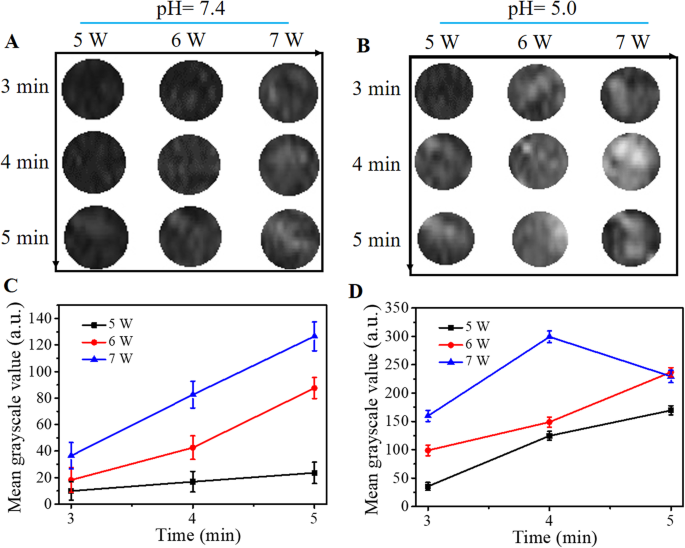
a e b Imagens de US de FA-FCP misturadas com gel de agarose em diferentes durações e poder de LIFU em pH 5,0 / 7,4. c e d Os dados estatísticos correspondentes do sinal dos EUA na Fig. 3a e b
A capacidade de direcionamento do FA-FCP
Um corante de molécula pequena clássico, FITC, foi usado para marcar as nanopartículas. Conforme mostrado no arquivo adicional 1:Figura S2, a intensidade de fluorescência de FCP marcado com FITC e FA-FCP na mesma concentração não mostrou nenhuma diferença significativa, indicando que a diferença de quantidade de FITC marcado em FCP e FA-FCP pode não ser influente na célula experiência de absorção. Imagens de fluorescência e análise de FCM mostraram que algum FCP poderia entrar nas células com uma taxa de captação de 19,5% (Fig. 4a eb), possivelmente porque a superfície da célula tem alguns receptores de ferritina que promovem a internalização de FCP. Após a conjugação com FA, FA-FCP mostrou um alto sinal de fluorescência nas células com 44,3% da razão de captação e um colapso da razão de captação (13,8%) quando as células foram pré-tratadas com FA livre (Fig. 4a e b). Os resultados acima indicaram que a conjugação de FA aumentou amplamente a proporção de captação de FA-FCP por meio do efeito de endocitose mediada pelo receptor de FA.
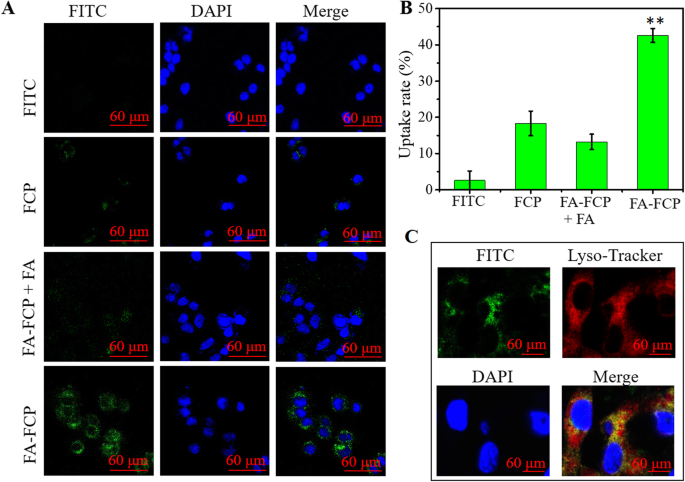
a As imagens confocais de fluorescência de células tratadas com FITC livre e FITC marcados com FCP, FA-FCP + FA e FA-FCP. As cores verde e azul representaram fluorescência FITC e DAPI, respectivamente. Barra de escala =60 um. b Os dados estatísticos do sinal de fluorescência FITC dentro das células tratadas com FITC livre e FCP marcado com FITC, FA-FCP + FA e FA-FCP por FCM. ** p <0,01, em comparação com os outros grupos. c As imagens de fluorescência confocal de células tratadas com FA-FCP marcado com FITC e vermelho liso-rastreador. As cores verde, azul e amarela representaram FITC, DAPI e fluorescência mesclada verde / azul, respectivamente. Barra de escala =60 um
Além disso, a localização organela de FA-FCP foi investigada usando um corante de coloração específico de lisossoma (Lyso-Tracker Red). Como mostrado na Fig. 4c, as células tratadas com FA-FCP e Lyso-Tracker Red exibiram forte fluorescência verde e vermelha no citoplasma, respectivamente. Após a fusão do verde e do vermelho, a fluorescência amarela intensa era visível no citoplasma, indicando que o FA-FCP poderia se realocar para os lisossomas (pH ≈ 5,0), o que foi benéfico para o desencadeamento da liberação do fármaco nas células.
Circulação de sangue e acúmulo tumoral de FA-FCP
Como mostrado na Fig. 5a, a meia-vida de FA-FCP foi de cerca de 7,31 h (um aumento de 8 vezes), em comparação com a de Cur livre, provavelmente devido ao revestimento de PEG e encapsulamento de FRT. Esta meia-vida prolongada de FA-FCP na corrente sanguínea é benéfica para melhorar a retenção de drogas na circulação sistêmica, facilitando o acúmulo de drogas em locais de tumor [32, 33]. Além disso, o acúmulo dinâmico de Cur livre e FA-FCP no tumor de 0 h a 24 h após a injeção da nanopartícula é mostrado na Fig. 5b. Como pode ser visto, FA-FCP apresentou o maior acúmulo de 18 horas e Cur livre apresentou o maior acúmulo de cerca de 1 hora após a injeção. Estes resultados indicam que em comparação com Cur livre, FA-FCP teve um desempenho de acumulação significativamente maior no tecido tumoral, possivelmente devido à permeabilidade e retenção aumentadas (EPR) e ao efeito de direcionamento ativo mediado pelo receptor de FA [34, 35].
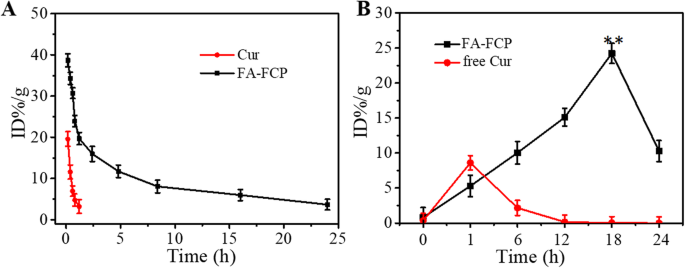
a A circulação sanguínea de Cur livre e FA-FCP após a injeção em camundongos. b O conteúdo de Cur livre e FA-FCP em tecido tumoral após injeção em camundongos com tumor. ** p <0,01, em comparação com os outros grupos
Imagens In Vivo nos EUA
O tumor de camundongos nus tratados em quatro grupos (controle em branco + LIFU, FCP + LIFU, FA-FCP + LIFU, FA-FCP sem LIFU) foram observados com ou sem exposição a LIFU (7 W, 4 min) para explorar melhor o potencial ADV de FA-FCP in vivo. Como mostrado na Fig. 6a, nenhum sinal de US óbvio foi observado dentro do tumor sob irradiação LIFU no grupo de controle. Às 18 h após as injeções, um sinal de US significativamente mais forte foi visto dentro do tumor no grupo FA-FCP + LIFU em comparação com os grupos com FCP + LIFU e FA-FCP sem LIFU (Fig. 6a e b). Os resultados demonstraram que FA-FCP + LIFU pode aumentar o contraste da imagem US do tumor.
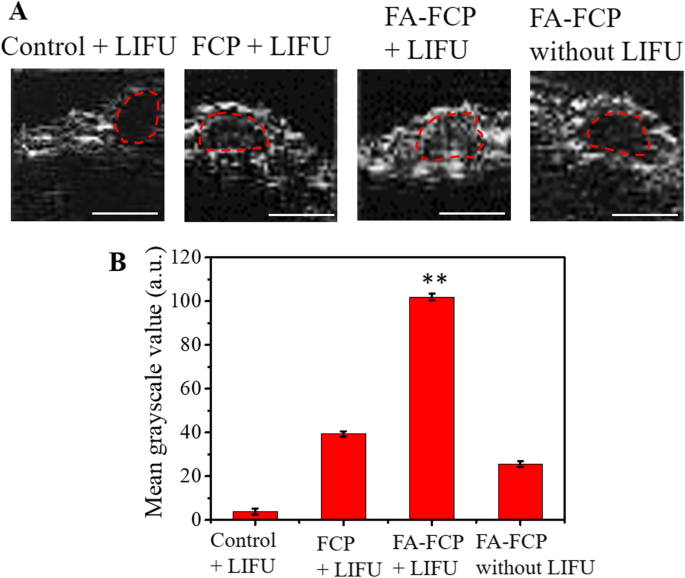
a Imagens de US de tumor nos grupos controle + LIFU, FCP + LIFU, FA-FCP + LIFU e FA-FCP sem LIFU, respectivamente. b Os valores quantitativos médios em tons de cinza de imagens de US do local do tumor em diferentes grupos. ** p <0,01, em comparação com os outros grupos
Terapia anticâncer In Vitro e In Vivo
A citotoxicidade in vitro de FA-FCP foi investigada pelo ensaio CCK-8. Como mostrado na Fig. 7a, a viabilidade celular de todos os grupos exibiu um padrão dependente da concentração de Cur. Sem LIFU, em comparação com Cur livre, FA-FCP mostrou maior inibição na viabilidade celular em todas as concentrações, possivelmente devido ao efeito de direcionamento de FA. No entanto, a inibição da viabilidade celular de FA-FCP + LIFU foi significativamente maior do que a de FP + LIFU, FCP + LIFU e FA-FCP sem LIFU, indicando que FA-FCP combinado com irradiação LIFU ofereceu melhor eficiência antitumoral. Este resultado deveu-se principalmente à presença de LIFU e ao ambiente ácido do lisossoma, os quais poderiam induzir a liberação do fármaco e o efeito da cavitação, e o efeito alvo das células tumorais mediadas por FA [36,37,38].
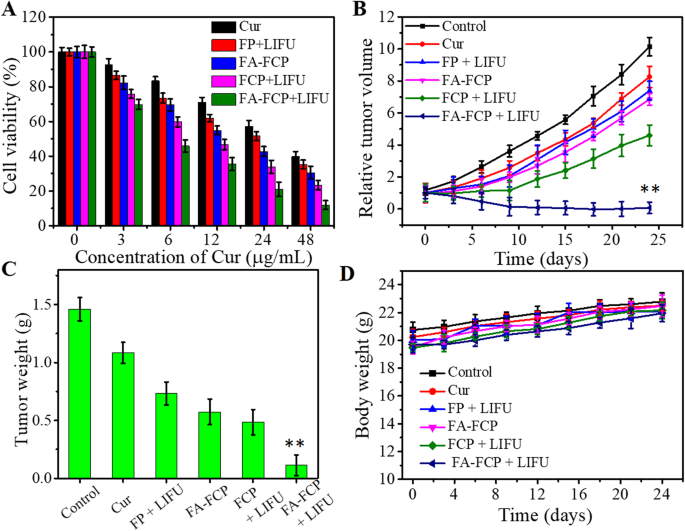
a Viabilidade celular de células SK-OV-3 incubadas com diferentes concentrações de Cur, FP + LIFU, FA-FCP, FCP + LIFU e FA-FCP + LIFU. b Volume de tumor relativo de camundongos nus portadores de tumor em grupos de controle, Cur, FP + LIFU, FA-FCP, FCP + LIFU e FA-FCP + LIFU, respectivamente. ** p <0,01, em comparação com os outros grupos. c Peso do tumor pós-tratamento de camundongos nus com tumor nos grupos controle, Cur, FP + LIFU, FA-FCP, FCP + LIFU e FA-FCP + LIFU, respectivamente. ** p <0,01, em comparação com os outros grupos. d Peso corporal de camundongos nus portadores de tumor nos grupos controle, Cur, FP + LIFU, FA-FCP, FCP + LIFU e FA-FCP + LIFU, respectivamente.
O efeito anticâncer in vivo do FA-FCP foi investigado adicionalmente com camundongos nus portadores de tumor. De acordo com o resultado de acúmulo de tumor de FA-FCP, LIFU foi conduzido 18 h após a injeção intravenosa de amostras a cada 2 dias por três vezes no total desde o primeiro dia. Como mostrado na Fig. 7b e c, o volume relativo do tumor no grupo FA-FCP + LIFU diminuiu significativamente, em comparação com os grupos controle, Cur, FA-FCP, FP + LIFU e FCP + LIFU após 24 dias de tratamento. O peso do tumor nos grupos FA-FCP e FCP + LIFU foi significativamente menor do que nos grupos controle e Cur, enquanto foi ainda mais inibido no grupo FA-FCP + LIFU. Durante o tratamento, não houve perda significativa de peso corporal nesses grupos (Fig. 7d). O efeito antitumoral brilhante de FA-FCP combinado com LIFU foi principalmente devido ao direcionamento da agregação de FA-FCP no tumor e na capacidade de liberação de fármaco responsiva a pH / acústica [39,40,41]. Além disso, esta eficácia terapêutica antitumoral aumentada do FA-FCP + LIFU pode ser explicada pela depuração retardada das nanopartículas no local do tumor devido à meia-vida prolongada do FA-FCP na corrente sanguínea [42].
Biocompatibilidade In Vitro e In Vivo
As biocompatibilidades in vitro e in vivo de FA-FCP foram avaliadas por ensaio CCK-8 e análise de coloração H&E. Como mostrado na Fig. 8a e b, a viabilidade celular do FA-FP portador de droga e o poder de LIFU de 0 a 8 W foram todos> 90%, indicando que não há citotoxicidade significativa do FA-FP e o poder de LIFU usado neste trabalho in vitro. A Figura 8c mostra as imagens de coloração de H&E dos principais órgãos dos camundongos tratados com FA-FCP + LIFU, não exibindo alterações histológicas em comparação com o grupo de controle. Estes resultados demonstraram a alta biocompatibilidade do FA-FCP in vitro e in vivo.
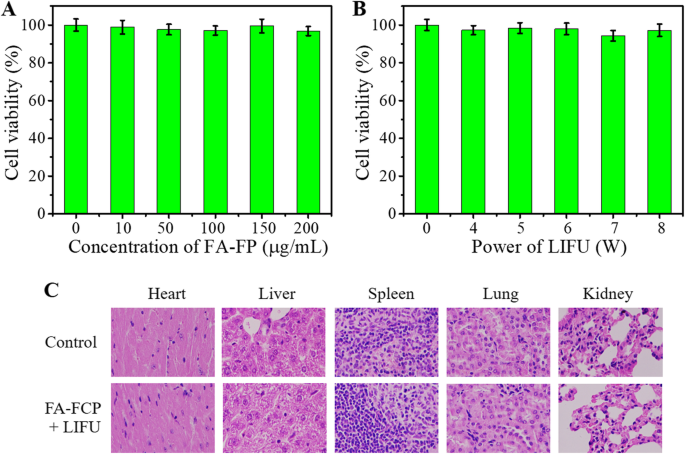
a Viabilidade celular de células SK-OV-3 após incubação com FA-FP por 24 h. b Viabilidade celular de células SK-OV-3 após tratamento por diferentes potências de LIFU. c Coloração H&E dos principais órgãos do grupo de controle e grupo FA-FCP 24 dias após a injeção intravenosa de nanopartículas (× 200)
Conclusão
Em resumo, preparamos um FA-FCP multifuncional carregado com o medicamento anticâncer Cur e a molécula de direcionamento de tumor FA, usando nanocages de ferritina, o que resultou em capacidade de imagem de US com contraste aprimorado e direcionamento preciso em procedimentos de quimioterapia. O FA-FCP recentemente sintetizado mostrou alta biocompatibilidade in vitro e in vivo. Além disso, FA-FCP exibiu excelente capacidade de direcionamento de tumor, liberação de Cur acústica / disparada por pH e transição de fase acústica-responsiva por LIFU para imagens de ultrassom. Dadas essas propriedades únicas do FA-FCP, ele pode ser aplicado como um fator de inibição tumoral significativo sem toxicidade sistêmica. Espera-se que tal nova e biocompatível nanoplataforma teranóstica integre a imagem de ultrassom com eficácia terapêutica melhorada para fornecer um paradigma promissor para o tratamento do câncer.
Disponibilidade de dados e materiais
As conclusões feitas neste manuscrito são baseadas nos dados (texto principal e figuras) apresentados e mostrados neste artigo
Abreviações
- EUA:
-
Ultrassom
- FA:
-
Ácido fólico
- FRT:
-
Ferritina
- PFH:
-
Perfluorohexano
- LIFU:
-
Ultra-som focalizado de baixa intensidade
- ADV:
-
Vaporização de gota acústica
- FITC:
-
Isotiocianato de fluoresceína
- CCK-8:
-
Kit de contagem de células-8
- FBS:
-
Soro fetal bovino
- EDC:
-
1-etil-3- (3-dimetilaminopropil) carbodiimida
- NHS:
-
N -hidroxisuccinimida
- Cur:
-
Curcumina
Nanomateriais
- Explorando a transformação digital com Fiix e IDC
- Demonstração de um biossensor flexível à base de grafeno para detecção sensível e rápida de células cancerosas do ovário
- Nanopartículas para terapia do câncer:progresso e desafios atuais
- Preparação de nanopartículas de mPEG-ICA carregadas com ICA e sua aplicação no tratamento de dano celular H9c2 induzido por LPS
- Síntese fácil de compósito CuSCN colorido e condutor revestido com nanopartículas de CuS
- Propriedades de síntese e luminescência de nanopartículas α-NaGdF4 / β-NaYF4:Yb, Er Core – Shell solúveis em água
- Mecanismo de condução e resistência aprimorada em RRAM baseado em HfO2 com tratamento de nitridação
- Promoção do crescimento celular SH-SY5Y por nanopartículas de ouro modificadas com 6-mercaptopurina e um peptídeo penetrador de neurônio
- Toxicidade de nanopartículas de CoFe2O4 revestidas com PEG com efeito de tratamento da curcumina
- Agentes teranósticos de última geração baseados em microcápsulas polieletrólitas codificadas com nanocristais semicondutores:desenvolvimento e caracterização funcional



