TiO2 dopado com nitrogênio e nitreto de carbono para catálise múltipla e sua atividade antimicrobiana
Resumo
Nitrogênio (N) e nitreto de carbono (C 3 N 4 ) TiO dopado 2 nanoestruturas foram preparadas usando a rota de co-precipitação. Quantidade fixa de N e várias concentrações (0,1, 0,2, 0,3% em peso) de C 3 N 4 foram dopados em TiO 2 treliça. Por meio de múltiplas técnicas, as propriedades estruturais, químicas, ópticas e morfológicas das amostras foram exaustivamente investigadas. Resultados de XRD verificados anatase TiO 2 presença ao longo do dopagem substitucional de N, enquanto maior grau de cristalinidade e aumento do tamanho do cristalito foram notados após a dopagem. O estudo HR-TEM revelou a formação de nanoestruturas incorporadas em C 3 bidimensional (2D) N 4 superfície de nanofolha. A composição elementar foi verificada usando a técnica EDS que confirmou a presença de dopante no produto. As características ópticas foram avaliadas com espectroscopia UV-vis, que representou o redshift no espectro de absorção, resultando em uma redução na energia do bandgap em N / C 3 N 4 -dopado TiO 2 amostras. A formação de ligações Ti – O – Ti e diferentes vibrações moleculares foram divulgadas por FTIR. Locais de armadilha e migração do portador de carga nos materiais foram avaliados com espectroscopia PL. Múltiplas atividades catalíticas (foto, sono e foto-sono) foram realizadas para avaliar o desempenho na degradação do corante da amostra preparada contra azul de metileno e ciprofloxacina. Além disso, a atividade antimicrobiana foi analisada contra Escherichia coli ( E. coli ) e Staphylococcus aureus ( S. aureus ) bactérias.
Introdução
Nos últimos anos, pesquisadores e cientistas prestaram mais atenção à crise de energia e à poluição ambiental e aquática. Na sociedade atual movida pela tecnologia, o consumo implacável de combustíveis fósseis está servindo para piorar essas questões [1]. Os combustíveis fósseis, a rica fonte de geração de energia, estão se contraindo em todo o mundo e os países desenvolvidos estão mudando para tecnologias sustentáveis e amigáveis ao meio ambiente. Por outro lado, a indústria têxtil produz águas residuais contendo 5 a 15% de corantes orgânicos não tratados. Cerca de 1 × 10 5 tinturas estão em uso globalmente e 7 × 10 5 toneladas de corante são geradas anualmente pela indústria têxtil em todo o mundo. A descarga dessas tinturas não tratadas não afeta apenas o ciclo do oxigênio e do nitrogênio conectado à fotossíntese, mas também causa grave deterioração estética [2]. Essas são algumas das questões ambientais sérias que precisam ser abordadas para sustentar a sociedade humana no longo prazo.
As propriedades dos materiais a granel dependem muito do tamanho e da estrutura [3]. Nesse sentido, semicondutores com escala nano com diversas propriedades são usados para aplicações fotocatalíticas e de degradação de corantes [4]. Vários metais de transição (TMs) Ti, Cu, Fe, Co e não metais (NMs) N, C, S etc. exibem propriedades físicas e químicas distintas [5]. A este respeito, uma combinação de TM (dióxido de titânio) e NM (nitrogênio) exibe propriedades aditivas. A combinação de semicondutores (com metais e óxidos metálicos) que possuem arranjos de bandas apropriados possuem aplicações notáveis na produção de energia e tratamento de água [6]. Óxidos de metais de terras raras, como TiO 2 , CdO, CoO, ZnO, etc., são os principais candidatos para muitas dessas aplicações. Entre estes, TiO 2 mantém atividade limitada na região visível devido ao seu alto valor de band gap (3,0 eV para a fase rutila, 3,2 eV para a fase anatase) [7], área de superfície baixa e alta recombinação elétron-buraco [8]. Em 1972, TiO 2 foi usado para a decomposição da água usando luz ultravioleta [9]. Desde então, a fotocatálise com semicondutores tem ganhado muita atenção devido às suas aplicações potenciais, como na produção de hidrogênio e limpeza ambiental [10]. Semicondutores com gap único (banda de valência ocupada e banda de condução não ocupada) servem como catalisadores adequados para reações fotoquímicas. Atualmente, o foco principal é a região de luz visível por meio do ajuste de gap de banda de semicondutor inorgânico.
TiO 2 é um semicondutor com características proeminentes, incluindo gap ajustável, rotas de síntese simples e natureza ecológica. Portanto, para melhorar a atividade fotocatalítica do TiO 2 nanoestruturas, a modulação de seu gap foi realizada pela adição de nitrogênio (N) para melhor absorção do espectro solar. N foi adicionado por meio do CH 4 N 2 Fonte O que contém 46% de sua concentração [7, 11]. Como resultado, bandgap de TiO 2 variou de 3,2 a 3,06 eV (substituição substitutiva de N por oxigênio) ou também pode ser de 3,2 a 2,46 eV (dopagem intersticial) que é mais preferível para luz visível [12,13,14]. Dopante C 3 N 4 é um material 2D que resolve o impedimento de baixa área de superfície do TiO 2 para aumentar a atividade fotocatalítica após a adição em várias concentrações e exibir uma resposta espectral mais ampla perto da região visível em comparação com TiO 2 puro . Além disso, C 3 N 4 tem aplicações promissoras devido a um gap adequado (2,7 eV) que tem a capacidade de aumentar a atividade fotocatalítica do TiO 2 para uso na degradação de corantes [15,16,17,18].
TiO 2 nanoestruturas também podem ser utilizadas como agente antibacteriano. A atividade antibacteriana do TiO 2 nanoestruturas são atribuídas a espécies reativas de oxigênio (ROS), como radicais hidroxila e peróxido de hidrogênio, que induzem estresse oxidativo severo na cepa bacteriana gerada sob iluminação. Portanto, TiO 2 é um candidato potencial para agente antibacteriano. O ROS gerado fornece um contato entre TiO 2 e células que matam a célula devido a danos provocados no DNA e na membrana celular que, em última análise, resulta no término do ciclo celular [19]. A atividade antimicrobiana do antibiótico preparado também depende da área de superfície, morfologia, cristalinidade, concentração / dosagem, pH da solução, agente de proteção e também da natureza dos microrganismos. Combinando os méritos de C 3 N 4 com TiO 2 e N, composto preparado é importante para resolver os problemas da crise ambiental em todo o mundo, incluindo poluentes orgânicos da água e contaminações microbianas patogênicas [20, 21]. Poucos estudos foram relatados para a atividade antibacteriana e degradação de diferentes corantes [5, 8, 11], melhor de nosso conhecimento, este novo estudo relata a eficiência de C 3 N 4 -dopado N / TiO 2 nanocompósitos sintetizados por via de co-precipitação.
Neste artigo, o método de co-precipitação foi usado para sintetizar TiO puro e dopado 2 nanoestruturas. Este estudo revelou a forte formação de contato do TiO 2 com dopantes (N e C 3 N 4 ) que aumentou eficientemente as atividades fotocatalíticas contra o azul de metileno e a ciprofloxacina, bem como a propriedade antibacteriana contra E. coli e S. aureus bactérias.
Detalhes Experimentais
Materiais
Ureia (CH 4 N 2 O) (99%) e butóxido de titânio (IV) (Ti (C 4 H 9 O) 4 ) (98%) foram recebidos da Sigma-Aldrich, Alemanha, enquanto o etanol (C 2 H 5 OH) (95%) foi adquirido da Panreac. Nitreto de carbono (C 3 N 4 ) foi obtido a partir da pirólise de CH 4 N 2 O no laboratório (Fig. 1a). Todos os reagentes foram usados sem purificação adicional.
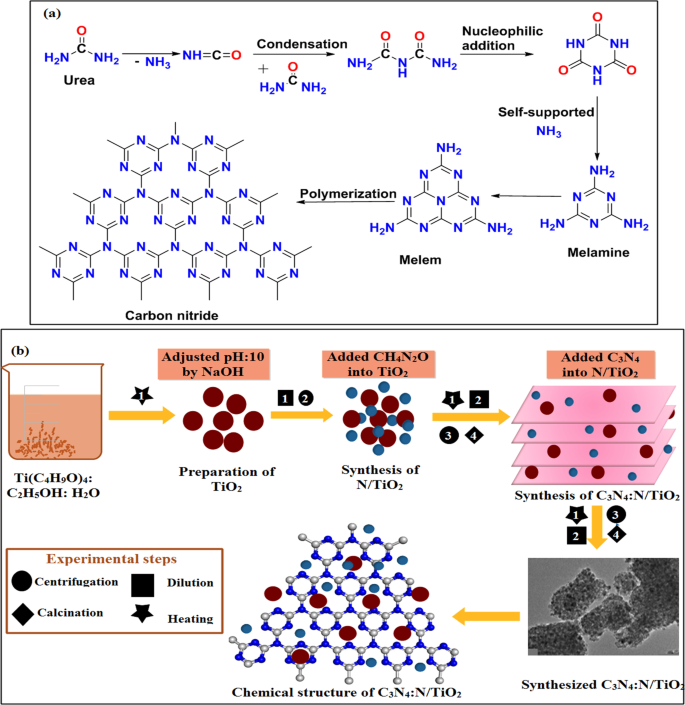
a Mecanismo de síntese de C 3 N 4 . b Ilustração esquemática do processo de síntese para C 3 N 4 :N / TiO 2
Preparação do TiO 2 Nanoestruturas
Dióxido de titânio (TiO 2 ) foi preparado adotando o método de co-precipitação, em que 55 mL de etanol, 13 mL de Ti (C 4 H 9 O) 4 e 5 mL de água desionizada (água DI) foram misturados e agitados vigorosamente durante 30 min. Etanol (~ 100 mL) e DIW (~ 100 mL) foram adicionados à solução agitada por 2 h a 50 ° C. O pH da solução foi mantido até ~ 10 usando solução de NaOH (0,5 M). Em seguida, a solução foi centrifugada e seca a 90 ° C por 10 h. Depois disso, a amostra foi recozida a 450 ° C por 4 h para atingir nanoestruturas de anatase estáveis (Fig. 1b).
Preparação de C 3 N 4 N-TiO dopado 2
Várias concentrações (0,1, 0,2, 0,3% em peso) de C 3 N 4 foi dopado em N-TiO 2 mistura. Ti (C 4 H 9 O) 4 (17,45 mL), CH 4 N 2 O (3 g), C 2 H 5 OH e água DI foram adicionados sob agitação vigorosa. As amostras foram sonicadas para mistura homogênea. As amostras sonicadas foram centrifugadas a 4000 rpm e secas a 90 ° C por 10 he recozidas a 450 ° C por 4 h para obter nanoestruturas estáveis. Seis amostras foram preparadas e nomeadas como TiO 2 , TiO dopado com nitrogênio 2 (N-TiO 2 como 0:1), nitreto de carbono puro (C 3 N 4 1:0) e diferentes concentrações de C 3 N 4 em N-TiO 2 nomeado como 0,1:1, 0,2:1, 0,3:1.
Avaliação da atividade fotocatalítica
A atividade fotocatalítica (PCA) dos catalisadores sintetizados foi avaliada estimando a taxa de degradação de uma combinação de dois corantes tóxicos, nomeadamente azul de metileno (MB) e ciprofloxacina (CF) em solução aquosa. A solução estoque de corantes foi preparada em DIW (10 mg / 1000 mL) e 10 mg de catalisador preparado (TiO puro 2 , C 3 N 4 , 0:1, 0,1:1, 0,2:1, 0,3:1) foi adicionado a 50 mL de solução estoque. Após agitação homogênea, a solução foi colocada em uma caixa selada sob lâmpada de mercúrio (Hg) (comprimento de onda de 400 a 700 nm e potência de 400 W) a ~ 15 cm de distância para evitar superaquecimento. Após um intervalo de 20 minutos, 3 mL de solução foram separados para verificar a concentração de corantes presentes na solução, utilizando espectroscopia UV-Vis. A eficiência de degradação foi determinada pela fórmula dada como:
$$ {\ text {Degradação}} \, {\ text {eficiência}} \, (\%) =\ frac {Co - Ct} {{Co}} \ vezes 100 $$ (1)
onde C o e C t concentração inicial e final de corante no tempo t =0 e no tempo final t, respectivamente [22].
Ensaio de eliminação radical 2-difenil-1-picrilhidrazil (DPPH)
A atividade de eliminação de radicais livres de todas as amostras foi examinada usando o método relatado por Kibiti e Afolayan [23] com certas modificações. Várias concentrações de TiO puro 2 , C 3 N 4 , e C 3 N 4 TiO dopado 2 nanopartículas (0–500 µg / mL) foram preparadas e misturadas com igual volume de solução DPPH 0,1 mM. A mistura reaccional foi submetida a vórtice e incubada durante 30 min no escuro à temperatura ambiente. O ácido ascórbico foi empregado como antioxidante de referência. A absorvância da mistura foi medida a 517 nm usando espectrofotômetro. A% capacidade de eliminação foi calculada usando a equação:
$$ {\ text {DPPH}} \, {\ text {eliminação}} \, {\ text {rate}} \ left (\% \ right) =\ frac {{\ left ({A_ {0} - A_ {1}} \ right)}} {{A_ {0}}} \ vezes 100 $$
onde A 0 é a absorção de controle (Metanol + DPPH) e A 1 é a absorbância da amostra.
Segregação e identificação bacteriana
Com a avaliação antibacteriana da amostra de leite mastítico ovino foi realizada em S. aureus e E. coli isolado após triagem inicial em ágar sangue ovino (5%) e finalmente em ágar sal de manitol (MSA) e ágar MacConkey (MCA), respectivamente. Os protocolos de coloração de coagulase, catalase e Gram foram usados para classificar os produtos extraídos (bioquímica e morfologicamente).
Atividade Antimicrobiana
O procedimento de difusão do poço foi adaptado para avaliar os efeitos antibacterianos de N e C 3 N 4 TiO co-dopado 2 esfregando 1,5 × 10 8 CFU mL −1 de isolados bacterianos purificados em MCA e MSA, separadamente. Em pratos esfregados, poços de 6 mm de profundidade foram perfurados com broca de poço asséptica. Várias diluições de nanomateriais dopados, por exemplo, 500 e 1000 µg / 50 µL foram colocadas em poços como dosagem mínima e máxima em contraste com ciprofloxacina como controle positivo (5 μg / 50 μL) e DIW (50 μL) como controle negativo. A sensibilidade de todas as amostras preparadas foi medida com um compasso Vernier após incubação noturna (37 ° C) das placas de Petri. A avaliação antibacteriana foi contemplada pela utilização de análise de variância unilateral [24].
Caracterização do material
Transição de fase e estrutura cristalina de TiO dopado binário 2 foi examinado com XRD utilizando o sistema de espectro Bruker com Cu K-α monocromático ( λ =0,154 nm e 2 θ =10 ° –80 °) com uma taxa de varredura de 0,05 ° por minuto. O estudo de grupos funcionais e análise química foi realizado utilizando espectrômetro FTIR (PerkinElmer 3100) com faixa de espectros de 4000 a 400 cm -1 em 32 varreduras e uma resolução de 0,2 cm −1 . O estudo óptico foi realizado com espectrofotômetro Genesys 10S (variando de 200 a 800 nm). O espaçamento entre camadas e a morfologia da superfície dos produtos preparados foram inspecionados por meio de espectrômetro HR-TEM e EDS, JSM-6460LV e HRTEM Philips CM30 e JEOL JEM 2100F. A espectroscopia de fotoluminescência foi realizada para investigar a transferência e recombinação de e - para h + pares utilizando um espectrofluorômetro (JASCO, FP-8300).
Resultados e discussão
Para analisar a estrutura do cristal, a pureza da fase e o tamanho dos cristalitos, o XRD foi empregado no controle e N / C 3 N 4 -dopado TiO 2 em 2 θ faixa de 10 ° -80 ° (Fig. 2a). Os espectros adquiridos revelaram picos a 25,4 °, 37,8 °, 48,1 °, 53,9 °, 55,1 °, 62,7 °, 68,6, 70,3 ° e 75,1 ° atribuídos a (101), (004), (200), (105), (211 ), (204), (116), (220), (215) planos de formação de anatase tetragonal, respectivamente (JCPDS no. 21-1272). Para N-TiO 2 composto, nenhuma mudança significativa no espectro de XRD foi observada, o que pode ser referido a uma concentração relativamente mais baixa de N no composto. Estrutura hexagonal para C 3 N 4 foi confirmada a partir dos picos gerados a 13,2 ° (100) e 27,4 ° (002) refletindo o espectro padrão (JCPDS nº 87-1526). Nenhuma mudança nos picos foi observada após dopagem para amostras de concentração de 0,1:1 (inferior) e 0,2:1 (intermediário) e 0,3:1 (superior), no entanto, a nitidez nos picos indicou o acoplamento bem-sucedido de C 3 N 4 :N / TiO 2 , resultando em maior cristalinidade e qualidade estrutural [25, 26]. O espaçamento entre camadas de TiO original 2 (~ 0,352 nm) e N-TiO 2 (~ 0,35 nm) foram calculados a partir do pico mais intenso (101) usando a fórmula de Debye-Scherer que foram posteriormente verificados por observação de HR-TEM.
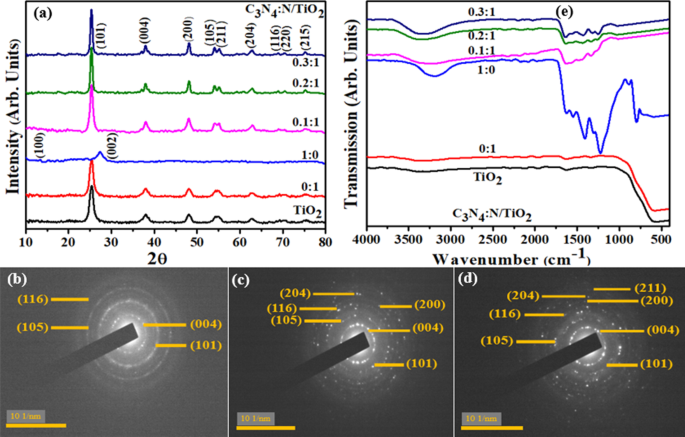
a Padrão de XRD. b Espectros de FTIR. c - e Perfis SAED de TiO co-dopado como sintetizado 2 . c TiO 2 . d 0:1. e 0,1:1
Perfis SAED (Selected Area Electron Diffraction) de TiO primitivo 2 , 0:1 (N-TiO 2 ) e uma amostra de 0,1:1 são fornecidas na Fig. 2b – d. As imagens foram indexadas com planos de difração (004), (101), (105), (116), (200), (204), (211) confirmados por resultados de XRD, mostrando a estrutura de cristal tetragonal de TiO 2 .
Vários grupos funcionais e composições químicas presentes nas amostras preparadas foram identificados usando a análise FTIR (Fig. 2e). Em espectros adquiridos, pode ser visto que a banda de absorção estacionada em 400-700 cm −1 corresponde aos modos de vibração de alongamento Ti – O e Ti – O – Ti, que indicavam TiO 2 formação. Esta banda de vibração foi associada a prótons de água fisiosorvidos em amostras sintetizadas [27,28,29]. Banda observada em cerca de 1635 e 3200-3500 cm −1 referido ao grupo hidroxil (O – H) e água fisicamente absorvida no TiO puro 2 superfície, respectivamente [30, 31]. Em C 3 N 4 espectro, banda de absorção em 1624 cm −1 foi atribuído a modos vibracionais de alongamento de heterociclo C-N [32], enquanto quatro bandas em 1232, 1304, 1411, 1556 cm −1 foram referidos aos modos vibracionais de alongamento C – N aromático [33, 34]. Notavelmente, todos os picos característicos de TiO 2 e C 3 N 4 pode ser observada, validando a formação de C 3 N 4 :N / TiO 2 nanoestrutura.
A morfologia e a estrutura cristalina do TiO puro 2 (Fig. 3a), 0:1, 1:0, 0,1:1 e 0,3:1 nanoestruturas foram estudadas por análise TEM. A Figura 3b representa N-TiO 2 composto com alta energia superficial que leva à agregação [35] e a Fig. 3c é a ilustração de C 3 N 4 , uma nanofolha mesoporosa (NS). Após C 3 N 4 além disso, N-TiO 2 o composto foi incorporado e bem distribuído em NS, o que também confirmou aproximadamente o C 3 N 4 embalagem, conforme ilustrado na Fig. 3d. Este contato interfacial íntimo entre N-TiO 2 composto e NS foi necessário para a atividade fotocatalítica. Após dopagem, a cristalinidade das nanoestruturas preparadas melhorou e, após dopagem mais elevada, N-TiO envolto em NS 2 compôs e, finalmente, fez um contato interfacial eficiente (Fig. 3e). Na imagem HR-TEM de 0,1:1 (Fig. 3c ′), o espaçamento entre camadas foi calculado em 0,35 e 0,33 nm pertencente a (101) e (002) planos de cristal de N-TiO 2 composto e C 3 N 4 , respectivamente, em consistência com os resultados de XRD. O espaçamento entre camadas foi medido para cada amostra usando o software Gatan, fornecido na Fig. 3á-d́.

a - e Micrografias HR-TEM de TiO puro 2 , 0:1, 1:0, 0,1:1, 0,3:1, respectivamente. a ′ - d ′ Espaçamento entre camadas medido usando imagens HR-TEM de TiO original 2 , 0:1, 0,1:1, 0,3:1, respectivamente
A fim de verificar o contato interfacial posterior, mapeamento EDX de C 3 conforme preparado N 4 (1:0) e 0,3:1 (maior dopagem) amostras foram conduzidas para inspecionar o padrão de distribuição de seus componentes. Como revelado na Fig. 4a, cinco componentes (C, N, Ti, O, Na) foram encontrados para estar uniformemente dispersos na amostra dopada superior. O sódio (Na) veio do hidróxido de sódio (NaOH) adicionado para manter o pH da solução até ~ 10. Combinado com os resultados de HR-TEM e XRD, recomendou que dentro de 0,3:1 amostra, N e TiO 2 as nanopartículas estão certamente bem dispersas dentro da embalagem C 3 N 4 NS e indicou contato íntimo também.
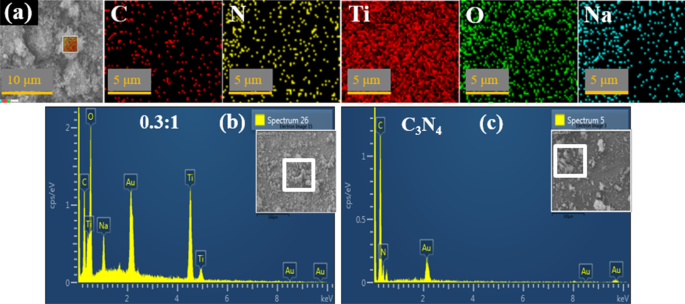
a Mapeamento de 0,3:1 amostra para garantir a distribuição de todos os componentes ( b - c ) Imagens EDX de 0,3:1 (dopagem mais alta) e 1:0, respectivamente
A composição elementar foi avaliada por EDX para confirmar a pureza de 0,3:1 (dopagem superior) e 1:0 (Fig. 4b-c). Conforme ilustrado na Fig. 4b, Ti indicou picos em 4,5 e 4,95 keV, pico de oxigênio (O) em 0,5 keV, picos C e N em 0,3 e 0,4 keV, juntamente com várias outras posições foram detectados, confirmando a incorporação bem-sucedida de dopante binário espécies com anatase TiO 2 .
Para determinar o desempenho óptico de TiO não dopado e dopado 2 , A espectroscopia UV-vis foi usada na faixa de 300-550 nm. TiO 2 tem pico de absorbância característico encontrado em torno de ~ 350 nm, com N-doping, ligeiro desvio para o vermelho foi observado no espectro de absorção causado pela sobreposição de 2 p orbitais de O 2 e N, como mostrado na Fig. 5a [36]. Um aumento na absorbância espectral foi observado em C 3 N 4 dopagem em N-TiO 2 composto, atribuído à planarização completa de C 3 N 4 (não sobreposição de orbitais adjacentes). A capacidade de absorção aprimorada na região UV foi atribuída à dispersão interna e ao efeito harmonioso do N-TiO 2 e C 3 N 4 π de para π * e n para π * transições, respectivamente, conforme representado na Fig. 5b [37]. Picos desviados para o vermelho devido à engenharia molecular de C 3 N 4 em N-TiO 2 composto que potencialmente avançada capacidade de absorção e transição de portadores de carga [38]. A transformação de Tuac foi aplicada para calcular bandgaps das amostras preparadas. Para TiO 2 o bandgap foi calculado em 3,2 eV e uma diminuição gradual nas energias do bandgap foi observada perto do nível de Fermi após adicionar N e C 3 N 4 a ~ 2,9 eV, conforme mostrado na Fig. 5c – h [39].
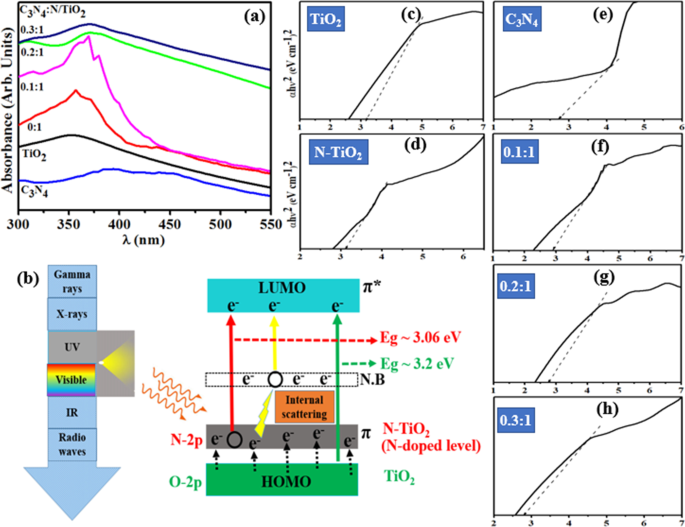
a Espectro de absorbância óptica ( b ) possíveis transições e espalhamento interno em espectroscopia UV-vis ( c - h ) determinação de bandgap de TiO 2 , N-TiO 2 , C 3 N 4 , 0,1:1, 0,2:1 e 0,3:1, respectivamente
Espectros de emissão PL de TiO 2 e seus compostos foram calculados de 410 a 520 nm com um comprimento de onda excitado de 350 nm em temperatura ambiente, conforme ilustrado na Fig. 6a. O espectro revelou a migração e o buraco do elétron (e - para h + ) eficiência de recombinação de pares [40]. Pico característico de TiO 2 a 455 nm mostrou a maior recombinação de e - para h + pares que limitaram significativamente o PCA do TiO 2 enquanto a taxa de recombinação diminuiu após a co-dopagem (N e C 3 N 4 ) O processo de Shockley-Read-Hall (SRH) explica as transições de bandgap da banda de valência para a sub-banda e depois para a banda de condução [41]. A sub-banda na borda da banda de condução facilitou o PCA [42], portanto, para uma amostra de dopagem mais alta, a taxa de recombinação mais baixa propôs um transporte de carga mais alto gerado pela foto que aumentou internamente o PCA de 0,3:1.
Mecanismo de reação e cinética
O seguinte mecanismo estava envolvido no PCA do catalisador preparado (ver Fig. 7):
- 1.
Fotoexcitação:O PCA primeiro envolve a fotoexcitação que é iniciada pelo processamento dos fótons com energia igual ou maior do que a energia do bandgap (E g ) de material. Esses fótons estimulam elétrons de valência / banda inferior (VB) e os migram para condução / banda superior (CB). Os elétrons deixam buracos no VB, resultando em e - -h + geração de pares, conforme mostrado na equação abaixo.
$$ {\ text {TiO}} _ {2} + h \ nu \ to {\ text {TiO}} _ {2} \ left ({e ^ {-}} \ right) + h ^ {+} $ $ (2) - 2.
Ionização da água:Buracos criam OH • radicais livres após entrarem em contato com a água (H 2 O).
$$ {\ text {H}} _ {2} {\ text {O}} + h ^ {+} \ to {\ text {OH}} ^ {\ cdot} + {\ text {H}} ^ { +} $$ (3)
O OH • O radical age como um agente oxidante na superfície do semicondutor que tem como alvo as moléculas adsorvidas e participa da mineralização.
- 3.
Ionosorção de oxigênio:fotogenado es - entra em contato com as moléculas de água e gera OH - (grupo hidroxila) enquanto es - são capturados por moléculas de O 2 para produzir O 2 • ˗ (radical superóxido) [43].
$$ {\ text {O}} _ {{2}} + {\ text {e}} ^ {-} \ to {\ text {O}} _ {{2}} ^ {\ cdot -} $$ (4)
O radical superóxido contribui nos ciclos de oxidação e inibe a recombinação de e - e h + enquanto mantém o TiO 2 neutro.
- 4.
Protonação de superóxido:íons superóxido (O 2 ¯ ) dá H 2 O • (radical hidroperoxilato protonado) e finalmente H 2 O 2 gerar OH • radical que é altamente reativo.
$$ {\ text {O}} _ {{2}} ^ {\ cdot -} + {\ text {H}} \ rightleftharpoons {\ text {HOO}} ^ {\ cdot} $$ (5) $$ {\ text {2HOO}} ^ {\ cdot} \ to {\ text {H}} _ {{2}} {\ text {O}} _ {{2}} + {\ text {O}} _ { {2}} $$ (6) $$ {\ text {H}} _ {{2}} {\ text {O}} _ {{2}} \ to {\ text {2OH}} ^ {\ cdot } $$ (7) $$ {\ text {Dye}} \, \, ({\ text {MB}} \, {\ text {and}} \, {\ text {CF}}) + {\ text {OH}} ^ {\ cdot} \ to {\ text {CO}} _ {{2}} + {\ text {H}} _ {{2}} {\ text {O}} \ left ({{ \ text {dye}} \, {\ text {intermediários}}} \ right) $$ (8) $$ {\ text {Dye}} + {\ text {h}} ^ {+} \ left ({{ \ text {VB}}} \ right) \ to {\ text {oxidação}} \, {\ text {produtos}} $$ (9) $$ {\ text {Dye}} + {\ text {e}} ^ {-} \ left ({{\ text {CB}}} \ right) \ to {\ text {redução}} \, {\ text {produtos}} $$ (10)
As reações de oxidação / redução ocorreram na superfície dos fotocatalisadores fotoexcitados [44, 45].
O PCA das amostras preparadas foi avaliada quanto à degradação do corante MB e CF sob irradiação de luz visível replicada (Fig. 6b). O teste em branco demonstrou que MB e CF não podem ser degradados sob irradiação de luz na ausência de catalisador, portanto, pode-se deduzir que MB e CF eram estáveis. Como indicado na Fig. 6c, C3N4 degradou o corante direcionado em até 45% e a atividade fotocatalítica aumentada de nanoestruturas foi observada com o aumento de C 3 N 4 concentração que efetivamente degradou MB e CF. No caso de N-TiO 2 , extensão relativamente maior de degradação (58%) ocorreu em comparação com TiO 2 (32%) enquanto a amostra dopada mais alta (0,3:1) apresentou degradação máxima de 85% em 80 min. As constantes de taxa de reação aparente ( k ) foram determinados para todos os espécimes medindo inclinações de ln ( C o / C t ) contra o enredo do tempo. Além disso, k valor de 0,3:1 também foi maior do que outros, que foi ~ 2,5 vezes maior do que o TiO original 2 (Fig. 6d).
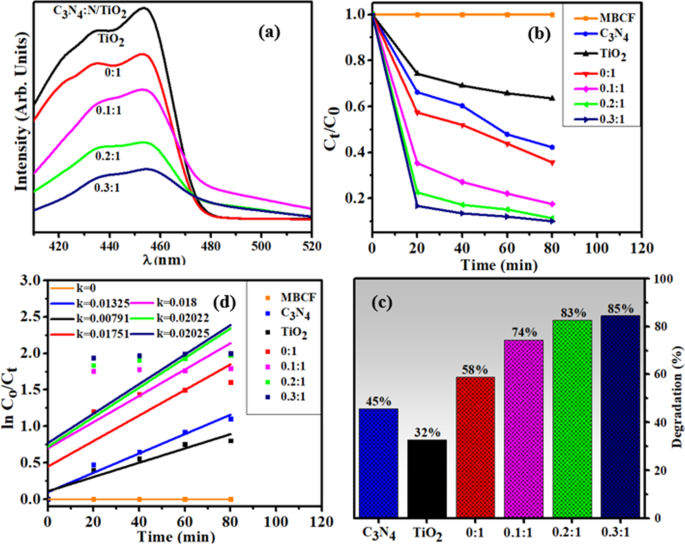
a Espectros PL ( b ) Gráfico da razão de concentração (C t / C o ) versus tempo ( c ) porcentagem (%) de degradação de todas as amostras ( d ) plot de ln (C o / C t ) versus espectros de tempo para redução de corante
O PCA aprimorado de nanoestruturas pode ser atribuído a estas medidas:em primeiro lugar, o C 3 N 4 a folha tem uma superfície maior que encoraja uma ampla adsorção dentro do catalisador e fornece locais ativos adicionais para os reagentes circundantes. Em segundo lugar, após a incorporação de N e C 3 N 4 em TiO 2 , maior eficiência de separação de carga induzindo novos níveis de energia dentro do intervalo de banda proibido de TiO 2 . Esses níveis induzidos atuam como locais de captura para elétrons fotoinduzidos, aumentando a eficiência de transferência de elétrons, o que, em última análise, melhorou o desempenho de degradação dos nano-catalisadores. Em terceiro lugar, devido à borda da banda íntima e bem combinada, N-TiO 2 coleta elétrons fotoinduzidos do CB de C 3 N 4 melhorando assim a eficiência de separação de carga. Em geral, C 3 N 4 produz e - para h + pares sob luz visível que se recombinam rapidamente e apenas uma pequena fração de e - participar do PCA. Considerando que quando TiO 2 foi modificado por dopantes binários para formar um nanocompósito, elétrons fotogerados no CB de C 3 N 4 pode mover diretamente para CB de N-TiO 2 composto, como mostrado na Fig. 7, porque CB borda de C 3 N 4 foi mais negativo do que N-TiO 2 . Os parâmetros mencionados acima eventualmente aumentaram a atividade fotocatalítica geral dos nanocompósitos preparados [46,47,48].
A atividade sonocatalítica (SCA) também foi medida pela degradação de MB e CF por meio da rota de ultra-sonicação. Da mesma forma que para PCA, as amostras foram coletadas após intervalo de 20 min em SCA. Conforme ilustrado na Fig. 8c, C3N4, TiO 2 , N-TiO 2 os compósitos degradaram o MB e o CF em até 36%, 20% e 27% em 80 min, enquanto para dopagem mais baixa, a atividade da nanoestrutura de 0,1:1 aumentou até 60% e depois diminuiu para concentrações de dopagem mais altas. Para dopagem mais baixa, o catalisador formou as microbolhas e carregou sítios mais ativos para o crescimento da nucleação, gerou ainda mais radicais reativos [49] e para dopagem adicional, os sítios ativos dos catalisadores preparados foram insuficientes para serem ocupados pelas moléculas de corante. O segundo motivo possível pode ser excesso de C 3 N 4 quantidade que restringiu a energia obtida da onda de ultra-som [50].
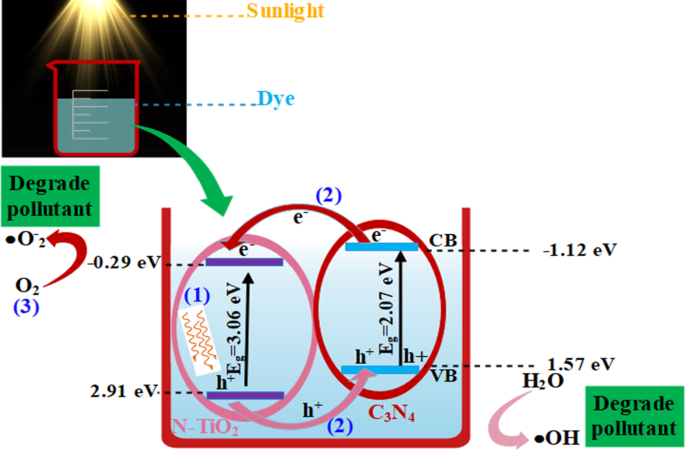
Mecanismo de degradação de corantes na presença de fotocatalisador preparado
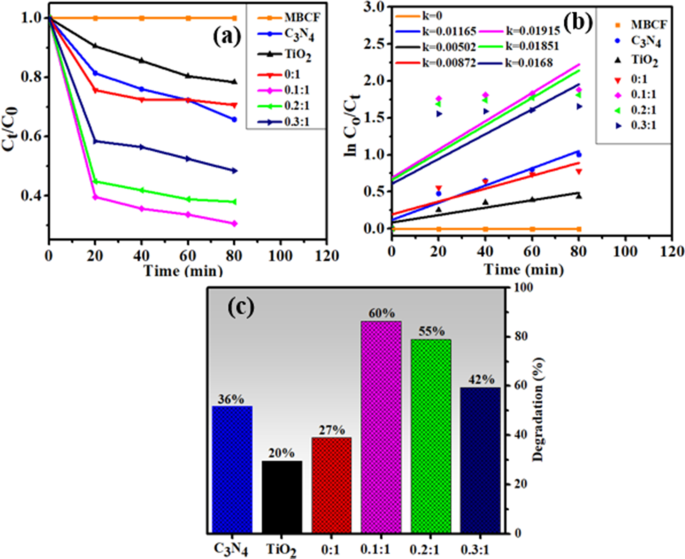
a Gráfico da razão de concentração ( C t / C o ) versus tempo, b trama de ln ( C o / C t ) versus espectros de tempo para redução de corante, c porcentagem (%) de degradação das amostras preparadas
As constantes de taxa ( k ) foram calculados para a cinética de degradação do sono medindo inclinações em ln ( C o / C t ) contra o tempo, conforme mostrado na Fig. 8b. PCA e SCA de TiO original 2 e C 3 N 4 eram menos eficientes, portanto, N / C 3 N 4 -dopado TiO 2 compósito revelou-se como um potencial catalisador para a degradação do corante.
O efeito combinado de PCA e SCA foi avaliado posteriormente ajustando o sonômetro sob a fonte de luz para todas as amostras sintetizadas. Os resultados obtidos revelaram aquele primitivo C 3 N 4 , TiO 2 e N-TiO 2 corante degradado composto de até 60%, 40% e 55%, respectivamente. Para dopagem mais baixa, a nanoestrutura 0,1:1 degradou MB e CF em até 86%, causado pelo efeito combinado de PCA e SCA. Mas, para dopagem adicional e superior (embora auxiliado por PCA), os locais ativos foram insuficientes, o que pode ser atribuído ao efeito dominante de SCA que subsequentemente diminuiu o desempenho de degradação. Além disso, a quantidade excedente de C 3 N 4 e a mistura não homogênea de catalisadores pode causar aglomeração que pode limitar a energia obtida da onda de ultrassom e da fonte de luz visível (Fig. 9c).
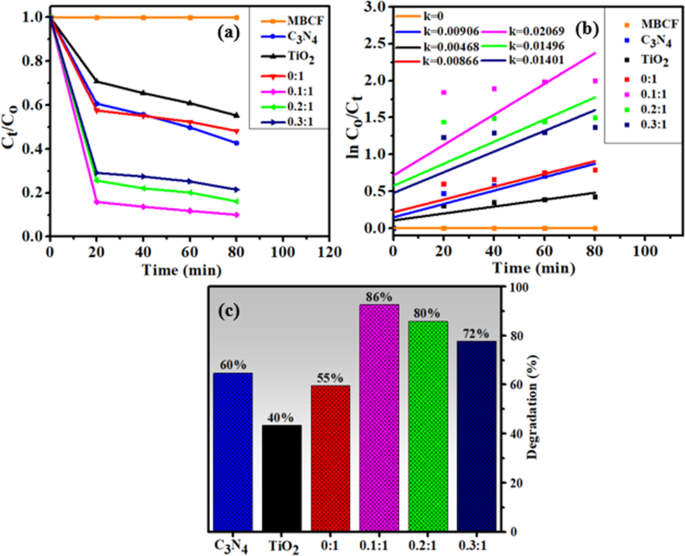
a Gráfico da razão de concentração ( C t / C o ) versus tempo, b trama de ln ( C o / C t ) versus espectros de tempo para redução de corante, c porcentagem (%) de degradação de todas as amostras preparadas
Para a cinética de degradação de foto-sono, as constantes de taxa ( k ) foram estimados calculando as inclinações em ln ( C o / C t ) contra o tempo, conforme manifestado na Fig. 9b.
Antioxidant characteristics of compounds is tied to their electron or hydrogen atom donating capability to DPPH free radical, such that they create stable diamagnetic compounds [51]. This DPPH free radical’s reduction capability can be examined by lowering the absorbance at 517 nm.
All synthesized compounds were evaluated for antioxidant activity using a DPPH radical scavenging assay. Using ascorbic acid as a reference, DPPH disappearance was evaluated spectrophotometrically at 517 nm. In this study, it was discovered that the DPPH activity of the nanoparticles increased in a dose-dependent manner (Fig. 10). It is confirmed that Pristine TiO2 showed high scavenging activity (50.22%) at concentration of 500 µg/mL compare to C3 N 4 . Because TiO2 may form OH . , O 2 .− and 1 O 2 reactive oxygen species, which have the potential to bond with the DPPH free radical [51,52,53]. Some recent studies have reported 1 O 2 to be the dominant active specie in the degradation of MB dye under solar irradiation [53, 54]. While N-TiO2 showed DPPH scavenging up to 57.34% that is 7% higher than that of TiO2 . This considerable increase is resulted from the addition of a doping agent which lowers the size of TiO2 nanoparticles and increases their reactivity [55, 56]. In case of C3 N 4 doped TiO2 with mass ratio of 0.1:1, scavenging activity increased up to 84.45% that might be the availability of sufficient amount of nitrogen from doped C3 N 4 . But increasing the concentration of doped C3 N 4 on N-TiO2 , scavenging activity was decreased. This was due to high C3 N 4 concentration caused an increase in turbidity of test sample, which in turn caused an antagonistic interaction resulted in a decrease scavenging activity (84.45–70.75%) [50].
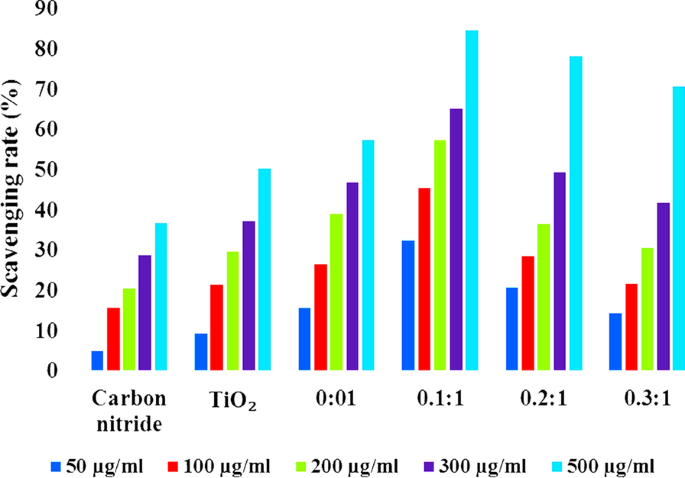
DPPH radical scavenging activity of synthesized nanostructures
Antimicrobial activity of binary doped TiO2 was conducted using well diffusion technique (Fig. 11) against S. aureus e E. coli as depicted in Table 1. Statistically, significant inhibition areas (p < 0.05) for minimum and maximum concentrations of doped nanostructures, respectively against Escherichia coli (1.05–2.00 mm) and (1.35–2.25 mm) were attained. Broadly, zero activity was observed for TiO2 and N-TiO2 against Staphylococcus aureus at minimum and maximum concentrations while binary-doped samples showed substantial activity against Escherichia coli at both concentrations. Similarly, C3 N 4 depicted 1.60 mm inhibition area at maximum concentration only against Escherichia coli .
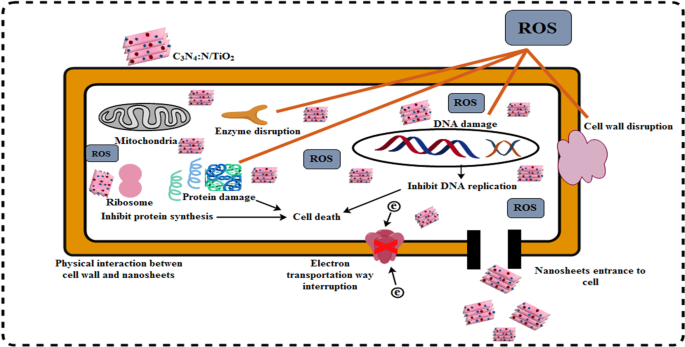
Illustration of antimicrobial activity of prepared sample
Anti-bacterial effectiveness is swayed by the scale of nanoparticles so oxidative stress of invented nanocomposites is dependent on scale and concentration [57]. An electrostatic contact between bacteria and nanoscale structures results in the generation of reactive oxygen species, which are lethal to cells [24, 58]. Oxygen reactive species (ROS) encircle bacteria external membrane and through extrusion and bulge of cytoplasmic components bacteria death occurs [59]. Micro pathogens ruin also proceeds when cations strongly bind with negative components of bacterial cells. Cations cause dysfunction in bacterial ribosomal activities and enzymatic degradation resulting collapse [60]. Two reactions have been identified as feasible for the bactericidal mechanism of nanomaterials, one of which involves strong interaction between the cations Ti +4 and bacterial cells, resulting in the formation of negativized sections and subsequent collapse, and the other of which involves electronic excitation of the TiO2 valance band surface via irradiation. Additionally, the electrical O2 reaction generates O −2 radicals, which results in the production of H2 O 2 . The resultant O −2 species play a critical role in the breakdown of lipid or protein molecules on the bacteria's external cell membrane [61, 62].
Conclusão
Binary-doped TiO2 was synthesized through co-precipitation method and synthesized samples were evaluated for photo, sono and photo-sono catalytic degradation of MB and CF dyes and bactericidal activities. The strong contact formation between dopants and TiO2 efficiently increased e − to h + pairs separation efficiency induced by light. The narrow bandgap of C3 N 4 :N/TiO2 composite was accredited to N as well as C3 N 4 incorporation in pristine TiO2 . The prepared samples showed efficient degradation performance under visible light as well as under ultrasonic waves (SCA). Moreover, the combined effect of photo and sono catalysis was also evaluated for prepared catalysts for comparative study. Furthermore, prepared nanocomposites exhibited notable efficacy against S. aureus e E. coli bacteria as well. We believe that this study will open new insights into the fabrication of novel, binary doped heterojunctions for effective dye degradation and bactericidal applications in the future.
Disponibilidade de dados e materiais
Todos os dados estão totalmente disponíveis sem restrição.
Abreviações
- C3 N 4 :
-
Carbon nitride
- EDS:
-
Espectroscopia de energia dispersiva de raios-X
- FTIR:
-
Espectroscopia de infravermelho com transformada de Fourier
- FESEM:
-
Microscopia eletrônica de varredura por emissão de campo
- G + ve:
-
Gram-positivo
- G −ve:
-
Gram negativo
- GO:
-
Grafeno
- HR-TEM:
-
Microscopia eletrônica de transmissão de alta resolução
- JCPDS:
-
Comitê conjunto sobre padrões de difração de pó
- TiO 2 :
-
Dióxido de titânio
- UV–vis:
-
Ultra-violet visible spectroscopy
- XRD:
-
Difração de raios X
Nanomateriais
- Materiais:Vidro e PP reforçado com fibra de carbono para automotivo
- Compostos de grafeno e polímero para aplicações de supercapacitor:uma revisão
- Rota de eletrofiação em uma etapa de nanofibras de Rutilo TiO2 modificadas com SrTiO3 e suas propriedades fotocatalíticas
- Rumo aos nanofluidos de TiO2 - Parte 2:Aplicações e desafios
- Fabricação e caracterização de novo composto de suporte de catalisador anódico de nanofibra de carbono Tio2 para célula de combustível de metanol direto via método de eletrofiação
- Propriedades ópticas estruturais e de infravermelho próximo visível de TiO2 dopado com Cr para pigmentos frios coloridos
- Uma Sonda Fluorescente Resumível BHN-Fe3O4 @ SiO2 Híbrida Nanoestrutura para Fe3 + e sua Aplicação em Bioimagem
- Um método fácil para carregar nanopartículas de CeO2 em arranjos de nanotubos de TiO2 anódicos
- Um método fácil para preparação de heterojunção Cu2O-TiO2 NTA com atividade fotocatalítica visível
- Um novo material de conversão ascendente de Ho3 + -Yb3 + -Mg2 + TiO2 tri-dopado e suas aplicações para células solares de perovskita



