CoFe2O4-pontos quânticos para terapia fototérmica / fotodinâmica sinérgica de câncer de pulmão de células não pequenas por meio do desencadeamento de apoptose por meio da regulação da via PI3K / AKT
Resumo
O câncer de pulmão de células não pequenas (NSCLC) tornou-se o segundo tumor maligno mais diagnosticado em todo o mundo. Como nosso interesse de longo prazo na busca de nanomateriais para desenvolver estratégias de terapias contra o câncer, aqui construímos o novo CoFe 2 O 4 - pontos quânticos (QDs) com excelente propriedade fototérmica / fotodinâmica sinérgica que suprimiu o NSCLC de forma eficiente, sem toxicidade aparente. Mostramos que a combinação de CoFe 2 O 4 O tratamento -QDs + NIR induz apoptose de células NSCLC. Além disso, o CoFe 2 O 4 O tratamento -QDs + NIR também promove a geração de espécies reativas de oxigênio para desencadear a morte celular por meio da regulação da via PI3K / AKT. Além disso, o CoFe 2 O 4 O tratamento -QDs + NIR elimina com sucesso os xenoenxertos tumorais in vivo sem efeitos tóxicos aparentes. Juntos, relatamos que os novos nanomateriais CoFe 2 O 4 -QDs podem exibir terapia fototérmica sinérgica aprimorada e efeito da terapia fotodinâmica em matar NSCLC sem toxicidade, o que pode ser um fotossensibilizador promissor para terapia com NSCLC.
Introdução
O câncer é a principal causa de morte e traz grande fardo para a família e a sociedade, entre as quais o câncer de pulmão ocupa o segundo tipo de câncer mais diagnosticado e o primeiro de morte relacionada ao câncer em 2020 [1, 2]. Conforme relatado, o câncer de pulmão de células não pequenas (NSCLC), que representa cerca de 85% de todos os cânceres de pulmão, é caracterizado por alta incidência e mortalidade [3, 4]. Recentemente, apesar das opções cirúrgicas, grande esforço tem sido feito para desenvolver quimioterapias ou imunoterapias para tratar o NSCLC. Por exemplo, inibidores mutantes de EGFR e inibidores de KRAS provaram ser eficazes e ainda existem mais novos inibidores de ALK em andamento [5,6,7,8,9]. Anti-PDL1 e anti-CLTA4, tais inibidores do ponto de verificação imunológico também trazem eficácia promissora e prolongam o benefício de sobrevivência [10,11,12]. No entanto, a taxa de resposta a esses medicamentos difere de paciente para paciente e os efeitos colaterais, especialmente a resistência aos medicamentos, não devem ser negligenciados [13, 14]. Portanto, desenvolver novas estratégias terapêuticas, que sejam menos invasivas, é uma urgência e também uma necessidade para pesquisas e tratamentos clínicos em NSCLC.
Com base no progresso recente, o uso de nanomateriais para realizar terapia fototérmica (PTT) e terapia fotodinâmica (TFD) tem despertado grande atenção e alcançado grande desenvolvimento como uma estratégia anticâncer e pode ser uma opção alternativa no tratamento clínico [15,16,17, 18]. A PTT e a TFD à base de nanomateriais são caracterizadas por menor invasão e baixa toxicidade, com pouca chance de induzir resistência aos medicamentos [19,20,21,22,23]. Com a colaboração da luz, principalmente NIR, os nanomateriais localizados podem elevar a temperatura dentro do tumor e converter o oxigênio em espécies reativas de oxigênio (ROS), que causa morte celular para eliminar tumores [24]. Neste contexto, o nanomaterial desempenha aqui um papel fundamental para influenciar a eficácia e garantir a segurança. Embora tais nanomateriais incluam nanoestruturas metálicas [25], materiais à base de carbono [26, 27], nanopartículas poliméricas (PNPs) [28] ou compostos semicondutores [29], eles têm suas próprias limitações. Por exemplo, materiais à base de carbono são caros e possuem propriedades de suspensão insatisfatórias, o que limita sua aplicação em larga escala e potencialidade clínica. Portanto, mais tentativas devem ser feitas para gerar nanomateriais mais adequados para uso posterior.
Nos últimos anos, os pontos quânticos (QDs), como novos nanomateriais, têm recebido grande atração em aplicações biomédicas por causa de sua boa biocompatibilidade, solubilidade e, o mais importante, sua fotoestabilidade superior e propriedade de funcionalização de superfície fácil [30,31,32, 33]. Aproveitando essas propriedades, vários relatórios usaram QDs como novos reagentes PDT e podem ser projetados para serem acompanhados com outras biomoléculas para aumentar a eficácia da PDT no tratamento do câncer. Por exemplo, Meng e colegas relataram um GQD multifuncional @ MnO 2 induzida por duas fotoexcitações para melhorar a eficácia do PDT [34]. Além disso, Kuo e colegas geraram QDs dopados com nitrogênio, funcionalizando-os com moléculas de amino, o que também aumentou a eficiência do PDT [35]. Inspirados por essas descobertas interessantes, buscamos desenvolver novos QDs combinados com nanomaterial à base de metal não nobre que pode trazer efeitos sinérgicos de PTT e PDT em um nano-sistema. Por exemplo, o nanomaterial baseado em Co é um nanomaterial à base de metal não nobre bem estudado, que é conhecido por ser usado como agentes PTT para terapia tumoral ou imagem [36]. Portanto, sugerimos que projetar QDs baseados em Co pode trazer efeitos sinérgicos PTT / PDT aprimorados.
Neste estudo, sintetizamos novos nanomateriais CoFe 2 O 4 -QDs que exibem efeitos sinérgicos de PTT e PDT aumentados em matar NSCLC sem efeitos tóxicos in vitro e in vivo, o que poderia ser um fotossensibilizador promissor para terapia com NSCLC.
Material e métodos
Síntese de CoFe 2 O 4 -QDs
O CoFe 2 O 4 -QDs foram sintetizados através do método hidrotérmico. Normalmente, 0,238 g CoCl 2 · 6H 2 O e 0,808 g Fe (NO 3 ) 3 · 9H 2 O foram dissolvidos em 10 mL de H 2 O e 10 mL de solvente da mistura de propilenoglicol e depois agitada durante 10 min. Em seguida, 4 mL de ditranol amina foram adicionados gota a gota à solução, seguido por agitação durante 30 min. Em seguida, a pasta obtida foi transformada em uma autoclave revestida com Teflon inoxidável de 50 mL. A autoclave foi mantida a 160 ℃ por 3 h em um forno. O CoFe 2 O 4 -QDs foram coletados por centrifugação a 8500 rpm por 10 min e, em seguida, enxaguados com água deionizada e etanol sucessivamente. Os reagentes e materiais usados neste estudo podem ser encontrados na Tabela 1.
Caracterização de CoFe 2 O 4 -QDs
A morfologia e o tamanho do CoFe 2 preparado O 4 -QDs foram determinados pelo sistema TEM e EDS. A estrutura cristalina foi analisada por difratômetro de raios X (Bruker Germany) equipado com radiação Cu Ka ( k =0,15406 nm). O espectro de absorbância de CoFe 2 O 4 -QDs foi detectado pelo espectrofotômetro SHIMADZU UV-2600. Os estados de valência do elemento de CoFe 2 O 4 -QDs foram determinados por medidas de espectroscopia de fotoemissão de raios-X (XPS, VG ESCALAB 220I-XL, EUA). A imagem térmica foi gravada com câmera térmica infravermelha (FLIR E50, EUA).
Cultura de células
A linha de células NSCLC NCI-H460 (H460) e A549 e células endoteliais da veia umbilical humana (HUVECs) foram obtidas da ATCC e testadas para microplasma negativo. As células H460 e A549 foram cultivadas em RPMI-1640 suplementado com 10% de soro fetal bovino (FBS) e 1% de penicilina-estreptomicina (Gibco). As HUVECs foram cultivadas em meio de crescimento de células endoteliais (Sigma, # 211-500). Todas as células foram mantidas em incubadora com umidade escura 37 ℃ com 5% de CO 2 .
Detecção de citotoxicidade
Várias concentrações de trabalho (0,1, 0,5, 1,0, 2,0 mg / mL) de CoFe 2 O 4 -QDs foram adicionados e cultivados com HUVECs por 24 h. Após a incubação, o meio de cultura foi trocado e o regente CCK-8 foi adicionado a cada poço seguido por 1 h de incubação. Em seguida, as placas foram medidas a 450 nm com EnSpire ™ Multimode Plate Reader. A proporção de viabilidade celular foi considerada como 100% em HUVECs de controle.
Análise de apoptose
Células H460 e A549 (2 × 10 5 ) foram cultivadas em placas de 6 poços durante a noite antes de serem tratadas com 1,0 mg / mL de CoFe 2 O 4 -QDs combinados com laser NIR de 808 nm por 5 min. Em seguida, as células foram lavadas e coradas com o kit de apoptose Anexina-V / PI (BD; # 556547) seguindo as instruções do fabricante. Quanto ao ensaio de apoptose de HUVECs, HUVECs foram incubados com diferentes concentrações de CoFe 2 O 4 -QDs. A proporção de apoptose foi determinada como descrito acima.
Detecção de ROS celular
As células H460 e A549 foram cultivadas em placas de 6 poços durante a noite. As células foram incubadas com ou sem 1,0 mg / mL por 1 h e tratadas com laser NIR de 808 nm por 5 min. Após os tratamentos, DCFH-DA foi adicionado e incubado por 30 min seguido por detecção FACS com excitação / emissão a 485 nm / 535 nm. Quanto ao ensaio de inibição de ROS, o inibidor de ROS NAC (Sigma; A7250) foi adicionado de acordo com as instruções do fabricante. Os dados foram posteriormente quantificados com o software Flow-jo.
Análise de Western Blot
As células H460 e A549 foram tratadas como ensaio de apoptose, e a proteína da célula inteira foi extraída usando tampão de lise RIPA. A detecção de Western blot foi realizada conforme descrito antes [37]. Os anticorpos usados neste estudo foram listados abaixo:anti-Bcl-2 policlonal de coelho (abcam; ab59348), anti-Bax monoclonal de coelho (abcam; ab32503), policlonal de coelho anti- P -PI3K (Bio-Vision; 3152-100), monoclonal de coelho anti- P -AKT-S473 (CST; 4060S), anti-β-Actina monoclonal de coelho (CST; 4970S), anticorpo IgG anti-coelho ligado a HRP (CST; 7074S). A quantificação foi determinada usando o software Image-J.
Estudo in vivo do efeito anti-NSCLC da combinação de CoFe 2 O 4 e tratamento NIR
Para determinar a capacidade de matar tumor de CoFe 2 O 4 -QDs, células H460 foram implantadas por via subcutânea com 50% de MatriGel em camundongos NSG ( N =8 cada grupo). Camundongos M-NSG machos de 4-6 semanas de idade foram obtidos da Shanghai Model Organisms (# NM-NSG-001) para todos os experimentos in vivo. Quando o tumor foi visualizado e o volume atingiu quase 5 mm × 5 mm, todos os camundongos foram divididos aleatoriamente em quatro grupos, denominados como Controle, NIR apenas, CoFe 2 O 4 -QDs apenas e CoFe 2 O 4 -QDs + grupo NIR, respectivamente. Em seguida, camundongos em CoFe 2 O 4 -QDs apenas e CoFe 2 O 4 -QDs + grupo NIR foram injetados intratumoralmente com 50 μL de CoFe 2 O 4 (5,0 mg / kg) com base em nosso trabalho anterior [37], enquanto o grupo Controle e NIR foi injetado com 50 μL de PBS. Após a injeção, laser NIR 808 nm (1 W / cm 2 ) foi realizada em NIR e CoFe 2 O 4 Grupo -QDs + NIR por 10 min, que foi monitorado por equipamento de imagem térmica infravermelho. O volume do tumor foi registrado todos os dias e calculado com a fórmula V =Comprimento × largura 2 / 2. Uma vez que o diâmetro dos xenoenxertos tumorais nos camundongos restantes atingiu quase 15 mm, os camundongos foram sacrificados e os xenoenxertos tumorais foram fotografados e armazenados para posterior detecção. Todos os experimentos e protocolos com animais foram aprovados pelo Comitê de Uso e Cuidado de Animais Institucionais (IACUC) e Comitê de Bem-Estar Animal do Hospital Shenzhen da Universidade de Pequim.
Análise de coloração de H&E e imunohistopatologia
Para avaliação patológica, os xenoenxertos de tumor ( N =3) foram colhidos um dia após o tratamento em cada grupo e, em seguida, fixados em formalina tamponada a 10% após embebidos em parafina para coloração de H&E e detecção de IHC. Para avaliação da toxicidade in vivo, o rim, fígado, pulmão, coração e baço dos camundongos foram extraídos e fixados para avaliação patológica. Para a coloração IHC, foi usado anticorpo anti-Ki67 (Abcam; ab15580). A quantificação da área positiva de IHC foi conduzida pelo software Fiji.
Análise estatística
Para todos os experimentos, “ N ”Representa o número de vezes repetidas ou o número de ratos usados conforme indicado na legenda da figura. t do aluno -teste ou ANOVA unilateral foi usado para comparações estatísticas. P <0,05 é considerado estatisticamente significativo, enquanto “ns” exibe não significativo. P <0,05, P <0,01 e P <0,001 são indicados com asteriscos “*”, “**” e “***”, respectivamente. Os dados foram analisados usando GraphPad Prism 5.
Resultados
As características do romance CoFe 2 O 4 -QDs
Em primeiro lugar, construímos o CoFe 2 O 4 -QDs utilizando abordagem hidrotérmica de baixo custo e simples de realizar. A imagem TEM do CoFe 2 O 4 -QDs foi mostrado na Fig. 1a, apresentando um padrão uniforme e estável com o diâmetro em torno de 3,4 nm (Fig. 1b). O CoFe conforme preparado 2 O 4 -QDs eram de cor marrom escuro (Fig. 1b) e com excelente solubilidade em água. Além disso, a imagem TEM de alta resolução (Fig. 1c) exibiu o espaçamento da rede de (222) é de cerca de 0,242 nm, o que é consistente com os parâmetros de cristal de CoFe 2 O 4 -QDs [38, 39]. Além disso, o espectro do elemento (Fig. 1d) confirmou ainda o componente do elemento do CoFe 2 O 4 -QDs é Co e Fe, e a proporção de átomos de Co e Fe era de cerca de 1:2. Esses dados mostraram uma construção bem-sucedida do CoFe 2 O 4 -QDs para nossas pesquisas futuras.
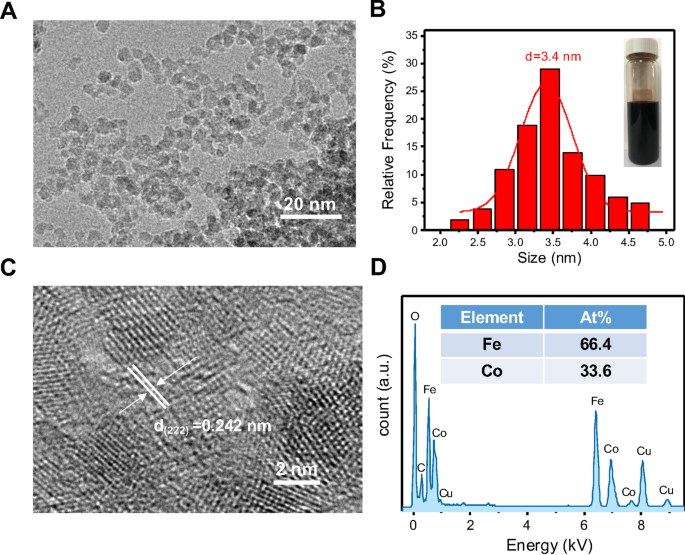
Preparação e caracterização do CoFe 2 O 4 -QDs. a A imagem representativa do TEM do CoFe 2 conforme preparado O 4 -QDs. Barra de escala, 20 nm. b Uma análise global do tamanho do CoFe 2 O 4 -QDs com diâmetro médio de 3,4 nm. A inserção é a foto digital representativa do CoFe 2 O 4 Suspensão de QDs. c As franjas da rede de nanocristais preparados correspondem a CoFe 2 O 4 -QDs HRTEM image. Barra de escala, 2 nm. d O CoFe conforme preparado 2 O 4 -QDs exibiram distribuição uniforme de Co, Fe e O. O mapa de elementos representativos foi mostrado
A detecção de propriedade física de CoFe 2 O 4 -QDs
A fim de determinar as propriedades físicas do CoFe preparado 2 O 4 -QDs, realizamos várias detecções após a construção. Com o teste de determinação de absorbância NIR, CoFe 2 O 4 -QDs mostraram conversão fototérmica adequada de uma maneira dependente da concentração e os incrementos de temperatura (Δ T ) pode ser ajustado de 0,3 a 18,9 ° C (Fig. 2a). Além disso, na concentração de 1,0 mg / mL de CoFe 2 O 4 -QDs, aumentando a potência de radiação NIR de 0,5 para 2,0 W / cm 2 , o ΔT pode ser ajustado de 0,8 a 24,3 ° C (Fig. 2b). Esses dados sugeriram que o desempenho de conversão fototérmica do CoFe 2 O 4 -QDs era dependente de sua concentração e do poder de irradiação. Além disso, a estabilidade do CoFe 2 O 4 A conversão fototérmica desencadeada por QDs foi determinada com irradiação de período (Fig. 2c). Embora a eficiência de conversão de luz em calor calculada tenha sido de 7,18% (Fig. 2d), é o suficiente para ser acompanhado para aumentar o efeito PDT de CoFe 2 O 4 -QDs. Além disso, o comprimento de onda mais longo do CoFe 2 O 4 -QDs pode absorver luz é de cerca de 808 nm (Fig. 2e, f). Juntos, esses dados sugerem que CoFe 2 O 4 -QDs podem ser desenvolvidos em um agente sinérgico PTT / PDT promissor para terapia alternativa de morte de tumor.
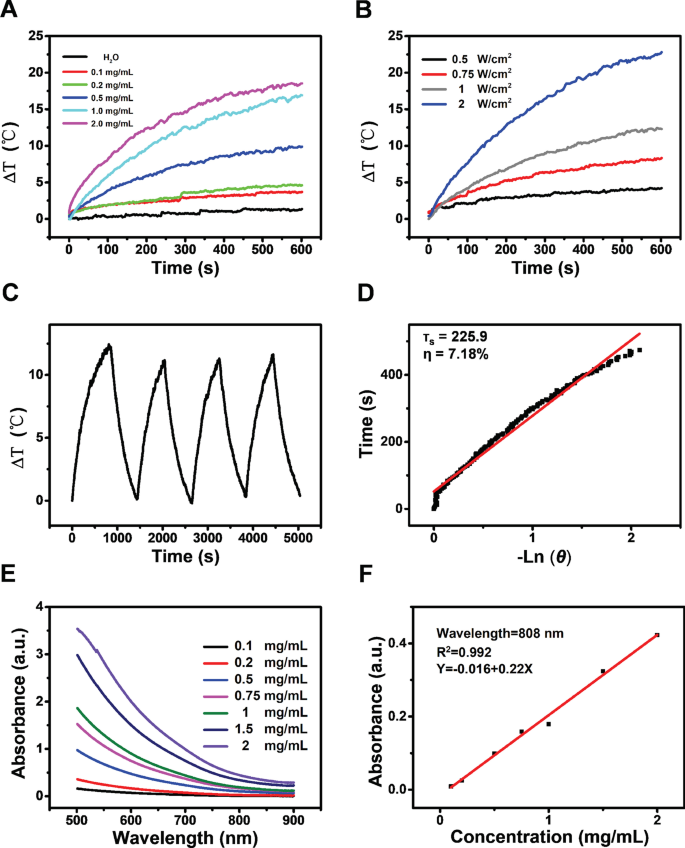
A avaliação da propriedade do CoFe 2 O 4 -QDs. a A conversão fototérmica de CoFe 2 O 4 -QDs foi determinado em diferentes concentrações. As curvas de aquecimento são mostradas. b A maneira dependente da energia de irradiação do CoFe 2 O 4 -QDs é mostrado em diferentes densidades de potência (0,5–2,0 W / cm 2 ) c CoFe 2 O 4 -QDs têm conversão fototérmica estável detectada com 4 ciclos de irradiação contínua de aquecimento-resfriamento (1,0 W / cm 2 ) d A eficiência do CoFe 2 O 4 - Conversão fototérmica de QDs. e , f A relação de comprimento de onda e absorbância de CoFe 2 O 4 -QDs
Avaliação de Citotoxicidade de CoFe 2 O 4 -QDs em direção às células normais
Uma vez que as nanopartículas são amplamente utilizadas como distribuidores de drogas ou intra-meio para terapias de tumor, a citotoxicidade do CoFe 2 O 4 -QDs em relação às células normais, especialmente as células epiteliais vasculares humanas, devem ser confirmadas para uso posterior. Portanto, a partir dos resultados anteriores, testamos diferentes concentrações (0,1, 0,5, 1,0 e 2,0 mg / mL) de CoFe 2 O 4 -QDs. Após co-cultura com HUVECs (linha de células epiteliais humanas normais), o reagente CCK-8 foi adicionado para a detecção da viabilidade celular. Não houve citotoxicidade óbvia observada em comparação com o grupo de controle (Fig. 3a). Neste contexto, o ensaio de apoptose adicional foi realizado para alcançar resultados consistentes com as mesmas condições (Fig. 3b). A quantificação da taxa de apoptose não indicou diferença significativa em relação ao grupo controle (Fig. 3c). Esses dados mostraram que CoFe 2 O 4 -QDs não tiveram efeito tóxico aparente em células normais, o que indicou que CoFe 2 O 4 -QDs tinha o potencial de ser usado como intermediário para a entrega de drogas.
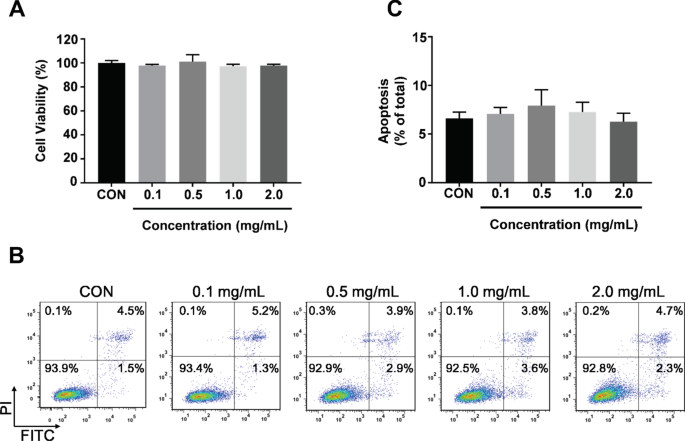
Avaliação in vitro da citotoxicidade de CoFe 2 O 4 -QDs para células normais. a O ensaio de viabilidade celular CCK-8 em HUVECs foi realizado sob diferentes concentrações de CoFe 2 O 4 -QDs. A viabilidade do grupo controle foi considerada como 100%. Os dados foram apresentados como média ± DP, N =3. b A apoptose de HUVECs foi determinada por detecção FACS. Imagens representativas das concentrações indicadas são mostradas, N =3. c A quantificação da razão de apoptose. Eles mostram não significância em comparação ao grupo controle. Os dados foram apresentados como média ± DP
Combinação de NIR e CoFe 2 O 4 -QDs induz apoptose de NSCLC
Para determinar a capacidade potencial de matar o câncer NSCLC de CoFe 2 O 4 -QDs, irradiação com laser NIR (808 nm) foi realizada combinada com a incubação de CoFe 2 O 4 -QDs in vitro. Em seguida, o ensaio de apoptose foi realizado após os tratamentos, ambas as células H460 e A549 revelaram taxa de apoptose agressiva com a combinação de CoFe 2 O 4 -QDs e laser NIR (Fig. 4a, b). A quantificação mostrou diferença significativa em comparação ao grupo de controle, enquanto CoFe 2 O 4 -QDs apenas ou NIR apenas grupos não mostraram nenhuma diferença, o que indicava que CoFe 2 O 4 -QDs mais NIR podem induzir efeito anti-NSCLC (Fig. 4a, b). É bem conhecido que a alteração do nível proteico de Bcl-2 / Bax é importante para determinar se as células sofreriam apoptose [40]. Consistente com esta ideia, o nível de proteína de Bcl-2 e Bax foi determinado em ambas as células H460 e A549 após os tratamentos (Fig. 4c, d). Conforme respeitado, os dados também mostraram que a proporção de Bcl-2 / Bax diminuiu, o que foi considerado o marcador de apoptose mediada por mitocôndrias. Portanto, apresentamos que CoFe 2 O 4 -QDs mais NIR dá origem ao efeito anti-NSCLC através da ativação da via de apoptose mediada por mitocôndrias.
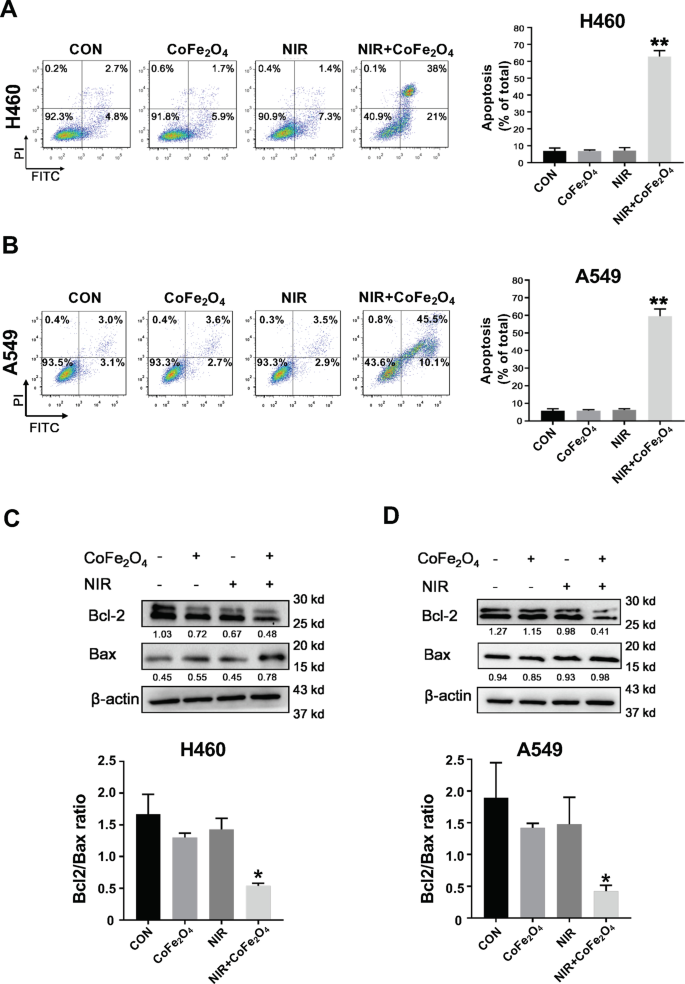
Combinação in vitro de CoFe 2 O 4 -QDs e NIR induzem apoptose de NSCLC. a , b NSCLCs H460 e A549 foram tratados com a combinação de CoFe 2 O 4 -QDs e laser NIR por 5 min. As células apoptóticas foram avaliadas por coloração com Anexina-V e detectadas por FACS. A quantificação também é mostrada respectivamente. Os dados foram apresentados como média ± DP, N =3. ** P <0,01 vs Controle, NIR, CoFe 2 O 4 grupos. c , d O nível de proteína de Bcl-2 e Bax foi determinado por análise de Western blot em NCI-H460 e A549 NSCLC após o tratamento. Imagens representativas são mostradas. A quantificação é mostrada após calibração para a expressão do controle interno β-Actina. Os dados foram apresentados como média ± DP, N =3. * P <0,05 vs Controle, NIR, CoFe 2 O 4 grupos
Combinação de CoFe 2 O 4 -QDs e NIR induzem geração de ROS via PI3K / AKT Pathway
A disfunção da mitocôndria sempre leva a um nível de geração de ROS regulado positivamente, o que causa morte celular no NSCLC. Neste contexto, realizamos a detecção de ROS após CoFe 2 O 4 -QDs mais tratamento NIR em células H460 e A549. Os resultados mostraram que uma imensa liberação de ROS no grupo de combinação, o que indicou que o efeito PDT potencializado poderia ser induzido por CoFe 2 O 4 -QDs mesmo com baixa eficiência de transmissão fototérmica (Arquivo adicional 1:Fig. S1A, B). Além disso, o nível de proteína relacionado da via de sinalização PI3K / AKT também foi reduzido, o que sugeriu que a alteração de ROS foi regulada pela via PI3K / AKT, o que leva à alteração do nível de expressão da proteína Bcl-2 / Bax (Fig. 4c, d, Arquivo adicional 1:Fig. S1C, D). Para confirmar essa ideia, o inibidor de ROS NAC foi adicionado para reverter o fenômeno (Fig. 5a, b). Em seguida, a expressão de PI3K / AKT foi determinada para ser resgatada após o tratamento com NAC, o que confirmou ainda que a liberação de ROS após CoFe 2 O 4 O tratamento -QDs mais NIR foi regulado pela via PI3K / AKT (Fig. 5c, d). Essas descobertas apóiam fortemente a ideia de que a combinação de CoFe 2 O 4 -QDs e NIR podem levar a PTT sinérgico e efeito PDT na morte de células NSCLC por indução de apoptose dependente de disfunção mitocondrial (ROS).
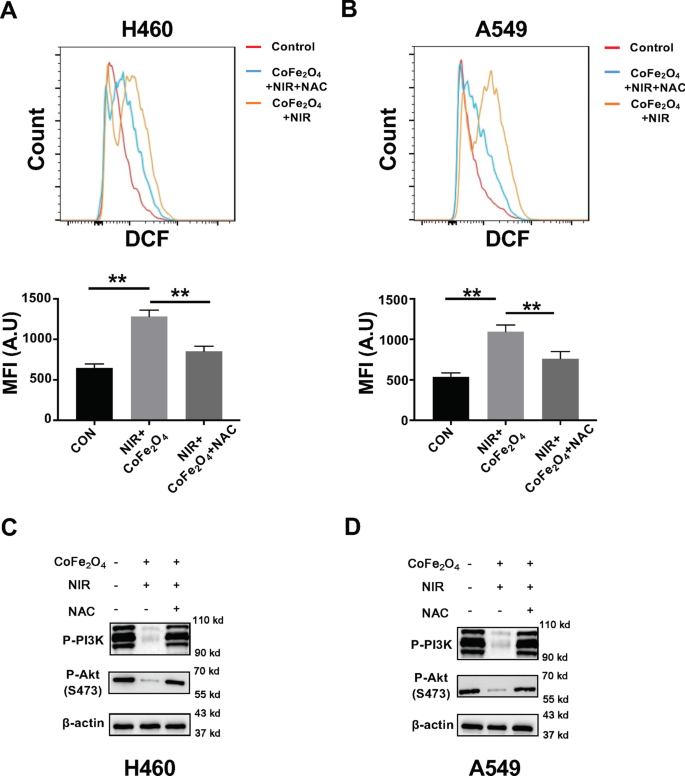
A combinação de CoFe 2 O 4 -QDs e NIR induzem geração de ROS através da regulação da via PI3K / AKT. a , b NCI-H460 e A549 NSCLCs foram tratados com o CoFe 2 O 4 -QDs e laser NIR com ou sem NAC por 5 min. O nível de ROS foi detectado por FACS e a intensidade média de fluorescência foi quantificada, respectivamente. Os dados foram apresentados como média ± DP, N =3. ** P <0,01. c , d O nível de proteína de P -PI3K e P -AKT foi determinado por análise de Western blot. Imagens representativas são mostradas, N =3
Avaliação In vivo Anti-NSCLC de Combinação de CoFe 2 O 4 -QDs e NIR
Com base nos resultados in vitro, investigamos a seguir o efeito anti-NSCLC do CoFe 2 O 4 -QDs e tratamento de combinação de NIR em modelo de camundongos com tumor NSCLC. Camundongos M-NSG foram implantados por via subcutânea com células H460. Após injeção intratumoral de CoFe 2 O 4 -QDs, a irradiação do laser NIR causou um rápido aumento da temperatura para cerca de 56 ° C sob o monitor do equipamento de detecção térmica (Fig. 6a, b). Além disso, a coloração histopatológica mostrou extensa área de necrose observada no grupo de combinação, indicando que CoFe 2 O 4 -QDs mais o tratamento NIR causou a morte de células tumorais como resultado da eliminação do tumor (Fig. 6c, d). A coloração IHC adicional também mostrou que a área Ki-67 positiva foi agressivamente reduzida em comparação com outros grupos após o tratamento combinatório, indicando que os xenoenxertos tumorais tratados não podiam mais proliferar (Arquivo adicional 2:Fig. S2A, B). Em seguida, acompanhamos por 12 dias após o CoFe 2 O 4 -QDs e tratamento NIR. Como esperávamos, o tamanho e o peso dos xenoenxertos de tumor em outros grupos crescem notavelmente, mas não no CoFe 2 O 4 -QDs e grupo de tratamento NIR (Fig. 6e, f), apoiando a ideia de que CoFe 2 O 4 O tratamento combinado -QDs e NIR pode eliminar completamente os xenoenxertos tumorais in vivo. Quanto ao efeito citotóxico do CoFe 2 O 4 -QDs, pelo menos em nosso período de observação, nenhum efeito adverso óbvio foi detectado a partir dos resultados da análise histopatológica em órgãos importantes de camundongos (arquivo adicional 2:Fig. S2C). Os dados acima forneceram fortes evidências de que CoFe 2 O 4 -QDs podem ser desenvolvidos como um novo reagente PTT / PDT para o tratamento de NSCLC.
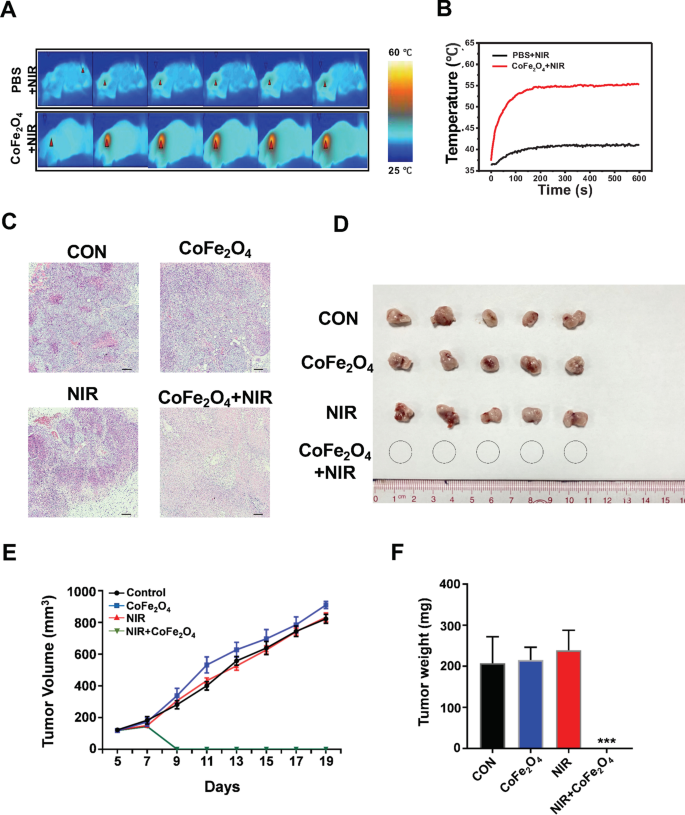
Avaliação de eliminação de tumor in vivo da combinação de CoFe 2 O 4 -QDs e tratamento NIR. a As imagens térmicas infravermelhas representativas de camundongos M-NSG com xenoenxertos de tumor NCI-H460 são mostradas. b A curva de temperatura mostra o aumento da temperatura dentro dos xenoenxertos de tumor sob irradiação NIR. c A coloração patológica de H&E de cada grupo foi fotografada 1 dia após o tratamento. Necrose aparente pode ser observada no grupo de combinação. Imagens representativas são mostradas, N =3. d A fotografia dos xenoenxertos em cada grupo depois que os camundongos foram sacrificados, N =5. e , f A curva de crescimento e o peso dos xenoenxertos tumorais em cada grupo foram registrados. Os dados foram apresentados como média ± DP, N =5. *** P <0,001
Discussão
Nos últimos anos, a pesquisa para o desenvolvimento de estratégias anti-NSCLC alcançou enormes progressos. Tanto a medicina de precisão que visa NSCLC específico viciado em oncogene mutante quanto as terapias de bloqueio do ponto de controle imunológico trazem um futuro promissor em tratamentos clínicos [41, 42]. No entanto, dada a complexidade e heterogenicidade do microambiente tumoral e o risco subjacente de perda do antígeno tumoral, continua sendo um gargalo reduzir a taxa de resistência aos medicamentos após o estado imune evasivo, o que leva à recidiva do tumor em um curto espaço de tempo. Portanto, é urgente buscar novos tratamentos ou intermediários para terapias de NSCLC. Entre as abordagens emergentes, os nanomateriais foram avaliados e listados como agentes eficazes para matar o câncer. Tirando vantagens de seu pequeno tamanho, boas biocompatibilidades e habilidades de transmissão térmica, vários nanomateriais exercem excelentes habilidades de matar o câncer em pesquisas recentes [43].
Em nosso estudo, desenvolvemos um novo CoFe 2 O 4 -QDs que podem ser aplicados como um intermediário para tratamentos de NSCLC via indução de apoptose de células tumorais com efeitos sinérgicos de PTT e PDT. Como outros nanomateriais, CoFe 2 O 4 -QDs exibiram excelentes biocompatibilidades em nossos estudos, que não mostraram toxicidade óbvia para células normais e órgãos principais. Embora tenhamos descoberto que a taxa de transmissão térmica não é alta como outros nanomateriais, é o suficiente para CoFe 2 O 4 -QDs para induzir a apoptose de células cancerosas sob a ativação do laser NIR. CoFe 2 O 4 -QDs mostra uma boa relação linear com a absorbância de luz neste estudo e potencialmente gera ROS com a combinação de laser NIR, o que prova ainda que CoFe 2 O 4 -QDs podem atuar como fotossensibilizador vantajoso. Em seguida, podemos otimizar ainda mais a estrutura ou adicionar elementos termossensíveis ao CoFe 2 O 4 -QDs que poderiam atingir uma taxa de transmissão térmica mais alta para melhores efeitos sinérgicos de PTT e PDT [44, 45]. Além disso, a aplicação de drogas químicas ou anticorpos na superfície do CoFe 2 O 4 -QDs também é viável, o que pode trazer eficiência superior de matança. Por exemplo, a abordagem de ligação de anticorpos anti-PDL1 ou anti-CTLA4 a CoFe 2 O 4 -QDs pode ser uma terapia combinacional promissora para quebrar o microambiente imunossupressor dentro de tumores, que é o nosso próximo interesse em fazer um uso completo com CoFe 2 O 4 -QDs.
Além disso, o mecanismo do CoFe 2 O 4 -QDs em matar NSCLC também foi elucidado neste estudo. Confirmamos que CoFe 2 O 4 -QDs induziu apoptose de NSCLC principalmente através da secreção de ROS após efeitos de PDT e PTT sinérgicos ativados por laser NIR. O excesso de geração de ROS causa estresse oxidativo nas células tumorais e causa diretamente danos ao DNA, que por sua vez ativam as vias de sinalização a jusante e, em seguida, induzem a morte das células tumorais [46, 47]. Entre os quais, evidências crescentes mostraram que a via de PI3K / AKT pode ser regulada por ROS celulares e leva à disfunção mitocondrial [48, 49]. Foi bem aceito que, após a ativação, AKT é fosforilado por PI3K e, portanto, inativa a proteína pró-apoptótica Bax e protege as células da apoptose. Além disso, AKT fosforilado também é capaz de estabilizar o complexo MDM2 / p53, que regula a sobrevivência celular [50]. Neste contexto, o papel dessa via no CoFe 2 O 4 A secreção de ROS induzida por -QDs foi investigada. Como esperado, descobrimos que ROS excessivos causados por CoFe 2 O 4 -QDs regulam negativamente a expressão das vias PI3K / AKT e, portanto, causam apoptose de células tumorais por meio da ativação de Bax, mas da proteína Bcl-2 inativada. Esse achado foi confirmado pela adição de inibidor de ROS, que reverteu a expressão de PI3K / AKT e diminuiu a produção de ROS. Uma vez que a via PI3K / AKT é conhecida por regular a sobrevivência e morte celular, especialmente em células cancerosas, compreendendo tais mecanismos de CoFe 2 O 4 -QDs em matar NSCLC nos ajudaria a desenvolver mais opções para terapias combinatórias.
Em resumo, para desenvolver novos fotossensibilizadores para terapia alternativa para matar tumor, construímos com sucesso o CoFe 2 O 4 -QDs usando abordagem hidrotérmica de forma fácil e de baixo custo neste estudo. O CoFe 2 O 4 -QDs têm uma ampla absorvância NIR, boa biocompatibilidade e capacidade de conversão fototérmica. Além disso, em comparação com QDs relatados anteriormente, CoFe 2 O 4 -QDs exibiram um efeito sinérgico de PTT / PDT em matar tumores NSCLC, o que representa um agente multifuncional promissor em outras fototerapias de NSCLC. Além disso, com a irradiação NIR, CoFe 2 O 4 -QDs podem matar NSCLC principalmente através da indução da geração de ROS através da regulação da expressão de Bcl-2 / Bax através da via de sinalização PI3K / AKT a montante. Quanto à capacidade de matar tumor in vivo, CoFe 2 O 4 -QDs combinados com NIR podem eliminar os xenoenxertos de tumor NSCLC completamente sem efeitos tóxicos óbvios. Estas descobertas provam que CoFe 2 O 4 -QDs possui aplicativos promissores a serem desenvolvidos como um novo reagente de eliminação de NSCLC.
Conclusão
Resumindo, CoFe 2 O 4 -QDs que sintetizamos podem exibir efeitos sinérgicos PTT / PDT superiores na supressão de NSCLC por induzir a geração de ROS por meio da regulação da via PI3K / AKT, que lança luz para a pesquisa de mecanismo e aplicações de novos estabelecimentos fotossensibilizadores.
Disponibilidade de dados e materiais
Os dados que suportam os resultados deste estudo estão disponíveis com o autor correspondente, mediante solicitação razoável.
Nanomateriais
- Nanopartículas para terapia do câncer:progresso e desafios atuais
- Nanorods de ouro revestidos com BSA para terapia fototérmica NIR-II
- N, N-Dimetilformamida regulando a fluorescência de pontos quânticos MXene para a determinação sensível de Fe3 +
- Administração de medicamentos baseados em células para solicitações de câncer
- Exploração de Zr – Metal – Estrutura Orgânica como Fotocatalisador Eficiente para Produção de Hidrogênio
- Síntese e desempenho in vitro de nanopartículas de ferro-platina revestidas com polipirrole para terapia fototérmica e imagem fotoacústica
- Biocompatível de ácido 5-aminolevulínico / vesículas etossômicas carregadas com nanopartículas de Au para terapia fotodinâmica / fototérmica sinérgica transdérmica in vitro de cicatrizes hip…
- Nanosensibilizador magnético modificado por aptâmero para imagens de ressonância magnética in vivo de câncer que expressa HER2
- Síntese fácil em um vaso de pontos de carbono de polidopamina para terapia fototérmica
- Carbon Dots @ Platinum Porfirina Composto como Nanoagente Teranóstico para Terapia Eficiente Fotodinâmica do Câncer



