Efeito do agente de peptização ácida na relação anatase-rutilo e desempenho fotocatalítico de nanopartículas de TiO2
Resumo
TiO 2 nanopartículas foram sintetizadas a partir de isopropóxido de titânio por um método simples de peptização usando ácidos sulfúrico, nítrico e acético. O efeito da peptização do ácido nas propriedades físico-químicas e fotocatalíticas do TiO 2 pós foi estudado. As propriedades estruturais do TiO sintetizado 2 os pós foram analisados usando XRD, TEM, N 2 -fiseorção, Raman, DR UV- vis , FTIR e técnicas de espectroscopia de fotoelétrons de raios-X. Os resultados da caracterização mostraram que a peptização com ácido acético facilitou a formação da fase anatase pura após tratamento térmico a 500 ° C; em contraste, a peptização com ácido nítrico levou a uma maior formação de fase rutilo (67%). Curiosamente, a amostra peptizada com ácido sulfúrico rendeu 95% de anatase e 5% de fases de rutilo. A atividade fotocatalítica do TiO sintetizado 2 nanopartículas foram avaliadas quanto à degradação de corantes orgânicos selecionados (cristal violeta, azul de metileno e p -nitrofenol) em solução aquosa. Os resultados confirmaram que o TiO 2 amostra peptizada usando ácido nítrico (com fases rutilo e anatase na proporção de 3:1) ofereceu a maior atividade de degradação de corantes orgânicos, embora, TiO 2 as amostras peptizadas com ácido sulfúrico e ácido acético possuíam tamanho de partícula menor, energia de gap mais alta e alta área de superfície. Curiosamente, TiO 2 amostra peptizada com ácido nítrico possuía densidade de fotocorrente teórica relativamente alta (0,545 mAcm −2 ) e diâmetro de poro (150 Å), que são responsáveis pela alta eficiência de separação elétron-buraco e difusão e transporte de massa de reagentes orgânicos durante o processo de degradação fotoquímica. A atividade superior do TiO 2 a amostra peptizada com ácido nítrico deve-se à efetiva transferência de elétrons fotogerados entre as fases rutila e anatase.
Histórico
Dióxido de titânio (TiO 2 ) é um material semicondutor amplamente conhecido por seu uso em muitas aplicações, incluindo conversão de energia solar, controle de poluição e fotocatálise [1,2,3]. TiO 2 geralmente tem três polimorfos, a saber, anatase, rutilo e brookita. Foi relatado que anatase e brookita podem ser transformados em rutilo após tratamento térmico em alta temperatura (<610 ° C) [4, 5]. TiO 2 anatase é conhecido por ser um fotocatalisador ativo para a degradação de poluentes orgânicos [1, 5,6,7,8]. Foi observado que o tamanho, a fase cristalina e a porosidade do TiO 2 as amostras têm forte influência sobre suas aplicações [9]. Síntese a baixa temperatura de TiO nanométrico poroso 2 requer tempos de síntese mais longos [10,11,12]. Li et al. [13] sintetizou anatase pura e mistura das fases rutilo e anatase por tratamento térmico do TiO amorfo 2 . A formação de anatase pura envolve tratamento térmico em alta temperatura (500 ° C) [14], o que geralmente causa sinterização do TiO 2 nanoestruturas. A síntese de anatase cristalina pura em temperaturas mais baixas é um interessante tópico de pesquisa [15]. Métodos sol-gel e síntese hidrotérmica [16] foram usados para preparar um TiO bem cristalino 2 em baixa temperatura e curto tempo de reação [17]. Wang et al. [12] sintetizou anatase altamente cristalina e nanopartículas de rutilo por HNO hidrotérmico 3 TiO peptizado 2 sóis. No entanto, o método hidrotérmico exige condições especiais de síntese e equipamentos caros que podem apresentar pH e temperaturas elevadas [18].
O método de síntese sol-gel foi usado utilizando o alcóxido de titânio como precursor de Ti em uma temperatura amena (<100 ° C), e rendeu TiO nanométrico altamente disperso 2 amostras [16]. O método de peptização química foi adaptado para a síntese de nanoestruturas de óxido metálico estáveis, incluindo TiO 2 [19], onde a suspensão coagulada se dissolve e recristaliza na solução estável de nanopartículas com o agente peptizante [20]. Foi relatado que a natureza do ácido peptizante tem efeito sobre as características físico-químicas, como tamanho do cristalito, composição e morfologia das partículas [21]. Zaban et al. [22] TiO sintetizado 2 colóides com HNO 3 e CH 3 COOH sob condições hidrotérmicas e observada a formação de mistura de anatase e brookita em ambos os casos. Liu et al. [23] obteve TiO 2 hidrossol de ácido metatitânico sob diferentes agentes de peptização e estudou a influência das condições de peptização nas propriedades estruturais e fotocatalíticas do TiO 2 hidrossóis. Kanna e Wongnawa [24] empregaram o método de síntese sol-gel para obter anatase-rutila amorfa usando diferentes ácidos, como HCl, HNO 3 , H 2 SO 4 , H 3 PO 4 e CH 3 COOH. Os autores observaram que a presença de grupos sulfato e fosfato são responsáveis pela inibição do crescimento da fase rutilo. Posteriormente, Alphonse et al. [25] TiO sintetizado 2 agregados, que são compostos pelas fases anatase e brookita por hidrólise do isopropóxido de titânio em meio altamente ácido. Parra et al. [26] estudaram a via de reação na síntese de nanopartículas de anatase com ácido acético. Eles usaram técnicas de FTIR e NMR para concluir que os íons de acetato atuam como ligantes bidentados entre dois centros de Ti.
Zhou et al. [27] estudaram o efeito de HCl, HNO 3 e CH 3 COOH em método solvotérmico para sintetizar TiO 3D 2 estruturas com morfologia diferente. Os autores concluíram que a amostra sintetizada com 0,68 M HCl possuía ambas as fases anatase / rutilo e ofereceu maior atividade fotocatalítica devido à sua morfologia única e propriedades ópticas. Tobaldi et al. [28] adotou hidrólise / peptização controlada de isopropóxido de titânio com HNO 3 , HBr e HCl para sintetizar TiO 2 nanopartículas. Foi observado que os íons haleto aumentaram a transição de fase anatase-rutilo, e as amostras continham até 77% em peso de rutilo e 5% em peso de brookita após calcinação a 450 ° C.
Em publicação anterior [29], síntese de nanodimensionamento TiO 2 pós por peptização ácida de xerogéis sob condições de umidade atmosférica foi realizada. Foi observado que a peptização ácida acompanhada de vibrações ultrassônicas tem efeito sobre o TiO 2 propriedades estruturais. No entanto, apenas alguns estudos foram dedicados ao estudo do efeito das condições de peptização na formação da fase rutilo e seu efeito subsequente na atividade fotocatalítica do TiO 2 nanopartículas. Neste artigo, examinamos a influência da natureza do ácido peptizante (H 2 SO 4 , HNO 3 e CH 3 COOH) na formação da fase rutilo e sua influência na eficiência fotocatalítica do TiO 2 nanopartículas na degradação de três diferentes poluentes orgânicos (cristal violeta (CV), azul de metileno (MB) e p -nitrofenol ( p -NP)).
Métodos
Preparação de nanopartículas de TiO2 usando diferentes ácidos de peptização
Tetra-isopropóxido de titânio [Ti (OPri) 4 ] foi usado como precursor de Ti, e a hidrólise de Ti (OPri) 4 foi realizado em condições atmosféricas padrão [29]. O procedimento de síntese típico pode ser descrito como segue:50 mL de Ti (OPri) 4 foi colocado em frasco de vidro escuro, sendo o frasco mantido na capela por 15 dias. A temperatura e a umidade da coifa foram medidas como 25 ± 5 ° C e 50 ± 10%, respectivamente. A hidrólise do precursor de Ti foi completada em 15 dias, e a solução resultante foi transformada em um gel, que foi então seco para a obtenção do xerogel. O ácido peptizante (100 mL de 1 N CH 3 COOH ou HNO 3 ou H 2 SO 4 ) foi pipetado para um copo de vidro, e a quantidade conhecida de pó de xerogel amorfo (2,0 g) foi adicionada lentamente ao ácido peptizante sob agitação constante. Em seguida, o béquer foi colocado em banho de ultrassom que foi mantido a 40 ° C, e a mistura foi submetida a tratamento ultrassônico por 10 min. O TiO peptizado 2 nanopartículas foram coletadas após centrifugação. Em seguida, os materiais foram lavados com água destilada e calcinados por 3 ha 500 ° C. As amostras sintetizadas foram rotuladas como TiO 2 prefixo de acrônimo após seu ácido peptizante como “ace,” “nit,” e “sul” correspondendo a CH 3 COOH, HNO 3 , e H 2 SO 4 , respectivamente.
Caracterização do material
Os perfis de difração de raios-X de pó foram coletados usando um difratômetro Philips PW1700 com radiação Cu Kα e monocromador de grafite com fenda divergente automática. Os perfis XRD foram indexados com dados JCPDS padrão. Fórmula de Spurr e Myers [30] [Eq. (1)] foi usado para determinar as frações de peso das fases anatase e rutilo.
$$ {X} _ {\ mathrm {R}} =1 / \ left [1 + k \ \ left ({I} _ {\ mathrm {A}} / {I} _ {\ mathrm {R}} \ direita) \ direita] $$ (1)
onde eu A e eu R são as intensidades integradas de (101) reflexão de anatase e (110) reflexão de rutilo, respectivamente. A constante empírica k foi considerado como 0,80 neste trabalho. O tamanho do cristalito das amostras sintetizadas foi medido usando a fórmula de Scherrer [Eq. (2)] e reflexões de anatase (101) e rutilo (110).
$$ D =B \ lambda / {\ beta} _ {1/2} \ cos \ theta $$ (2)
onde D é o tamanho médio do cristalito da fase, B é a constante de Scherrer (0,89), λ é o comprimento de onda da radiação de raios-X (1,54056 Å), β 1/2 é a largura total na metade do máximo da reflexão, e θ é o ângulo de difração.
A análise de TEM das amostras foi realizada usando microscópio Philips CM200FEG equipado com uma pistola de emissão de campo a 200 kV. O coeficiente de aberração esférica Cs =1,35 mm foi aplicado. Imagens HRTEM com um tamanho de pixel de 0,044 nm foram obtidas com uma câmera CCD. A análise espectral Raman de laser das amostras foi realizada usando espectrômetro Bruker Equinox 55 FT-IR equipado com um módulo FRA106 / S FT-Raman e um líquido N 2 Detector de Ge resfriado usando a linha de 1064 nm de um laser Nd:YAG com uma potência de saída do laser de 200 mW.
N 2 As medidas de fisiossorção foram realizadas usando o instrumento ASAP 2010, Micromeritics Instrument Corporation, EUA. Área de superfície específica ( S APOSTA ) das amostras foram medidas usando N 2 - valores de adsorção e a equação BET. A largura e o volume dos poros das amostras foram determinados aplicando o método BJH.
Refletância difusiva UV- vis espectros para TiO sintetizado 2 as amostras foram registradas usando o espectrofotômetro Thermo Scientific Evolution na faixa de comprimento de onda de 220–700 nm. A energia do gap das amostras foi determinada usando a transformação de Kubelka-Munk ( K ) conforme apresentado na Eq. (3).
$$ K =\ frac {{\ left (1-R \ right)} ^ 2} {2R} $$ (3)
onde R é a refletância. Os comprimentos de onda (nm) foram traduzidos em energias (eV), e um gráfico de \ ({\ left (\ mathrm {Kh} \ upnu \ right)} ^ {0,5} \) vs. hν foi desenhado. A energia do gap (eV) foi estimada como a interseção das duas inclinações da curva desenhada.
Os espectros de fotoelétrons de raios-X das amostras foram coletados usando o instrumento Thermo Scientific Escalab 250 Xi XPS com raios-X Al Kα tendo um tamanho de ponto de 650 mm. O deslocamento de pico devido à compensação de carga foi corrigido usando a energia de ligação de C 1s pico. Os dados foram adquiridos usando energia de passagem de 100 eV, tempo de espera de 200 ms com um tamanho de passo de 0,1 eV e 10–30 varreduras.
Degradação fotocatalítica de cristal violeta, azul de metileno e p -Nitrofenol
A degradação fotocatalítica de CV, MB e p Os experimentos de -NP foram conduzidos em um reator de vidro usando TiO sintetizado 2 amostras como fotocatalisador sob irradiação UV para diferentes tempos de reação. Foram utilizadas seis lâmpadas ultravioleta pretas (F20 T8 BLB) com potência de 18 W e dimensões de 60 × 2,5 cm. A potência total da irradiação UV na superfície de uma solução aquosa de corante orgânico foi medida com um detector Newport 918DUVOD3, e o medidor de potência foi medido como 13 Wm −2 . Cem miligramas de catalisador foram adicionados a 100 mL de solução aquosa de poluente orgânico (10 ppm). Antes da avaliação da eficiência fotocatalítica do catalisador, a solução do corante orgânico foi equilibrada com o catalisador por agitação por 45 min para estabilizar a adsorção do corante orgânico na superfície do catalisador. A degradação fotocatalítica de CV, MB e p -NP foi monitorado medindo a absorbância de corante orgânico em um intervalo de tempo regular usando um Thermo Fisher Scientific Evolution 160 UV- vis espectrofotômetro. A porcentagem de degradação foi calculada usando a expressão
$$ \ eta =\ left (1-C / {C} _0 \ right) \ vezes 100 $$ (4)
Onde C 0 é a concentração de corante orgânico antes da iluminação e C é a concentração após um certo tempo de reação.
A estabilidade dos fotocatalisadores foi analisada pelos experimentos de reutilização. A regeneração do catalisador foi realizada por meio de um procedimento simples. Após o primeiro ciclo de medição da atividade, o catalisador foi filtrado do fotorreator e as alíquotas por centrifugação. O catalisador obtido foi cuidadosamente lavado com água destilada e acetona. O catalisador foi seco a 50 ° C por 2 h e então reutilizado para o próximo ciclo de medições de fotocatálise. Da mesma forma, o experimento foi repetido por vários ciclos para estudar a estabilidade do catalisador.
Resultados e discussão
Difração de raios-X em pó
Os padrões de difração de raios-X de TiO calcinado 2 -ace, TiO 2 -nit e TiO 2 -sul amostras são exibidas na Fig. 1. As posições de pico de XRD e intensidades para TiO 2 fases apresentadas nas amostras são complementadas com o banco de dados JCPDS. É conhecido que a fase anatase mostra picos de difração principais em 2 θ valores de 24,8 °, 37,3 °, 47,6 °, 53,5 °, 55,1 ° e 62,2 ° correspondidos a (101), (004), (200), (105), (211) e (204) planos de cristal [JCPDS No. 21-1272]. Por outro lado, a fase do rutilo mostra os principais picos de difração em 2 θ valores de 27,0 °, 35,6 °, 40,8 °, 54,0 °, 53,9 °, 56,1 ° e 61,0 ° que correspondem aos planos de cristal de (110), (101), (200), (111), (210), ( 211), (220), (002) e (310) [JCPDS No. 21-1276]. O tamanho do cristalito e as frações em peso das fases anatase e rutilo apresentadas nas amostras foram determinados usando a fórmula de Scherrer e os métodos de Spurr e Myers, respectivamente. O padrão de pó XRD de TiO 2 -ace amostra mostrou que é composta de fase anatase pura (100%) com um tamanho de partícula de 48 nm (Tabela 1).
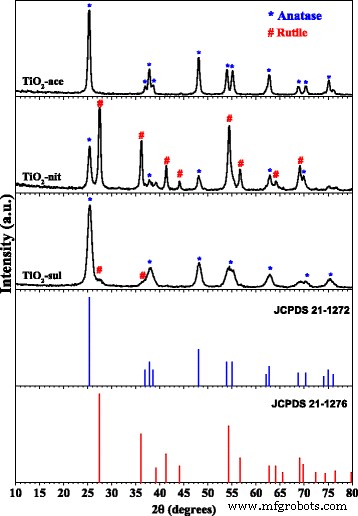
Padrões de XRD em pó do TiO calcinado 2 amostras (reimpressas com permissão de [29]. Copyright @ 2017 Elsevier)
O TiO 2 -sul amostra possuía principalmente fase anatase (95%) com tamanho de partícula em torno de 23 nm; no entanto, um pequeno pico de difração correspondente ao plano (110) da fase rutilo pode ser visto nesta amostra. Em contraste, TiO 2 amostra -nit mostrou reflexos de XRD para as fases anatase e rutilo com um tamanho de cristalito de 41 nm e 50 nm, respectivamente. Observa-se que o rutilo é a fase majoritária (67%) nesta amostra. Estes resultados indicam que a natureza do ácido peptizante desempenha um papel na formação de TiO 2 Estágio.
Microscopia Eletrônica de Transmissão de Alta Resolução
TEM foi realizado para examinar o tamanho das partículas, cristalinidade e morfologia do TiO sintetizado 2 nanopós. As imagens TEM e HRTEM de TiO sintetizado 2 nanopós são exibidos na Fig. 2. Pode-se ver que o TiO 2 -sul amostra consiste em partículas aglomeradas de anatase compactadas com tamanho médio de grão estimado em cerca de 7 nm. O TiO 2 -nit amostra possuía nanopartículas de tamanho entre 10 e 20 nm com morfologia esférica e também grandes folhas com largura de 20 nm. Em contraste, TiO 2 -ace a amostra consiste em TiO 2 nanopartículas (15–20 nm) consistiam em morfologia esférica principalmente definida. Vinogradov e Vinogradov [31] também observaram o tipo semelhante de resultados em que os agregados de tamanho pequeno foram detectados quando ácidos fortes de peptização como HNO 3 e H 2 SO 4 foram usados para a peptização. O tamanho do cristalito medido pela fórmula de Scherer resultou em tamanhos de cristalito maiores em comparação com o tamanho do grão medido com a análise TEM. Conforme relatado anteriormente, o tamanho do cristalito é diferente do tamanho do grão; entretanto, o tamanho do cristalito pode corresponder ao tamanho do grão em alguns casos [32]. Pode-se observar que as imagens HRTEM do TiO 2 -sul e TiO 2 -ace amostras mostraram partículas que continham franjas correspondendo a planos de rede de cristal de anatase com d - espaçamento de 0,356 nm para o plano (101) [33], enquanto a imagem HRTEM de TiO 2 -nit amostra mostrou partículas com franjas de rede para plano de rede de cristal rutilo (110) com d - espaçamento de 0,325 nm junto com o plano da rede de cristal de anatase (101).

Imagens TEM e HRTEM do TiO calcinado 2 amostras
Espectroscopia Raman
A espectroscopia Raman também foi usada para investigar a formação de fase no TiO 2 sintetizado amostras. A Figura 3 mostra os espectros Raman obtidos para os três TiO 2 amostras calcinadas a 500 ° C. É relatado que as fases anatase e rutilo possuíam seis e cinco bandas Raman ativas, respectivamente, (anatase 143, 195, 395, 512 e 638 cm −1 ; rutilo 145, 445, 611 e 826) [34]. É claro a partir da Fig. 3 que todas as três amostras mostraram banda Raman nítida altamente intensa ( E g ) no intervalo de 141–146 cm −1 , que é banda característica devido à presença da fase anatase. Bandas Raman de baixa intensidade devido às fases anatase e rutilo podem ser observadas claramente na figura inserida. O TiO 2 -nit e TiO 2 -sul amostras apresentaram bandas Raman devido às fases anatase e rutilo; no entanto, a intensidade das bandas Raman devido à presença da fase rutilo é alta no caso de TiO 2 -nit amostra. Em contraste, TiO 2 A amostra -ace exibiu bandas Raman devido apenas à fase anatase.
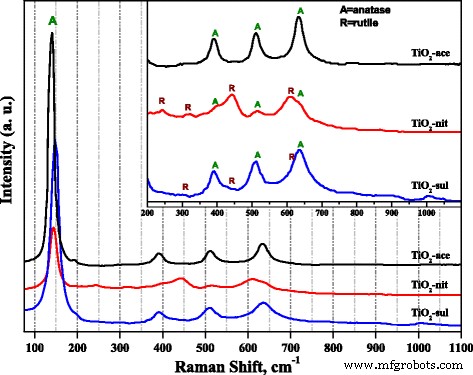
Espectros Raman do TiO calcinado 2 amostras
Foi relatado que os resultados da espectroscopia Raman podem ser usados para investigar o tamanho de partícula de TiO 2 nanopartículas, uma vez que um deslocamento de banda incomum de bandas Raman pode ser correlacionado com a diminuição do tamanho de partícula das amostras [35]. Na Fig. 3, o TiO 2 -ace amostra exibida E g banda a 141,5 cm −1 ; no entanto, a banda foi deslocada para 146 e 150 cm −1 no caso de TiO 2 -nit e TiO 2 -sul amostras, respectivamente. As observações dos espectros Raman indicam que TiO 2 -sul amostra possuía tamanho de partícula pequeno do que as outras duas amostras, o que está de acordo com as observações de XRD e TEM.
Difusa-Refletância UV- vis
O DR UV- vis espectros do TiO sintetizado 2 amostras tratadas termicamente a 500 ° C foram mostradas na Fig. 4. A posição do pico máximo na derivada do DR UV- vis espectros para três amostras foram mostrados na inserção da figura. Isso mostra claramente que as amostras têm uma forte refletância eletrônica na região do UV. O pico máximo de refletância é diferente para as amostras sintetizadas usando três ácidos diferentes. O TiO 2 -sul amostra mostrou pico máximo em 372 nm, enquanto é deslocado para 383 nm em TiO 2 -ace e 402 nm para TiO 2 -nit amostra, respectivamente. É relatado que o anatásio e o rutilo possuem energia de banda gap de 3,2 eV (380 nm) e 3,0 eV (415 nm), respectivamente [1]. As diferenças na refletância máxima podem ser atribuídas à mudança do tamanho do cristalito e da estrutura de fase das amostras [36]. O máximo de absorção mudou para comprimentos de onda mais altos para as amostras que têm mais porcentagem de fase de rutilo. A energia do band gap (eV) foi calculada para as amostras calcinadas determinando a relação entre hν e (αhν) [2] [Arquivo adicional 1:Figura S1]. Os dados revelaram que a energia do gap para TiO 2 -sul (3,12 eV) é maior em comparação com TiO 2 -ace (2,99 eV) e TiO 2 -nit (2,97 eV). A lacuna de banda do TiO 2 diminuiu quando a fase rutilo é dominada na amostra. Foi relatado que a banda de valência (VB) das fases anatase e rutilo é principalmente devida a O 2p estados; por outro lado, a banda de condução (CB) é composta por Ti 3d estados [37]. A energia do intervalo de banda do TiO 2 é estabelecido pelas posições CB e VB, que são influenciadas principalmente pela composição de fase. Assim, a energia do intervalo de banda da amostra que continha as fases anatase e rutilo deve estar entre os valores de anatase e rutilo puros.
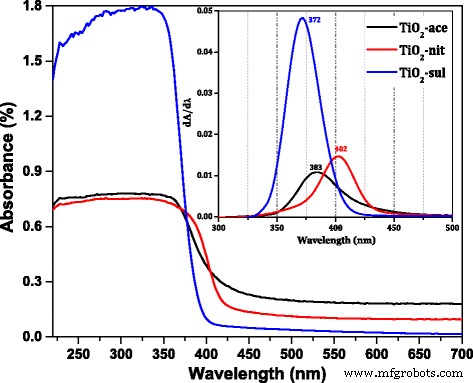
DR UV- vis espectros do TiO calcinado 2 amostras (inserção; a derivada do DR UV- vis espectro)
N 2 - Medições de fiseorção
Isotermas de adsorção-dessorção de nitrogênio para as três amostras sintetizadas são apresentadas na Fig. 5a. Isotermas do tipo IV com loop de histerese do tipo H2 foram observadas para as amostras sintetizadas por peptização com ácido acético (TiO 2 -ace) e ácido sulfúrico (TiO 2 -sul). Isso indica que essas duas amostras possuem mesoporos resultantes dos agregados de TiO 2 nanopartículas. No entanto, a isoterma típica do tipo IV com circuito de histerese do tipo H3 estreito (característica de poros abertos e / ou em fenda) foi observada para TiO 2 -nit amostra. Também pode ser observado que o ciclo de histerese foi fechado em alta pressão relativa ( P / P 0 = 1) e esta observação indicando a presença de poros de grande tamanho [38].
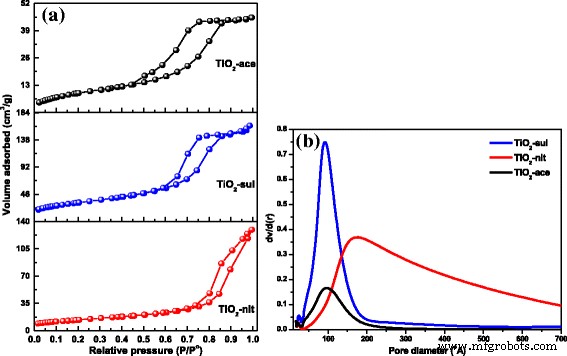
a N 2 isotermas de adsorção-dessorção. b Distribuição do tamanho dos poros para o TiO calcinado 2 amostras (reimpressas com permissão de [29]. Copyright @ 2017 Elsevier)
As distribuições de tamanho de poro do modelo BJH para os materiais sintetizados foram obtidas a partir dos valores do ramo de adsorção das isotermas. As distribuições de tamanho de poro BJH das amostras são mostradas na Fig. 5b. Distribuições estreitas de tamanho de poro monomodal foram observadas para TiO 2 -ace e TiO 2 -sul samples. No entanto, foi observada uma distribuição mais ampla do diâmetro dos poros para a amostra preparada com ácido nítrico, provavelmente devido aos espaços vazios existentes entre as partículas maiores. As propriedades texturais das amostras são apresentadas na Tabela 1. Os resultados mostraram que a área de superfície elevada (115 m 2 g −1 ) foi observado para o TiO 2 -ace amostra calcinada a 500 ° C. A ordem de S APOSTA mudança foi TiO 2 -ace> TiO 2 -sul> TiO 2 -nit. Os resultados observados indicam claramente que as condições de peptização adaptadas foram muito eficazes na geração de nanopartículas com textura porosa.
Espectroscopia de infravermelho com transformada de Fourier
A atividade fotocatalítica do TiO 2 depende da cristalinidade, tamanho do cristalito, composição, taxa de recombinação elétron-buraco, área de superfície e também a densidade dos grupos hidroxila da superfície [39]. Técnicas espectroscópicas FTIR e XPS foram usadas para investigar a natureza dos grupos –OH apresentados no TiO calcinado 2 amostras. A Figura 6 mostra os espectros de FTIR para os três TiO 2 amostras na faixa de 1600–4000 cm −1 . É relatado que TiO 2 o suporte pode possuir diferentes tipos de grupos hidroxila de superfície; eles podem ser categorizados como Ti-OH isolados, grupos hidroxila ligados um ao outro por meio de ligação de hidrogênio e H 2 quimicamente ligado Moléculas O [40].
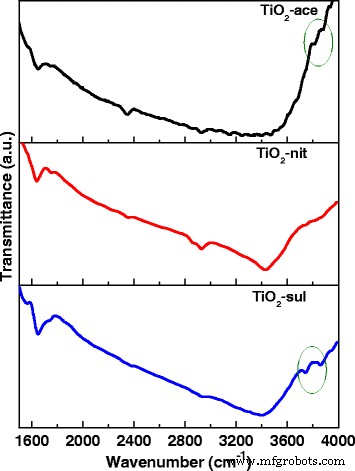
Espectros de FTIR do TiO calcinado 2 amostras
As três amostras mostraram uma banda larga centrada em 3408 cm −1 , que é atribuído à vibração de alongamento dos grupos O-H (moléculas de água e os grupos -OH da superfície livre). Bandas adicionais também apareceram em 2340 e 1640 cm −1 , que poderia ser atribuído a vibração de alongamento O-H e H 2 adsorvido molecularmente O, respectivamente [41]. Uma existência de duas vibrações de alongamento –OH no caso de anatase (em 3715 e 3675 cm −1 ) e uma banda fraca em 3680 cm −1 com rutilo foram relatados anteriormente [42]. Um resultado muito semelhante pode ser visto no caso de TiO 2 sintetizado amostras.
Espectroscopia de fotoelétrons de raios-X
A Figura 7 mostra Ti 2p deconvoluído e O 1s Espectros XP para TiO sintetizado 2 amostras. As três amostras mostraram dois picos principais em 457,2 e 463,1 eV correspondendo a 2p 3/2 e 2p 1/2 de Ti 4+ em TiO 2 [43]. Valores de energia de ligação muito semelhantes foram observados em Ti 2p região para todos os três TiO 2 amostras indicando que os átomos de Ti nessas amostras existiam no mesmo estado de oxidação. Dois pequenos picos de ombros em 455,8 e 458,7 eV também foram observados para todas as amostras. O ombro em 455,8 eV pode ser atribuído a um Ti 3+ estado, devido a uma deficiência de oxigênio em TiO 2 [44], enquanto o outro pico do ombro em 458,7 eV surge de um Ti 4+ estado da espécie Ti-OH [45]. É claro a partir do Ti 2p espectros de que a contribuição de TiO deficiente em oxigênio 2 espécie é superior em TiO 2 -nit que TiO 2 -sul e TiO 2 -ace samples. Todas as amostras mostraram O 1s Picos de XP em 528,4, 529,3 e 531,3 eV. O pico XPS em 528,4 eV pode ser atribuído a O-Ti 4+ espécies no TiO 2 rede cristalina, enquanto outros dois picos em 529,3 e 531,3 eV podem ser atribuídos a espécies de oxigênio apresentadas em grupos hidroxila adsorvidos na superfície [46].
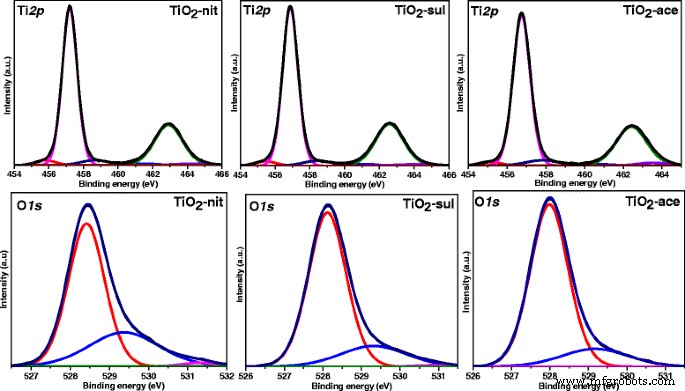
Ti 2p e O 1s Espectros de fotoelétrons de raios-X para o TiO calcinado 2 amostras
McCafferty [47] também observou que o O 1s pico possuía um pico de cauda nos altos valores de energia de ligação, o que poderia ser devido à presença de grupos Ti-OH. Como a superfície fisicamente adsorvida, os grupos Ti-OH podem ser facilmente removidos sob o ultra-alto vácuo usado para operar o instrumento XPS [48]. Esses grupos –OH apresentados nas amostras devem ser devidos ao Ti-OH, que estão quimicamente ligados aos defeitos de superfície do TiO 2, onde as porcentagens de grupos –OH em espécies de oxigênio total para TiO 2 -nit amostra são ligeiramente maiores do que o TiO 2 -sul e TiO 2 -ace (Tabela 2).
Degradação fotocatalítica de cristal violeta, azul de metileno e Para -nitroFenol Corantes
A atividade fotocatalítica de TiO calcinado 2 nanopartículas para a degradação de CV, MB e p -NP foi estimado. É relatado que a reação de degradação fotocatalítica geralmente segue a cinética de Langmuir-Hinshelwood [1]. Assim, a degradação fotocatalítica de corantes orgânicos pode ser expressa como
$$ - \ mathrm {dc} / \ mathrm {dt} =\ mathrm {kC} $$ (5)
e após a integração, Eq. (4) pode ser derivado
$$ C ={C} _0 {\ exp} ^ {\ left (- \ mathrm {kt} \ right)} $$ (6)
onde C 0 é a concentração inicial (ppm) dos corantes orgânicos, e k é a constante de velocidade, que depende do tempo de reação, da temperatura e do pH da solução. Normalmente, a eficiência fotocatalítica do catalisador aumenta com o tempo na corrente.
Os experimentos em branco foram realizados para confirmar a significância do fotocatalisador e da irradiação UV. Nenhuma reação ocorreu quando o catalisador e a irradiação UV foram aplicados isoladamente. Resultados semelhantes foram observados em nossos achados anteriores [49]. Conforme notificado na seção experimental, o TiO 2 fotocatalisadores foram equilibrados com a solução de corante orgânico por 45 min para determinar a adsorção de corantes orgânicos em TiO sintetizado 2 amostras. O UV- vis espectro de absorção de CV, MB e p -NP foram registrados após o equilíbrio do fotocatalisador. Arquivo adicional 1:As Figuras S2, S3 e S4 exibiram a variação no UV- vis espectros de absorbância de CV, MB e p Soluções -NP (10 ppm) com tempos de reação diferentes sobre TiO 2 -ace, TiO 2 -sul e TiO 2 -nit amostras, respectivamente. A intensidade dos picos de absorção que corresponde ao CV, MB e p -NP diminuiu com o aumento do tempo de reação. O UV- vis espectros de produtos de reação indicam que os corantes orgânicos foram degradados durante a fotorreação. O TiO 2 -nit amostra considerada o fotocatalisador mais eficaz em comparação com TiO 2 -sul e TiO 2 -ace samples. Degradação de 50% de p -NP foi observado dentro de 60 min para o TiO 2 -nit amostra, enquanto 75 e 100 min foram necessários para a degradação de 50% p -NP para o TiO 2 -ace e TiO 2 -sul amostras em condições semelhantes. Padrões de atividade fotocatalítica semelhantes foram observados para a degradação dos corantes MB e CV.
A porcentagem de eficiência de degradação dos catalisadores investigados foi calculada usando a Eq. (4). A Figura 8 mostra as mudanças percentuais de CV, MB e p -NP aqueous solution at room temperature in the presence of calcined TiO2 amostras. After just 10 min of the reaction, the TiO2 -nit sample showed 29% CV degradation efficiency, while TiO2 -ace and TiO2 -sul samples showed only 17 and 9%, respectively. The photocatalytic activity steeply increased with the increase of reaction time over the three samples. However, after 120 min, TiO2 -nit and TiO2 -ace samples showed 99% efficiency; however, TiO2 -sul sample showed only 65% efficiency.
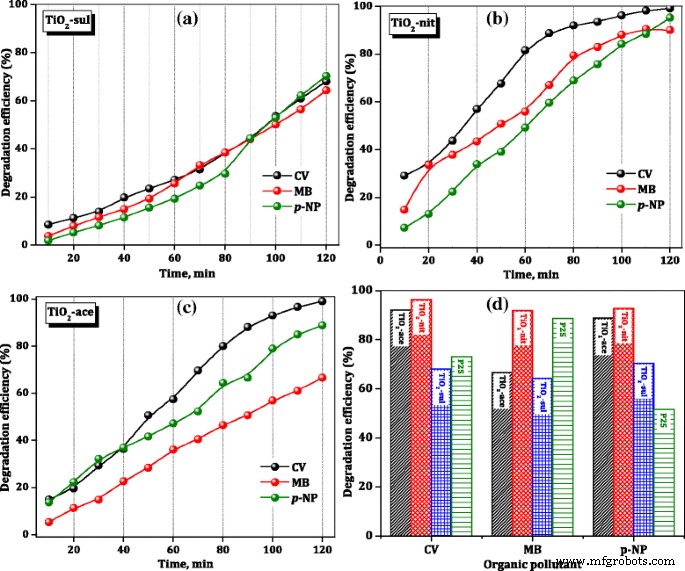
Photocatalytic degradation efficiency of TiO2 catalysts
To compare the photocatalytic performance of synthesized TiO2 samples, the degradation efficiency of the commercial P25 sample for organic dyes after 120 min is included in Fig. 8d. It is clear that TiO2 -nit sample showed better performance than the P25 sample in the degradation of three organic dyes; however, TiO2 -ace and TiO2 -sul samples showed lower activity than the P25 catalyst in case of p -NP degradation. These results are suggesting that the performance of catalysts is influenced by the physicochemical characteristics of the TiO2 samples and nature of the organic dye.
The rate constants for photocatalytic degradation of CV, MB, and p -NP over synthesized TiO2 samples and commercial P25 sample were determined from the slope of the straight line which is plotted between ln(C 0 /C t ) and t , and the results are presented in Table 3. The observed results are indicating that the photocatalytic activity of the degradation of organic dyes was greatly influenced by the composition of TiO2 sample and amount of the surface hydroxyl groups. The activity indeed is not influenced by the particle size, crystallinity, and surface area of TiO2 synthesized in this work. This observation is not consistent with the results observed by Fujishima et al. [8] that the catalyst which possesses lower particle size offered high photocatalytic efficiency.
Previously, it was reported that anatase is a better photocatalyst than rutile due to its high band gap energy and a large number of surface OH groups [50]. It was thought that TiO2 -nit sample would offer low photocatalytic activity due to the presence of more rutile phase (67%). However, Masahashi et al. [51] claimed that rutile exhibited higher performance than anatase MB degradation due to its superior crystalline nature.
Determination of photocurrent values was carried out to obtain a better insight responsible factor for the superior photocatalytic performance of the samples containing more rutile. It was reported that photocatalytic activity is directly related to the electron-hole separation efficiency of a catalyst which is influenced by the photocurrent density [52]. Theoretical photocurrent density of the TiO2 samples was calculated from the absorption edge of the TiO2 samples (obtained from DR UV-vis spectroscopy measurements) and theoretical equations (supporting information) presented in the literature [53]. The results of photocurrent of TiO2 samples are presented in Table 4 along with the percentage of rutile and photocatalytic efficiency values. The photocurrent density of TiO2 -nit (0.545 mA/cm 2 ) is higher than other two synthesized TiO2 samples and also commercial P25 sample (0.401 mA/cm 2 ), manifesting the beneficial role of rutile phase in improving the photoactivity of TiO2 amostras.
Previously, Melcher et al. [54] reported that photocatalytic capability of the commercial P25 material originates due to the presence of a mixture of rutile and anatase phases in the sample (75% anatase and 25% rutile). Hirakawa et al. [55] indicated that pure rutile itself is not a powerful photocatalyst, and it is also reported that the light with a wavelength of 380 nm is not powerful enough to generate charge carriers in the pure anatase [56]. Based on XPS spectroscopy results and theoretical calculations, Scanlon et al. [57] concluded that electrons were moved from rutile to anatase and the holes were transported from anatase to rutile, which inhibited the electron-hole recombination. Yu et al. [58] reported a similar observation that TiO2 sample with mixed phases was beneficial to decrease the rate of h + -e − recombination and thus enhance the photocatalytic efficiency of the catalyst.
In literature reports, two possible transfer mechanisms have been proposed for anatase-rutile composite samples [59]. The first mechanism is the interfacial electron transfer from CB of anatase to that of the rutile [60], and the second one is an electron transfer from CB of rutile to lower energy anatase active sites [61]. It is known that the anatase CB possesses higher negative potential than the rutile CB due to the fact that anatase has a higher band gap (3.12 eV) than rutile. Therefore, it is not possible for an electron to move from the rutile CB to the anatase CB because it would have to overcome the energetic barrier between the two bands. The band gap of anatase VB is also slightly higher, than the rutile VB, so the generated holes could be moved to the anatase VB, to achieve an effective charge separation. Most probably, the electron-hole pair is formed in the composite of rutile and anatase in case of TiO2 -nit and TiO2 -sul samples (Fig. 9), and this rate is much higher in TiO2 -nit sample due to predominant rutile formation.
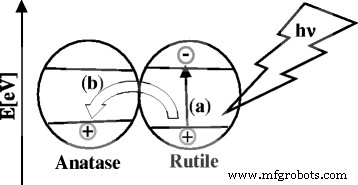
Plausible model of a generation of electron-hole pairs and b effective charge carrier separation via transfer of the generated holes into the anatase valence band
It was reported that increase of crystal growth of initial phase is possible by increasing the mobility of ions presented in precursor solution [62]. Several researchers added small volumes of mineral acids (such as hydrochloric acid and sulfuric acid) to improve the mobility of dissociated ions [63]. Their role is not only to increase the rate of diffusion of ions in a solution but also to alter the surface charge. Under humidity conditions, titanium isopropoxide can subsequently undergo hydroxylation and polymerization to TiO2 .
$$ \mathrm{Ti}{\left(\mathrm{OPri}\right)}_4+4{\mathrm{H}}_2\mathrm{O}\to \mathrm{Ti}{\left(\mathrm{OH}\right)}_4+4\ \mathrm{PriOH}\kern2.5em \left(\mathrm{hydroxylation}\right) $$ (7) $$ \mathrm{Ti}{\left(\mathrm{OH}\right)}_{4\kern0.5em }\to {\mathrm{TiO}}_{2.}x{\mathrm{H}}_2\mathrm{O}+\left(2\hbox{-} x\right)\ {\mathrm{H}}_2\mathrm{O}\kern5em \left(\mathrm{condensation}\right) $$ (8)
Depending on the nature of peptizing acid, the transformation of TiO2 leads to anatase or rutile phase [64]. Formation of amorphous TiO2 or metastable anatase phase was observed when the condensation initiated before hydrolysis of Ti precursor. Under highly acidic conditions, the rutile phase formation is favorable as the rate of condensation is slow. Accordingly, the rutile phase was obtained when sulfuric and nitric acids were used for the peptization. The use of weak acid (acetic acid) as a peptizing agent allows the control of both the degree of condensation and oligomerization and persuades the preferential crystallization of TiO2 in the anatase phase. Zeng et al. [20] used polycarboxylic acid as a peptizing agent and observed the formation of nanoparticles of anatase which they attributed to chelation effect of organic acid.
It is known that TiO6 octahedra are a fundamental structural unit for both anatase and rutile phases (D 4h system), and the only difference between these two structures is the assembly of the octahedral chains [65]. Face-shared linking of TiO6 units results in anatase structure, while edge-shared linking results in rutile structure [66]. It is clear that NO 3− anions possessed weaker affinity to Ti atoms in an aqueous solution than CH3 COO − and SO4 2− anions. The strong affinity of CH3 COO − and SO4 2− anions with Ti atoms is responsible for the inhibition of the phase transformation.
In the previously reported studies, many of the photocatalysts have not been tested for reuse mainly due to undergo photocorrosion; hence, their photostability is reduced for further usage. The reusability of the calcined TiO2 samples was examined to study the effectiveness of these photocatalysts. It was observed that the used photocatalyst offered 90% efficiency for three consecutive cycles. The efficiency of the catalyst was reduced to 80 and 75% during fourth and fifth cycle, respectively. The decrease is due to the loss of some amount of catalyst during the filtration and regeneration procedures.
Conclusions
A simple peptization method was adapted to synthesize TiO2 nanoparticles by using sulfuric, nitric, and acetic acid as peptizing agents and titanium isopropoxide as Ti precursor. The influence of acid species on the crystal phase, morphology, textural, and surface composition of TiO2 were studied in detail. O TiO 2 sample peptized with acetic acid possessed pure anatase phase, while the formation of minor (5%) and major (67%) of rutile phase was observed in case of samples peptized with sulfuric acid and nitric acid, respectively. It is observed that TiO2 peptized with nitric acid showed sheet-like structures along with nanoparticles, while TiO2 samples peptized with sulfuric and acetic acids possessed near spherical nanoparticles. The photocatalytic properties of synthesized TiO2 nanostructures were evaluated for photodegradation of aqueous CV, MB, and p -NP solutions. O TiO 2 peptized using nitric acid showed the best photocatalytic activity than commercial P25 and other two peptized samples, and its photodegradation efficiency was reached to 95% in 120 min for p -NP degradation. Although TiO2 samples peptized using sulfuric acid and acetic acid possessed smaller particle size, higher band gap energy, and high surface area, TiO2 sample peptized with nitric acid possessed a higher percentage of rutile and photocurrent density. The observed photocurrent density is dominated by the photoactivity of TiO2 . The results indicate a direct correlation between the photocatalytic activity and the photocurrent density of the TiO2 amostras. The superior activity of TiO2 sample peptized with nitric acid is due to the effective transfer of photogenerated electrons between rutile and anatase phases, and large pore diameter could have enhanced the diffusion and mass transportation of reacting molecules and OH radicals during the photochemical reaction. O TiO sintetizado 2 photocatalysts can be recycled with a minor change in the activity.
Abreviações
- CV:
-
Crystal violet
- DR UV-vis :
-
Diffuse-reflectance ultraviolet-visible spectroscopy
- FTIR:
-
Espectroscopia de infravermelho com transformada de Fourier
- HRTEM:
-
Microscopia eletrônica de transmissão de alta resolução
- MB:
-
Methylene blue
- NMR:
-
Nuclear magnetic resonance
- p –NP:
-
para –nitro phenol
- TEM:
-
Microscopia eletrônica de transmissão
- TiO2 :
-
Titanium oxide
- XPS:
-
espectroscopia de fotoelétrons de raios-X
- XRD:
-
Difração de pó de raios-x
Nanomateriais
- Rota de eletrofiação em uma etapa de nanofibras de Rutilo TiO2 modificadas com SrTiO3 e suas propriedades fotocatalíticas
- Alto desempenho fotocatalítico de dois tipos de fotocatalisadores compostos de TiO2 modificados com grafeno
- Nanopartículas como bomba de efluxo e inibidor de biofilme para rejuvenescer o efeito bactericida de antibióticos convencionais
- Rumo aos nanofluidos de TiO2 - Parte 2:Aplicações e desafios
- Efeito da distribuição de nanopartículas de ouro em TiO2 nas características ópticas e elétricas de células solares sensibilizadas por corante
- Os efeitos da relação Li / Nb na preparação e desempenho fotocatalítico de compostos Li-Nb-O
- Atividades fotocatalíticas aprimoradas por nanopartículas de Au-plasmônica em fotoeletrodo nanotubo de TiO2 revestido com MoO3
- Preparação e desempenho fotocatalítico de fotocatalisadores de estrutura oca LiNb3O8
- Propriedades ópticas estruturais e de infravermelho próximo visível de TiO2 dopado com Cr para pigmentos frios coloridos
- Matrizes de nanotubos de TiO2:fabricadas por modelo Soft-Hard e a dependência do tamanho do grão do desempenho de emissão de campo



