Carbon Dots @ Platinum Porfirina Composto como Nanoagente Teranóstico para Terapia Eficiente Fotodinâmica do Câncer
Resumo
Os fotossensibilizadores são moléculas sensíveis à luz altamente hidrofóbicas, o que representa um desafio para seu uso na terapia fotodinâmica. Conseqüentemente, esforços consideráveis têm sido feitos para desenvolver transportadores para a entrega de PSs. Aqui, sintetizamos um novo nanoagente teranóstico (CQDs @ PtPor) por meio da interação eletrostática entre o complexo porfirina tetraplatinado (PtPor) e os CQDs carregados negativamente. O tamanho e a morfologia dos CQDs preparados e dos CQDs @ PtPor foram caracterizados por uma série de métodos, como XRD, TEM, XPS e espectroscopia FTIR. O composto CQDs @ PtPor integra as propriedades ópticas dos CQDs e a função anticâncer da porfirina em uma única unidade. Os resultados espectrais sugeriram a transferência de energia de ressonância efetiva de CQDs para PtPor no composto CQDs @ PtPor. Impressionantemente, o composto CQDs @ PtPor mostrou o efeito PDT mais forte do que o PtPor molecular orgânico, sugerindo que CQDs @ PtPor é vantajoso em relação à formulação convencional, atribuível à eficiência aprimorada de 1 O 2 produção de PtPor por CQDs. Assim, este nanocarreador de droga à base de CQDs exibiu eficácia de inibição de tumor aumentada, bem como efeitos colaterais baixos in vitro, mostrando potencial de aplicação significativo na terapia do câncer.
Histórico
A terapia fotodinâmica (PDT) tem sido amplamente praticada como uma modalidade terapêutica não invasiva promissora para o tratamento de muitas doenças humanas, incluindo várias condições da pele, degradação macular relacionada à idade e câncer [1]. O PDT pode ser usado sozinho ou em combinação com cirurgia, quimioterapia ou radiação ionizante [2]. Na terapia fotodinâmica, os fotossensibilizadores (PSs) são irradiados por um comprimento de onda de luz específico, o que desencadeia a geração de espécies reativas de oxigênio a partir do oxigênio intracelular que consequentemente induzem a morte celular e necrose dos tecidos proximais [3,4,5,6]. Como os fotossensibilizadores são normalmente inofensivos sem luz, o tratamento do tumor pode ser precisamente direcionado por iluminação seletiva, limitando assim os danos aos tecidos saudáveis circundantes [7,8,9]. Foi demonstrado que os fotossensibilizadores ativáveis, como a porfirina e derivados de ftalocianinas, possuem imagens simultâneas de câncer e capacidades de terapia, e alguns desses fotossensibilizadores foram aprovados para uso clínico [10, 11]. No entanto, muitos deles são limitados por causa da baixa solubilidade em água, fotossensibilidade cutânea prolongada, seletividade inadequada e sua incapacidade de serem absorvidos na região (> 700 nm) onde a pele é mais transparente, que são encontrados em aplicações clínicas de numerosos produtos químicos. Portanto, várias abordagens foram propostas para incorporar PSs em transportadores, como lipossomas [12], nanopartículas poliméricas [13, 14], nanopartículas de ouro [15,16,17], nanotubos de carbono [18], grafenos [19] e carbono nanopontos [20,21,22].
Recentemente, os pontos quânticos de carbono (CQDs), como um novo tipo de nanomaterial de carbono, têm atraído considerável atenção devido às suas propriedades únicas, como propriedades ópticas superiores, excelente solubilidade em água, baixa toxicidade, excelente biocompatibilidade, boa permeabilidade celular e preparação fácil e modificação. Assim, CQDs têm demonstrado muitas aplicações promissoras em optoeletrônica, sensoriamento [23, 24], teranóstico [25,26,27] e campos de bioimagem. Durante os últimos anos, vários métodos foram desenvolvidos para sintetizar uma variedade de CQDs, como método hidrotérmico, método de microondas, método de tratamento térmico e método eletroquímico [28]. Entre eles, métodos hidrotérmicos usando precursores naturais para produzir CQDs foram amplamente relatados devido à sua natureza química verde [29, 30].
Além disso, CQDs tem o potencial de ser uma plataforma de carregamento para várias moléculas devido aos seus grupos de superfície abundantes e biocompatibilidade razoável [31, 32]. Em particular, quando funcionalizados com diferentes grupos químicos, CQDs podem ser projetados com vários elementos funcionais, como moléculas de drogas, proteínas e aptâmeros por interação covalente ou não covalente para aplicações biomédicas versáteis [33]. Por exemplo, em 2012, Huang et al. projetou uma nova plataforma teranóstica baseada em pontos de carbono conjugados com fotossensibilizador. Após a irradiação, os CQDs-Ce6 preparados exibiram a emissão de fluorescência mais forte e maior eficácia fotodinâmica em relação ao Ce6 sozinho [34]. Em 2014, Choi et al. desenvolveu uma plataforma teranóstica semelhante baseada em CQDs conjugados a FA carregados com ZnPc [3]. No mesmo ano, Wang et al. desenvolveu conjugados conectando eletrostaticamente TMPyP com CQDs não tóxicos [35]. Em 2015, Beack et al. sintetizou um conjugado CQDs-Ce6-HA, que mostrou efeito fotodinâmico muito maior do que o de Ce6 livre e CQDs-Ce6 [36].
Mais recentemente, um novo complexo de porfirina tetraplatinado foi relatado por Naik et al. Os resultados mostraram que a porfirina de platina exibiu citotoxicidade menor no escuro, mas IC 50 valores abaixo de 19 nM após irradiação de laser de 420 nm, sugerindo que o complexo de porfirina tetraplatinado é um agente anticâncer promissor para terapia de câncer [37]. No entanto, as porfirinas tetraplatinadas sintetizadas exibiram baixa biocompatibilidade e baixa solubilidade em água, o que limitou seu uso clínico. Para tanto, aqui, desenvolvemos um novo nanoagente teranóstico (CQDs @ PtPor) por meio da interação eletrostática entre o complexo porfirina tetraplatinado (PtPor) e os CQDs carregados negativamente (Esquema 1). O composto CQDs @ PtPor integra as propriedades ópticas dos CQDs e a função anticâncer da porfirina em uma única unidade. Os resultados espectrais sugeriram a transferência de energia de ressonância efetiva de CQDs para PtPor no composto CQDs @ PtPor. Impressionantemente, o CQDs @ PtPor mostrou o efeito PDT mais forte do que o de PtPor sozinho, o que pode ser atribuído à maior eficiência de 1 O 2 geração de PtPor por CQDs. Além disso, o tamanho pequeno de CQDs @ PtPor pode permitir o acúmulo seletivo no local do tumor por meio do efeito EPR. Assim, a nanoagnet preparada (CQDs @ PtPor) mostrou grande potencial de aplicação na terapia do câncer.
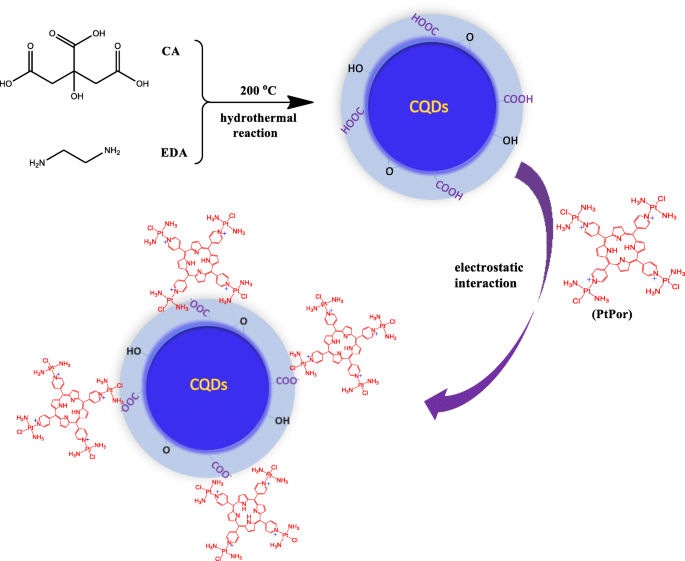
Ilustração esquemática da preparação de CQDs @ PtPor
Métodos
Dicloreto de diammina trans-platina (transplatina) foi adquirido de Aladdin®. O 1,3-difenilisobenzofurano (DPBF) foi obtido na Sigma-Aldrich. Todos os solventes foram adquiridos da Tianjin Fu Chen Chemical Reagents. Os outros produtos químicos foram adquiridos da Sinopharm Chemical Reagent Co., Ltd. e usados conforme recebidos.
Síntese de [Trans-PtCl (NH 3 ) 2 ] 4 -5,10,15,20-Tetra (4-piridil) -Porfirina Nitrato
Transplatina (0,193 mmol, 58 mg) e nitrato de prata (0,193 mmol, 33 mg) foram dissolvidos em 5 mL de DMF. Após coluna por 24 h, o cloreto de prata branco formado foi removido da solução turva resultante através da centrifugação para adquirir a solução límpida, que foi então adicionada à suspensão de 5,10,15,20-Tetra (4-piridil) porfirina (0,487 mmol, 30 mg) em 3 mL de DMF. Após agitação a 50 ° C durante 48 h, a mistura foi arrefecida até à temperatura ambiente. Em seguida, foram adicionados 10 mL de éter dietílico para obter o precipitado vermelho, que foi então lavado com metanol, diclorometano e éter dietílico. Finalmente, a amostra foi seca sob vácuo para adquirir 81 mg do produto. Rendimento 86%. 1 H NMR (400 MHz; DMSO-d 6 ):δ 9,45 (d, 8H), 9,14 (s, 8H), 8,52 (m-piridil, d, 8H), 4,70 (NH 3 , s, 24H), - 3,04 (s, 2H); MS (ESI): m / z =1209 [M-3 (NÃO 3 ) -2 {PtCl (NH 3 ) 2 }] + , 1074 [M-4 (NO 3 ) -2 {PtCl (NH 3 ) 2 } -2NH 3 -Cl-2H] + , 883 [M-4 (NÃO 3 ) -3 {PtCl (NH 3 ) 2 }] + , 866 [M-4 (NÃO 3 ) -3 {PtCl (NH 3 ) 2 } -NH 3 ] + , 812 [M-4 (NÃO 3 ) -3 {PtCl (NH 3 ) 2 } -Cl-2 (NH 3 )] + , 574 [M-4 (NÃO 3 ) -2 {PtCl (NH 3 ) 2 }] 2+ .
Preparação dos CQDs
Geralmente, ácido cítrico (0,45 g) e etilenodiamina (500 μL) foram dissolvidos em água DI (10 mL). Em seguida, a solução foi transferida para uma autoclave revestida com poli (tetrafluoroetileno) (Teflon) (30 mL) e aquecida a 200 ° C durante 5 h. Após a reação, os reatores foram resfriados à temperatura ambiente por água ou naturalmente. O produto bruto, que era marrom-escuro, foi purificado em uma centrífuga por 30 min para remover as partículas aglomeradas, e então dialisado contra água DI para obter os CDs.
Preparação do composto CQDs @ PtPor
A molécula PtPor, com quatro cargas positivas no anel de piridina, pode se ligar nas superfícies dos CQDs carregados negativamente por meio de uma interação eletrostática para obter o compósito CQDs @ PtPor. Em geral, 20 mg de PtPor dissolvidos em 3 mL de DMSO foram dispersos em 12 mL de água. A solução foi adicionada lentamente à suspensão de CQDs (5 mg de CQDs dissolvidos em 15 mL de H 2 O) sob sonicação. Após agitação à temperatura ambiente por 24 h, a solução foi purificada em uma centrífuga por 30 min para remover as partículas aglomeradas, e então dialisada contra água DI por 2 dias. A solução aquosa de CQDs @ PtPor foi liofilizada a 4 ° C para produzir o produto desejado.
O cálculo dos rendimentos quânticos de CQDs
O rendimento quântico de CQDs foi medido com sulfato de quinina como referência (0,1 M H 2 SO 4 solução aquosa, rendimento quântico fluorescente ∼ 54%) pela seguinte equação:
$$ \ upvarphi \ kern0.5em =\ kern0.5em {\ upvarphi} _ {\ mathrm {st}} \ left (I / {I} _ {\ mathrm {st}} \ right) \; {\ left ( \ upeta / {\ upeta} _ {\ mathrm {st}} \ right)} ^ 2 $$
Onde Φ é o rendimento quântico de fuorescência, I é a inclinação das curvas e η é o índice de refração do solvente. O subscrito “st” refere-se à referência de rendimento quântico conhecido (sulfato de quinina em 0,1 M H 2 SO 4 ) A absorção foi mantida abaixo de 0,1 no comprimento de onda de excitação de 360 nm para minimizar a reabsorção.
Geração de oxigênio singlet
Uma solução da amostra e 3-difenilisobenzofurano foram irradiados em uma cubeta de vidro (3 mL), à temperatura ambiente. O decaimento da absorção de DPBF em 415 nm foi medido em intervalos de irradiação de 3 min até 30 min. A produção de oxigênio singlete foi avaliada qualitativamente por meio do DPBF, um supressor de oxigênio singlete. A porcentagem da queda da absorção DPBF, proporcional à produção de 1 O 2 , foi avaliada pela diferença entre a absorbância inicial e a absorbância após um determinado período de irradiação. Cada experimento foi repetido três vezes.
Ensaio de citotoxicidade de CQDs, PtPor e CQDs @ PtPor
Células de carcinoma cervical humano (HeLa) foram cultivadas em meio de Eagle modificado por Dulbecco (DMEM) suplementado com 5% de soro fetal de bezerro (FCS), 100 U / mL de penicilina, 100 μg / mL de estreptomicina a 37 ° C e 6% de CO 2 . O ensaio de viabilidade do metiltiazoliltetrazólio (MTT) foi realizado de acordo com um método padrão. Em resumo, células HeLa (3 × 10 3 / poço) foram semeados em placas de 96 poços por 24 h antes da exposição aos medicamentos. As células foram tratadas com amostras durante a noite no escuro. A citotoxicidade foi determinada pelo ensaio de redução do MTT. As monocamadas de células foram enxaguadas duas vezes com solução salina tamponada com fosfato (PBS) e depois incubadas com 50 μL de solução de MTT (0,5 mg / mL) a 37 ° C por 3 h. Depois que a mídia foi removida, 100 μL de DMSO foram adicionados. A solução foi agitada durante 30 min para dissolver os cristais de formazan formados em células vivas. A absorbância foi medida em comprimento de onda duplo, 540 nm e 690 nm, em um leitor de microplacas Labsystem Multiskan (Merck Eurolab, Suíça). Cada concentração dosada foi realizada em poços em triplicado e repetida duas vezes para o ensaio de MTT.
A fotocitotoxicidade das amostras foi avaliada por um protocolo semelhante. Em geral, células HeLa (3 × 10 3 por poço) foram incubados em placas de 96 poços por 24 h antes de sua exposição aos medicamentos. As células foram tratadas com as amostras no escuro durante a noite. Em seguida, as células foram expostas a uma lâmpada de xenônio de 50 W equipada com um filtro de isolamento térmico e um filtro passa-longa de 500 nm por 10 min. A taxa de fluência foi de 6 mW / cm 2 . A viabilidade celular foi determinada pelo ensaio de redução MTT.
Aplicações de bioimagem de CQDs @ PtPor
A imagem celular foi avaliada usando um microscópio confocal de varredura a laser. Células HeLa (5 × 10 4 células por poço) foram semeadas em placas de cultura de 6 poços e deixadas aderir por 12 h. As células foram então tratadas com CQDs @ PtPor (0,25 mg / mL) a 37 ° C durante 1 h. Em seguida, o sobrenadante foi cuidadosamente removido e as células foram lavadas três vezes com PBS. Posteriormente, as lâminas foram montadas e observadas em microscópio confocal (Zeiss Laser Scanning Confocal Microscope; LSM7 DUO) por meio do software ZEN 2009 (Carl Zeiss).
Resultados
Preparação de CQDs @ PtPor
Os CQDs foram preparados por meio de uma reação hidrotérmica de um único recipiente de acordo com o método descrito na literatura [38], conforme mostrado no Esquema 1. O PtPor foi sintetizado através da complexação da transplatina substituída com 5, 10, 15, 20-Tetra (4-piridil ) porfirina de acordo com o método relatado [37]. Uma vez que a molécula de PtPor tem quatro cargas positivas no anel de piridina, que poderia se ligar nas superfícies dos CQDs carregados negativamente por meio de uma interação eletrostática, produzindo o composto CQDs @ PtPor desejado.
Caracterização de CQDs @ PtPor
As imagens do microscópio eletrônico de transmissão (TEM) (Fig. 1 à esquerda) mostram que os CQDs preparados e os CQDs @ PtPor são homogeneamente distribuídos com tamanhos uniformes. O tamanho de partícula mostrado na Fig. 1 à direita é estreito (1-9 nm) e o tamanho médio, determinado pelo histograma, é 2,5 e 7,6 nm para CQDs e CQDs @ PtPor, respectivamente. O tamanho médio dos CQDs @ PtPor é maior do que o dos CQDs, provavelmente devido à adsorção da molécula de PtPor na superfície dos CQDs por meio de uma interação eletrostática.
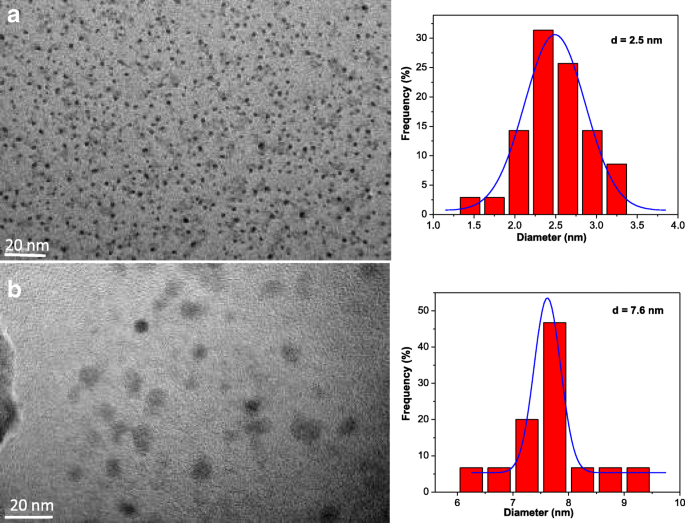
Imagens TEM (esquerda) e histogramas de distribuição de tamanho correspondentes (direita) de a CQDs e b CQDs @ PtPor
A Figura 2a mostra o padrão de difração de raios-X (XRD) dos CQDs como sintetizados. O amplo pico de XRD de CQDs aparece em torno de 23 °, indicando a estrutura desordenada de CQDs [39]. Os grupos funcionais dos CQDs foram caracterizados por espectroscopia FTIR. Conforme mostrado na Fig. 2b, os picos amplos de 3.000 a 3.500 cm −1 são atribuídos a vibrações de alongamento O-H e N-H, indicando a presença de grupos hidroxila e amino. Os picos em 1150 e 1230 cm −1 são atribuídos às vibrações de alongamento C-O e C-N, respectivamente. A ligação amida é confirmada pelos picos típicos em 1678 e 1392 cm −1 , atribuindo às vibrações de C =O e C-N da amida, respectivamente. Finalmente, o pico em 1600 cm −1 é identificado como ligação C =C / C =N. Em comparação com os resultados de FTIR de ácido cítrico, os CQDs não exibiram nenhuma absorção característica significativa de ácido cítrico (CA), indicando que CA deve ser principalmente carbonizado durante o processo de hidrólise. Além disso, um novo pico nítido em 1700 cm −1 , atribuída à ligação amida foi encontrada, indicando que a etilenodiamina deve ser funcionalizada na superfície de CQDs através da ligação -CONH-. O diâmetro médio e a distribuição do tamanho de partícula de CQDs e CQDs @ PtPor foram determinados por medição DLS (arquivo adicional 1:Figura S1 e Figura 2c). Como mostrado na Fig. 2c, o tamanho médio de CQDs @ PtPor é de cerca de 9,2 nm, o que é consistente com o resultado do teste TEM. A medição do potencial zeta foi ainda conduzida para confirmar a conjugação entre CQDs e PtPor. Conforme mostrado na Fig. 3d, o potencial zeta de CQDs livres é - 15,6 mV, devido às cargas negativas na superfície. Após a conjugação com PtPor, o potencial zeta do composto CQDs @ PtPor foi alterado para 4,5 mV, indicando a cobertura bem-sucedida de CQDs pelas moléculas de PtPor.
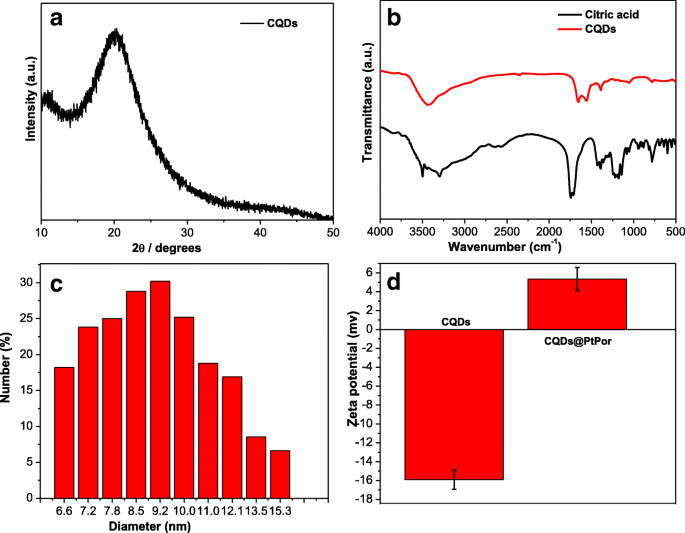
Padrão de XRD de CQDs ( a ) O espectro FTIR de CQDs ( b ) Distribuição de tamanho de partícula de CQDs @ PtPor medido por espalhamento de luz dinâmico ( c ) Potencial Zeta de CQDs e CQDs @ PtPor ( d )
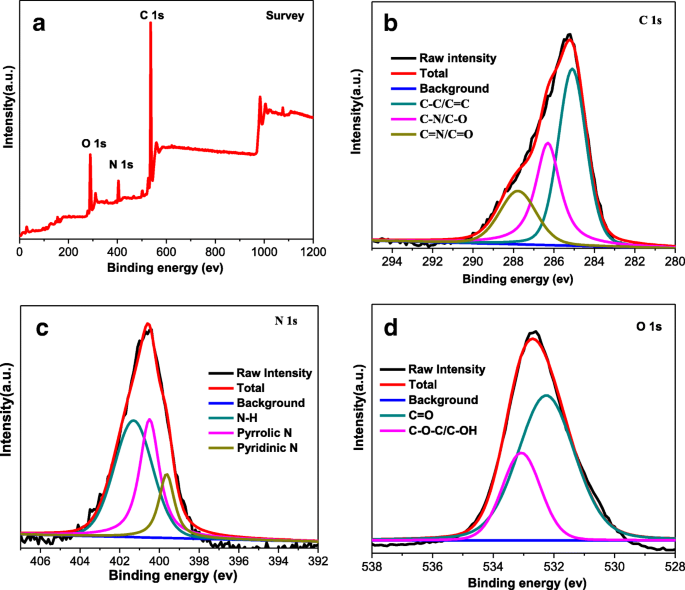
Espectro de pesquisa XPS ( a ), e C 1s ( b ), N 1s ( c ), e O 1s ( d ) espectros XPS de alta resolução de CQDs
A espectroscopia de fotoelétrons de raios-X (XPS) foi realizada para investigar a composição química de CQDs (Fig. 3) e CQDs @ PtPor (Arquivo adicional 1:Figura S2). O espectro de pesquisa de CQDs na Fig. 3a indica que os elementos de existência na superfície são C, N e O, com os sinais relacionados em 535, 402 e 283 eV, respectivamente [40]. O sinal C 1s mostrado na Fig. 3b tem três picos distintos em 284,4 eV, 286,3 eV e 288,2 eV, que são atribuídos à ligação C-C, ligação C-O e ligação C =O, respectivamente. O XPS N 1s de alta resolução mostrado na Fig. 3c é equipado com três picos, com energias de ligação em 395,3, 399,1 e 402,2 eV, correspondendo ao N semelhante à piridina, N pirrólico e N quaternário, respectivamente [41]. A deconvolução de O 1s exibiu os picos C-O e O-H (Fig. 3d), indicando a existência de grandes grupos carboxílicos na superfície dos CQDs.
Propriedades fotofísicas de CQDs @ PtPor
Os espectros de absorção e fluorescência de UV-Vis foram executados para investigar as propriedades fotofísicas do compósito. Como mostrado na Fig. 4a, o compósito CQDs @ PtPor mostrou os picos característicos de CQDs e porfirina. Por exemplo, um pico de absorção significativo em torno de 360 nm foi provavelmente atribuído à transição n → π * de CQDs [42], enquanto os picos em torno de 425 nm, 520 nm e 580 nm foram atribuídos às bandas soret e Q de porfirina , respectivamente. A solução aquosa de CQDs mostra emissão azul sob a irradiação de uma lâmpada ultravioleta (UV) de 365 nm. Além disso, os CQDs exibiram o comportamento PL dependente de excitação, onde o pico de emissão mudou de 460 para 552 nm quando o comprimento de onda de excitação mudou de 280 para 500 nm, conforme mostrado na Fig. 4b. O rendimento quântico de fluorescência dos CQDs preparados foi de 36% com sulfato de quinina como referência.
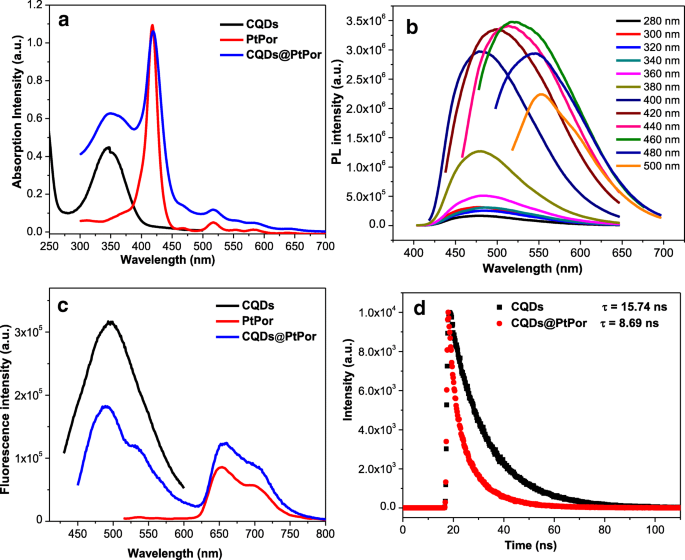
Absorção UV-Vis ( a ) e fluorescência ( b ) espectros de CQDs, PtPor e CQDs @ PtPor. Espectro de fluorescência ( c ) de CQDs com diferentes comprimentos de onda de excitação. A fluorescência decai ( d ) de CQDs e CQDs @ PtPor. A concentração de amostras:CQDs (5 μg / mL), CQDs @ PtPor (5 μg / mL, 3 μg / mL) e PtPor (3 μg / mL)
Discussão
O efeito da transferência de energia de ressonância de fluorescência (FRET) no composto CQDs @ PtPor pode ser investigado através da comparação da intensidade de fluorescência de CQDs @ PtPor com CQDs e PtPor. Os espectros de fluorescência e as intensidades de CQDs, PtPor e CQDs @ PtPor com a mesma concentração foram medidos sob a excitação de 360 nm (Fig. 4c). Uma vez que os CQDs mostraram absorção muito forte em 360 nm (Fig. 4a) com o rendimento quântico PL tão alto quanto 36%, ele emite fluorescência muito forte. Pelo contrário, como a absorção de PtPor a 360 nm é muito baixa e seu rendimento quântico PL é inferior a 1%, o PtPor apresenta emissão muito fraca. Notavelmente, a intensidade da emissão de azul (500 nm) em CQDs @ PtPor diminuiu obviamente em comparação com CQDs livres, enquanto a emissão de vermelho (660 nm) é significativamente aumentada em relação à de PtPor sozinho, indicando a transferência de energia eficiente no composto CQDs @ PtPor . O tempo de vida de fluorescência de CQDs no compósito CQDs @ PtPor diminuiu em relação ao dos CQDs livres, como mostrado na Fig. 4d. Essa diminuição evidente no tempo de vida do doador indica ainda a transferência de energia de ressonância eficaz de CQDs para PtPor no compósito CQDs @ PtPor.
Uma vez que a produção de oxigênio singlete é um fator-chave no PDT, o 1 O 2 geração foi determinada por um método químico usando 1,3-difenilisobenzofurano (DPBF) como o 1 O 2 Carniceiro. Em geral, a intensidade de absorção do DPBF diminuirá gradualmente na presença de oxigênio singlete. Portanto, a taxa de diminuição da intensidade de absorção de DPBF pode ser usada para avaliar o rendimento relativo de oxigênio singlete. Neste experimento, CQDs (5 mg / mL), PtPor (5 mg / mL) ou CQDs @ PtPor (5 mg / mL) foram misturados com DPBF (10 mM), respectivamente, seguido pela irradiação com lâmpada de xenônio. Conforme mostrado na Fig. 5a, após a adição de CQDs, a absorção de DPBF não apresentou qualquer alteração com o prolongamento do tempo de irradiação, indicando que os CQDs não tiveram produção significativa de oxigênio singlete. Além disso, o composto CQDs @ PtPor exibiu uma degradação muito óbvia para DPBF, que é muito maior do que a de PtPor, indicando que o 1 O 2 o rendimento de porfirina pode ser aumentado sob o papel de CQDs. Enquanto isso, a produção de 1 O 2 foi posteriormente quantificado usando o reagente diclorofluoresceína (DCFH). A fluorescência verde (λ em =525 nm) de DCFH é conhecido por aumentar quantitativamente quando reage com 1 O 2 gerado a partir dos fotossensibilizadores. Conforme mostrado na Fig. 5b, o composto CQDs @ PtPor apresentou maior eficiência de 1 O 2 produção do que a de PtPor puro. Esse resultado é bastante consistente com o obtido pelo método DPBF.
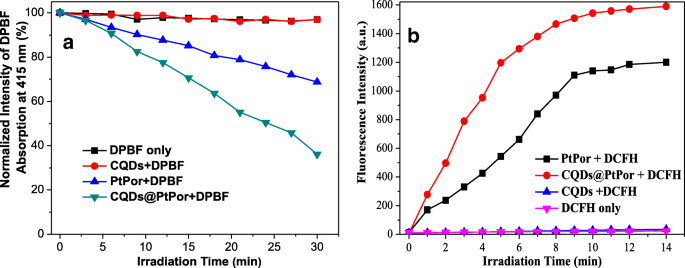
Geração de oxigênio singlete de CQDs, PtPor e CQDs @ PtPor a partir do método DPBF ( a ) e método DCFH ( b )
A citotoxicidade de CQDs, PtPor e CQDs @ PtPor sobre células HeLa foi testada através do ensaio de metiltiazoliltetrazólio (MTT). Como mostrado na Fig. 6a, todas as três amostras exibiram citotoxicidade insignificante contra células HeLa após tratamento por 24 h no escuro. Mais de 90% das células cancerosas ainda estavam vivas com sua concentração aumentada para 50 μg / mL, sugerindo que todas as três amostras não tiveram efeito adverso nas células cancerosas no escuro. Além disso, a fotocitotoxicidade de três amostras foi posteriormente avaliada usando um método semelhante. Conforme mostrado na Fig. 6b, após o tratamento de células cancerosas com CQDs @ PtPor por 24 h seguido por irradiação de luz, a viabilidade celular diminuiu gradualmente com o aumento da concentração da amostra. Quando a concentração de CQDs @ PtPor foi de 50 μg / mL, a taxa de sobrevivência das células cancerosas foi de apenas 8%, o que foi aparentemente menor do que a de PtPor sozinho (18%) e CQDs (90%). Ou seja, o composto CQDs @ PtPor exibiu eficácia terapêutica mais forte do que a de PtPor sozinho, sugerindo que CQDs @ PtPor é vantajoso em relação à formulação convencional, o que é provavelmente atribuído à maior eficiência da geração de oxigênio singlete de PtPor por CQDs.
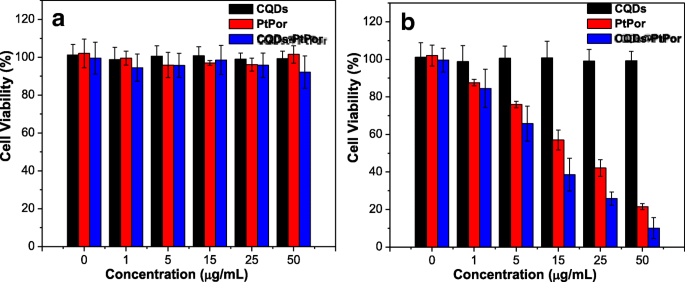
Citotoxicidade escura ( a ) e fotocitotoxicidade ( b ) de CQDs, PtPor e CQDs @ PtPor em diferentes concentrações
A captação celular de CQDs, PtPor e CQDs @ PtPor puros foi estudada usando um microscópio de varredura a laser confocal sob excitação de um laser de 405 nm. Como mostrado na Fig. 7, o compósito CQDs @ PtPor distribuído principalmente no citoplasma de células HeLa. Além disso, a imagem de fluorescência azul de CQDs é quase sobreposta com a emissão vermelha daquela de PtPor no composto CQDs @ PtPor, indicando que os CQDs e PtPor permaneceram no estado de ligação após o composto CQDs @ PtPor entrar nas células. Esses resultados verificam que o compósito CQDs @ PtPor é estável no ambiente celular e ainda pode realizar a transferência de energia de ressonância de fluorescência nas células.
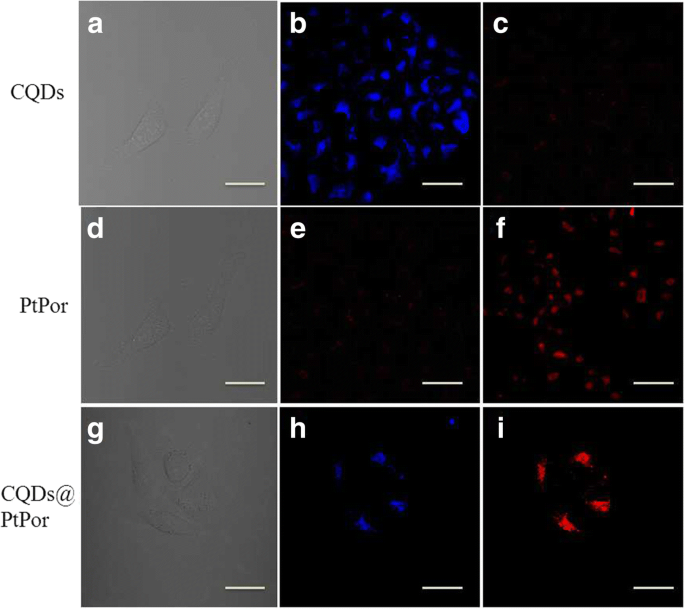
As imagens de microscopia de fluorescência confocal de células HeLa sob excitação de 405 nm após o tratamento com 50 μg / mL de CQDs puros ( a - c ), PtPor ( d - f ), e CQDs @ PtPor ( g - i ) por 24 h. a , d , g Campo brilhante. b , e , h O canal de imagem CQDs, detectado na região de comprimento de onda de 410–450 nm. c , f , i O canal de imagem PtPor, detectado com a região de passagem longa de 590 nm; (barra de escala =20 μm)
Conclusões
Um novo nanoagente teranóstico (CQDs @ PtPor) foi projetado e desenvolvido com sucesso através da interação eletrostática entre o complexo porfirina tetraplatinado (PtPor) e os CQDs carregados negativamente. O composto CQDs @ PtPor conforme preparado exibiu alta dispersibilidade em água, boa estabilidade e biocompatibilidade e detecção aprimorada de fluorescência de fotossensibilizador. O efeito PDT de CQDs @ PtPor foi significativamente aumentado em relação ao de PtPor sozinho, sugerindo que CQDs @ PtPor é vantajoso sobre a formulação convencional devido à eficiência aprimorada de 1 O 2 geração de PtPor por CQDs. Assim, este nanoagente baseado em CQDs exibiu eficácia terapêutica aprimorada sobre células cancerosas, bem como efeitos colaterais baixos in vitro, mostrando grande potencial para aplicações na clínica para tratar pacientes com câncer em um futuro próximo.
Histórico de alterações
Abreviações
- CA:
-
Ácido Cítrico
- CQDs:
-
Pontos quânticos de carbono
- DPBF:
-
1,3-difenilisobenzofurano
- EDA:
-
Etilenodiamina
- MTT:
-
Brometo de 3- (4,5-dimetiltiazol-2-il) -2,5-difeniltetrazólio
- PDT:
-
Terapia fotodinâmica
- PSs:
-
Fotossensibilizadores
- TEM:
-
Microscopia eletrônica de transmissão
- UV:
-
Ultravioleta
- XPS:
-
espectroscopia de fotoelétrons de raios-X
- XRD:
-
Difração de raios X
Nanomateriais
- Nanopartículas para terapia do câncer:progresso e desafios atuais
- Composto de MoS2 / Acetileno com poucas camadas como um ânodo eficiente para baterias de íon-lítio
- Uma abordagem simples para sintetizar pontos quânticos de carbono fluorescentes de águas residuais de Tofu
- Na4Mn9O18 / Composto de Nanotubo de Carbono como um Material de Alto Desempenho Eletroquímico para Baterias Aquosas de Íons de Sódio
- Composto de aerogel de carbono ativado revestido com polianilina para bateria de lítio-enxofre de alto desempenho
- Síntese fácil em um vaso de pontos de carbono de polidopamina para terapia fototérmica
- Incorporação de materiais compostos de carbono nanoestruturados em contra-eletrodos para células solares sensibilizadas com corante altamente eficientes
- Um fotocatalisador composto ZnO / Fe3O4 / g-C3N4 magnético reciclável ternário para fotodegradação eficiente de corante Monoazo
- Entrega de siRNA à base de micela catiônica para terapia gênica eficiente do câncer de cólon
- Nanopartículas de ouro bioconjugadas ambientalmente compatíveis como agentes de contraste eficientes para imagiologia de câncer induzida por inflamação



