Fósforo orgânico e fonte de cálcio induzem a síntese de microesferas estruturadas em casca de gema de fosfato de cálcio com área de superfície altamente específica:aplicação em adsorção de HEL
Resumo
Microesferas de fosfato de cálcio estruturadas em casca de gema têm um grande potencial para aplicações médicas devido às suas excelentes propriedades físico-químicas e biocompatibilidade. No entanto, o desenvolvimento de um fosfato de cálcio estruturado em casca de gema com alta capacidade de adsorção permanece um desafio. Aqui, uma microesfera estruturada em casca de gema porosa (ATP-CG) de fosfato de cálcio com área de superfície altamente específica [ S APOSTA =143 m 2 g −1 , que é aproximadamente três vezes maior do que as microesferas de ATP-CL sintetizadas pela substituição da fonte de cálcio por l-lactato pentahidratado (CL) de cálcio] foi sintetizado com sucesso usando o sal dissódico de 5'-trifosfato de adenosina (ATP) como fonte de fósforo e gluconato de cálcio monohidratado (CG) como fonte de cálcio por meio de uma abordagem autotemplante. As influências da razão molar de Ca para P (Ca / P), temperatura hidrotérmica e tempo na morfologia de microesferas de ATP-CG também foram investigadas. Verificou-se que a fonte orgânica de cálcio e a fonte orgânica de fósforo desempenham um papel vital na formação da estrutura da gema. Além disso, um lote de experimentos de adsorção foi investigado para iluminar o mecanismo de adsorção de dois tipos de microesferas estruturadas em casca de gema sintetizadas com diferentes fontes de cálcio. Os resultados mostram que a capacidade de adsorção das microesferas ATP-CG (332 ± 36 mg / g) é cerca de duas vezes maior do que a das microesferas ATP-CL (176 ± 33 mg / g). Além disso, a área de superfície específica mais elevada causada pela fonte de cálcio e as propriedades químicas de superfície únicas para as microesferas de ATP-CG desempenham um papel importante na melhoria da capacidade de adsorção de HEL. O estudo indica que a microesfera estruturada em casca de gema preparada é promissora para aplicação em campos de distribuição de drogas e fornece uma abordagem eficaz para melhorar a capacidade de adsorção de drogas.
Introdução
O fosfato de cálcio ganhou considerável atenção nos últimos anos devido à sua excelente biocompatibilidade [1], alta capacidade de carregamento e eficiência de entrega. Biomateriais relacionados ao fosfato de cálcio têm sido amplamente usados em vários campos biomédicos, como engenharia de tecidos [2], reparo ósseo [3] e administração de drogas [4]. A fim de estender a faixa de aplicação e melhorar o desempenho de materiais à base de fosfato de cálcio, vários materiais de fosfato de cálcio com variedades de morfologias e microestruturas, incluindo microesferas de hidroxiapatita carbonatada (HAp) [5], microtubos HAp [6], microesferas HAp ocas [7 ], nanoesferas de gema em gaiola mesoporosa de fosfato de cálcio amorfo (ACP) [8] foram relatadas.
Entre as várias morfologias, as microesferas estruturadas em casca de gema têm atraído cada vez mais atenções, visto que não são apenas ciência de materiais de fronteira, mas também apresentam características morfológicas únicas. Em microesferas estruturadas em casca de gema, o espaço vazio entre o núcleo da gema e a casca pode servir como um reservatório de armazenamento para várias cargas e a casca estruturada porosa pode fornecer uma via de difusão para moléculas convidadas, o que as torna com grande potencial para diversas aplicações, incluindo catálise [9], baterias de íon-lítio [10], fotocatalisador [11] e biomedicina [12]. Tradicionalmente, os métodos de modelo de sacrifício são os principais para preparar microesferas estruturadas em casca de gema [13, 14]. Essas estratégias de modelo obtiveram grande sucesso no ajuste da estrutura e propriedades. No entanto, essas abordagens apresentam algumas desvantagens. Por exemplo, etapas de processamento tediosas e surfactantes ou reagentes direcionadores de estrutura, que podem ser perigosos para a saúde humana. Atualmente, os métodos de auto-modelagem têm sido amplamente utilizados na pesquisa de microesferas estruturadas em casca de gema [15, 16]. Ao contrário das abordagens de modelagem tradicionais, os modelos empregados em abordagens de auto-modelagem não são apenas os modelos para formar os vazios, mas também os precursores de microesferas estruturadas em casca de gema. Assim, os métodos de auto-modelagem são abordagens convenientes para preparar microesferas estruturadas em casca de gema. No entanto, a introdução de abordagens de auto-modelagem para a síntese de microesferas de fosfato de cálcio estruturadas em casca de gema permanece um desafio interessante.
Além disso, materiais de fosfato de cálcio têm sido utilizados para transportar diferentes tipos de cargas, como proteínas [17], DNA [18] e siRNA [19]. No entanto, a fraca capacidade de adsorção de fármaco de fosfato de cálcio precisa ser resolvida com urgência. Geralmente, as abordagens das moléculas de drogas que se imobilizam sobre a superfície do carreador dependem das propriedades da superfície contendo potencial de superfície [20], hidrofobicidade / hidrofilicidade [21], ligação de hidrogênio [22] e área de superfície específica [23]. Portanto, melhorar as propriedades de superfície e a área de superfície específica é uma abordagem válida para aumentar a capacidade de adsorção de drogas do carreador.
Aqui, preparamos um tipo de microesferas porosas de fosfato de cálcio com estrutura de gema de gema usando adenosina 5'-trifosfato de sal dissódico (ATP) como fonte de fósforo e gluconato de cálcio monohidratado (CG) como fonte de cálcio por meio de abordagem de autotemplante. Sem qualquer adição de agente de modelagem, as microesferas de fosfato de cálcio estruturadas em casca de gema, conforme preparadas, exibem uma área de superfície altamente específica. Além disso, o comportamento de adsorção de lisozima de ovo de galinha (HEL) de microesferas de ATP-CG foi investigado em comparação com as microesferas de ATP-CL preparadas pela substituição da fonte de cálcio por l-lactato de cálcio penta-hidratado (CL). Os resultados revelam que a diferença da área superficial específica causada pela fonte de cálcio e as propriedades químicas da superfície desempenham um papel vital na melhoria da capacidade de adsorção de HEL.
Métodos
Materiais
O sal dissódico de 5'-trifosfato de adenosina (ATP) foi obtido de Macklin Biochemical Co., Ltd (Shanghai, China). Gluconato de cálcio mono-hidratado (CG) e cálcio (I) -lactato penta-hidratado (CL) foram adquiridos de Sangon Biotech Co., Ltd (Shanghai, China). A lisozima de ovo de galinha (HEL, ~ 70000 U / mg) foi adquirida na Sigma-Aldrich (Taufkirchen, Alemanha).
Síntese e caracterização de microesferas estruturadas em casca de gema ATP-CG e ATP-CL
As microesferas de fosfato de cálcio estruturadas em casca de gema ATP-CG foram preparadas como segue:Em resumo, 0,9 g de CG foi dissolvido em 20 mL de água ultrapura para formar a solução C a 60 ° C e 0,11 g de ATP foi dissolvido em 5 mL de água ultrapura para formar a solução P. Em seguida, a solução C foi resfriada até a temperatura ambiente e misturada com a solução P sob agitação vigorosa e o pH da solução foi ajustado por solução de NaOH 2 M a 5. O volume final da solução foi 30 mL com a adição extra de água ultrapura e a razão molar de Ca para P (Ca / P) foi de 3,3. A solução final foi transferida para um sistema de digestão por micro-ondas para reação hidrotérmica de micro-ondas e tratada a 120 ° C por 15 min. Os precipitados resultantes foram coletados por centrifugação (4500 rpm, 10 min), enxaguados com água ultrapura e liofilizados por 48 h. As microesferas ATP-CL foram preparadas de acordo com os procedimentos da literatura [24].
A fase cristalina das microesferas foi caracterizada por difração de raios-X (XRD, Cu K α fonte, λ =0,154). A morfologia das microesferas foi observada por microscopia eletrônica de varredura (MEV), microscopia eletrônica de transmissão (TEM) e TEM de alta resolução (HRTEM). As composições das microesferas foram estudadas por espectrofotômetro de infravermelho com transformada de Fourier (FTIR). A área de superfície específica das microesferas foi determinada por Brunauer-Emmett-Teller (BET). A termogravimetrianálise (TGA) foi empregada para estudar as propriedades térmicas de amostras a uma taxa de aquecimento de 10 ° C / min em atmosfera de nitrogênio.
Adsorção e caracterização HEL
Os experimentos de adsorção HEL de dois tipos de microesferas foram conduzidos da seguinte forma:as certas quantidades de microesferas de casca de gema (ATP-CG, Ca / P =3,3, 120 ° C, 15 min, e ATP-CL, Ca / P =2,5, 120 ° C, 30 min) foram dispersos na água com tratamento ultrassônico constante por 10 min para formar 1,5 mg / mL de suspensão de microesferas. Em seguida, 0,5 mL de soluções aquosas que contêm várias concentrações de HEL foram imediatamente adicionados a 1 mL acima da suspensão e as concentrações finais da droga foram de 1-7,5 mg / mL. Cada solução foi agitada (200 rpm) a 37 ° C durante 6 h. Posteriormente, as soluções foram centrifugadas e as quantidades de HEL nos sobrenadantes foram medidas por espectrofotômetro UV-vis a 280 nm. Os potenciais zeta e as composições das microesferas antes e após o carregamento da droga foram caracterizados por analisador de potencial zeta, espectrômetro FTIR e analisador termogravimétrico (TGA, taxa de aquecimento 10 ° C min −1 , atmosfera de nitrogênio).
Isoterma de Adsorção
A fim de investigar o comportamento de adsorção, o modelo de isoterma de Dubinin-Radushkevic (D-R) foi conduzido em nosso estudo. O modelo D-R é baseado na teoria de preenchimento de micropore, que é usado para descrever a sorção não ideal em uma superfície heterogênea, bem como distinguir o mecanismo de sorção (sorção física ou sorção química). O modelo é expresso pela seguinte equação:onde Q eq é a capacidade de adsorção do adsorvente em equilíbrio (mg / g), C eq é a concentração de adsorbato na fase aquosa em equilíbrio (mL / L). Q m é a capacidade máxima de adsorção. R é a constante do gás, 8,314 J / (mol ∙ k). T é a temperatura absoluta. E representa a energia livre média para estimar o tipo de adsorção. Se o E valor está abaixo de 8 kJ / mol, o tipo de adsorção pode ser explicado pela adsorção física, entre 8 e 16 kJ / mol, o tipo de adsorção pertence à troca iônica e maior que 16 kJ / mol, o tipo de adsorção pode ser descrito por adsorção química .
$$ {Q} _ {\ mathrm {eq}} ={Q} _m \ exp \ left (- {K} _ {\ mathrm {DR}} \ {\ varejpsilon} ^ 2 \ right) $$ (1) $$ \ varejpsilon =\ text {RT1n} (1+ \ frac {1} {{C} _ \ text {eq}}) $$ (2) $$ \ mathrm {E} =\ frac {1} {\ sqrt {K _ {\ mathrm {DR}}}} $$ (3)
Análise estatística de adsorção de drogas
Os dados foram apresentados como valor de média ± desvio padrão (DP). Diferenças significativas ( p <0,05) foram calculados estatisticamente entre grupos diferentes usando a ANOVA de uma via. Todos os experimentos foram realizados em triplicata e os dados analisados por meio do software DPS.
Resultados e discussão
Morfologia e caracterização química de microesferas
ATP-CG Yolk-Shell-Structured Microspheres
Imagens SEM na Fig. 1 mostram as morfologias de várias amostras obtidas em diferentes condições de reação. Em t =5 min ou 15 min, todos os produtos são compostos por microesferas uniformes. No entanto, quando o tempo hidrotérmico é ainda aumentado para 30 min, nanofolhas auto-montadas microesferas foram formadas (como mostrado na Fig. 1 f, i, l). Enquanto isso, o efeito do Ca / P na morfologia dos produtos também é observado em t =30 min. Conforme o aumento de Ca / P, as nanofolhas auto-montadas microesferas foram formadas gradualmente (como mostrado na Fig. 1 f, i, l). A formação de microesferas automontadas de nanofolhas pode ser explicada pelos seguintes motivos. Em primeiro lugar, sob o processo hidrotérmico de microondas, as moléculas de ATP podem hidrolisar para formar moléculas baseadas em adenosina, incluindo difosfato de adenosina (ADP), monofosfato de adenosina (AMP) e adenosina, e simultaneamente liberar íons de fosfato (PO 4 3− ) Enquanto isso, as moléculas de CG podem se hidrolisar para formar gluconato e íons de cálcio (Ca 2+ ) Então, os íons fosfato reagiriam com os íons cálcio para formar núcleos ACP primários [25]. Então, os núcleos ACP iniciais crescem e se agrupam para formar microesferas ACP. Portanto, quando o tempo hidrotérmico é estendido, as moléculas de ATP e CG em solução são hidrolisadas e liberam mais PO 4 3− e Ca 2+ íons, o que causa a formação de nanofolhas auto-montadas microesferas, melhorando a supersaturação do sistema e a taxa de nucleação. Além disso, ao aumentar o Ca / P, a alta concentração local de Ca 2+ também acelera a transformação da morfologia dos produtos da mesma forma que acima. A análise acima indica que o tempo hidrotérmico e o Ca / P têm importante influência na morfologia dos produtos.

Imagens SEM de microesferas ATP-CG preparadas pelo método hidrotérmico de microondas a 120 ° C
Em seguida, os espectros de FTIR de microesferas sintetizadas com vários Ca / P a 120 ° C por 15 min são investigados (Fig. 2). Os picos em 1620 cm −1 , 1383 cm −1 e 912 cm −1 atribuído aos picos característicos dos grupos C =O, C – O do CG e P – O do ATP [26], respectivamente, implicando que as moléculas de CG e ATP não hidrolisadas ou seus derivados são absorvidos na superfície das microesferas. O tênue pico característico do PO 4 3− do HAp está localizado a 1035 cm −1 [27] e os picos de absorção em 1122 cm −1 e 567 cm −1 são atribuídos ao PO 4 3− íons de ACP [28], indicando que os produtos são compostos de ACP e HAp. Os resultados do FTIR sugerem que o fosfato de cálcio é preparado com sucesso usando ATP como fonte de fósforo e CG como fonte de cálcio.
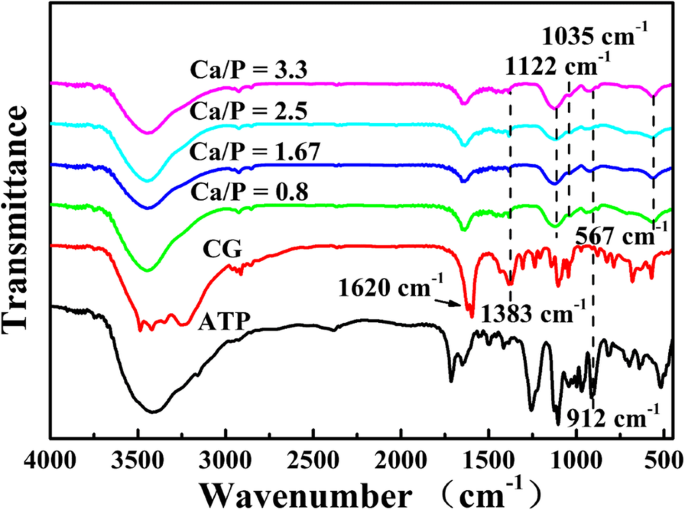
Espectros de FTIR de microesferas ATP-CG sintetizadas com vários Ca / P a 120 ° C por 15 min
Além disso, as imagens SEM e TEM de amostras sintetizadas com vários Ca / P através do método hidrotérmico de microondas a 120 ° C por 15 min são exibidas na Fig. 3. Quando o Ca / P é 0,8 ou 1,67, as amostras consistem em microesferas porosas ( Fig. 3b, d). Quando o Ca / P é 2,5, a morfologia dos produtos começa a se transformar em microesferas estruturadas em casca de gema (Fig. 3f). À medida que o Ca / P aumenta ainda mais para 3,3, os produtos são inteiramente compostos por microesferas estruturadas em casca de gema (Fig. 3h). Além disso, algumas das esferas quebradas e os núcleos expostos das microesferas da casca da gema (inserção na Fig. 3g) são observadas após fratura mecânica, fornecendo evidências de uma estrutura oca entre a gema e a casca. Com base na observação acima, propomos provisoriamente o mecanismo de formação de microesferas estruturadas em casca de gema sintetizadas com vários Ca / P. Quando o Ca / P é menor, as microesferas ACP porosas são formadas primeiro, o que é atribuído ao efeito de inibição das moléculas de ATP e CG ou seus derivados adsorvidos na superfície das microesferas. Então, conforme o Ca / P é ainda mais aumentado, o ACP metaestável aumentará ainda mais, o que é impulsionado pela alta supersaturação do sistema. Finalmente, os HAps cristalinos são formados na superfície externa, o que é confirmado pela imagem TEM de alta resolução (HRTEM) das microesferas na Fig. 3i (a distância interplanar de 0,308 nm pode ser indexada a (210) de HAp). Como resultado, as estruturas ocas entre a gema e a casca são geradas devido à diferença de volume ou densidade entre HAp e ACP [24]. O mapeamento EDS correspondente indica que os elementos Ca, P e O estão uniformemente distribuídos pelas microesferas. Os espectros de EDS na Fig. 3k e o espectro de XPS na Fig. 31 revelam que os elementos químicos das microesferas incluem principalmente Ca, P e O, o que é consistente com o resultado de FTIR (Fig. 2).

Imagens SEM e TEM de microesferas ATP-CG sintetizadas com vários tipos de Ca / P. a , b Ca / P =0,8. c , d Ca / P =1,67. e , f Ca / P =2,5. g , h Ca / P =3,3. eu HRTEM, j Mapeamento EDS, k Espectro EDS, l Espectros XPS de microesferas ATP-CG com Ca / P =3,3
O impacto do tempo hidrotérmico assistido por microondas e da temperatura na morfologia das microesferas sintetizadas com Ca / P =3,3 é investigado posteriormente. Conforme mostrado na Fig. 4a-b, quando o tempo hidrotérmico é de 5 min, as amostras são compostas por microesferas porosas. Conforme discutido acima, quando t =15 min, o produto também é composto por microesferas estruturadas em casca de gema (Fig. 4c-d). Quando o tempo hidrotérmico é estendido para 60 min ou a temperatura aumentada para 160 o C, os limites das folhas ou das hastes são observados (Fig. 4e-l). A transformação da morfologia de poroso para casca de gema para folha ou bastonete é atribuída ao crescimento posterior de ACP com a hidrólise contínua de moléculas de ATP e CG em solução. Além disso, a hidrólise das moléculas de ATP e CG ou seus derivados adsorvidos na superfície das microesferas ACP também acelera o crescimento de ACP. Um fenômeno interessante surgiu em 60 min ou 160 o C, essas folhas ou hastes também são desenvolvidas a partir de nanopartículas ACP (como mostrado nas caixas vermelhas), o que é confirmado pela análise DTA na Fig. S1. Um pico exotérmico a 650 ° C é observado nas curvas DTA [29, 30], o qual é atribuído à cristalização do ACP. O pico exotérmico torna-se gradualmente fraco com o aumento do tempo hidrotérmico ou da temperatura, implicando na transformação do ACP nos produtos em fosfato de cálcio cristalino.

Imagens SEM e TEM de microesferas ATP-CG sintetizadas com Ca / P =3,3 em diferentes condições experimentais. a , b T =120 ° C, t =5 min. c , d T =120 ° C, t =15 min. e – h T =120 ° C, t =60 min. i – l T =160 ° C, t =15 min
A constituição química e a estrutura de amostras sintetizadas com Ca / P =3,3 sob diferentes tempos ou temperaturas hidrotérmicas são investigadas pelo FTIR e pelo XRD. Conforme mostrado na Fig. 5a, os picos característicos de PO 4 3− íons de HAp estão localizados a 1037 cm −1 e 603 cm −1 [27]. O pico em 1122 cm −1 é atribuído ao pico característico do PO 4 3− íons de ACP. Os picos de absorção em 1620 cm −1 e 1383 cm −1 são atribuídos ao pico característico dos grupos C =O e C – O do GC, respectivamente. O pico de absorção em 912 cm −1 refere-se à vibração de alongamento P – O assimétrica do ATP. Ao aumentar o tempo ou temperatura hidrotérmica, a intensidade dos picos característicos de CG e ATP é gradualmente diminuída, indicando que as moléculas de ATP e CG ou seus derivados adsorvidos na superfície das microesferas são posteriormente hidrolisados. Enquanto isso, a intensidade do pico característico de PO 4 3− Os íons no HAp apresentam tendência de aumento gradativo com a diminuição da intensidade do pico característico do ACP, iluminando a transformação da fase cristalina dos produtos em direção à fase HAp.
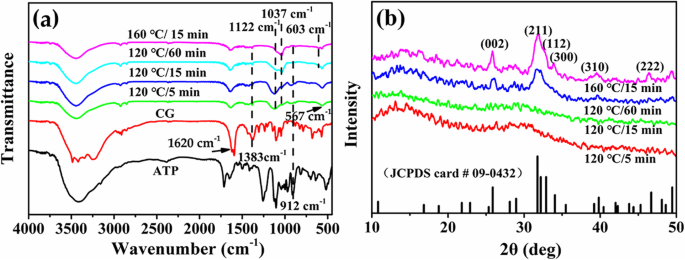
a Espectros FTIR e b Padrões de XRD de microesferas ATP-CG sintetizadas com Ca / P =3,3 sob diferentes condições experimentais
A Figura 5b mostra os padrões de XRD de diferentes amostras. Uma protuberância característica de fase amorfa em torno de 2 θ =30 ° de microesferas sintetizadas em 5 ou 15 min. No entanto, quando o tempo hidrotérmico é estendido para 60 min ou a temperatura aumentada para 160 ° C, a fase cristalina das microesferas se transforma completamente em HAp, que pode ser indexado como os dados padrão (JDCPS no. 09-0432). A melhoria na intensidade relativa dos planos de rede (211), (300) e (002) poderia explicar ainda mais o aumento na cristalinidade dos produtos. Assim, os resultados de XRD e FTIR confirmam ainda mais a transformação da fase cristalina dos produtos com o aumento da temperatura ou tempo hidrotérmico.
ATP-CL Yolk-Shell-Structured Microspheres
Para comparar o comportamento de adsorção do fármaco, as demais microesferas estruturadas em casca de gema foram preparadas usando CL como fonte de cálcio orgânico através do método hidrotérmico de microondas [24]. Em termos de morfologia, as amostras ainda consistem em microesferas estruturadas em casca de gema, o que é verificado pelas esferas quebradas (inserção na Fig. 6a) e imagens TEM (Fig. 6b, c). O resultado demonstra que a mudança na fonte de cálcio não tem efeito significativo na morfologia dos produtos. Além disso, a difração de elétrons de área selecionada (SAED) mostra os pontos SAED discretos (Fig. 6d), demonstrando que microesferas bem cristalizadas são obtidas. Além disso, o mapeamento EDS exibe a distribuição uniforme dos elementos Ca, P e O em microesferas (Fig. 6e). Os espectros de EDS correspondentes também confirmam a presença de elemnetos de Ca, P e O nas microesferas (Fig. 6f), indicando que as microesferas preparadas são fosfato de cálcio.

a SEM . b , c Imagens TEM . d S difração de elétrons de área eleita (SAED) . e EDS-mapeamento e f Espectros EDS de microesferas ATP-CL
HEL Adsorção e mecanismo de adsorção de microesferas
Conforme mostrado na Fig. 7, a capacidade de adsorção de dois tipos de microesferas aumenta com o aumento da concentração inicial de HEL. Quando a concentração inicial de HEL aumenta para 6,5 mg / mL, a capacidade de adsorção das microesferas ATP-CG atinge um platô e a capacidade máxima de adsorção das microesferas é cerca de 332 ± 36 mg / g (Fig. 7a), que é cerca de duas vezes superior ao das microesferas ATP-CL (176 ± 33 mg / g, 6 mg / mL, Fig. 7b).
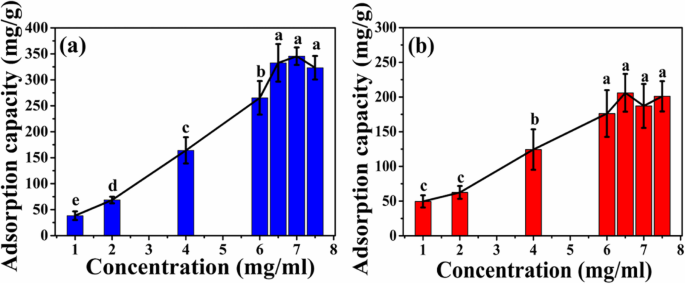
Curva de adsorção de microesferas em diferentes concentrações iniciais de HEL. a Microesferas ATP-CG. b Microesferas ATP-CL
O resultado da adsorção HEL é posteriormente suportado pelos espectros FTIR e curvas TG. Conforme mostrado na Fig. 8a, b, os picos de absorção em 1134 cm −1 (1139 cm −1 ) e 563 cm −1 (568 cm −1 ) atribuído ao pico característico PO 4 3− íons de ACP e 1039 cm −1 (1040 cm −1 ) atribuído ao pico característico do PO 4 3− íons de HAp são observados nas microesferas adsorvidas por HEL, o que indica que a introdução de HEL nas microesferas não causa nenhuma alteração significativa na estrutura das microesferas. Os picos de adsorção são de 1542 cm −1 e 1545 cm −1 atribuídas ao grupo amida de HEL são observadas em microesferas adsorvidas por HEL, confirmando que a HEL é adsorvida com sucesso nas microesferas. Enquanto isso, as bandas de adsorção em 2966, 2962, 2935 e 2927 cm −1 originado de –CH 3 e –CH 2 grupos de HEL também são detectados em microesferas adsorvidas em HEL, o que verifica ainda mais a presença de HEL nas microesferas. As curvas TGA mostram que a perda de peso das microesferas ATP-CG antes e depois da adsorção de HEL é de 11,3% e 36,7%, respectivamente (Fig. 8c). Portanto, a capacidade de adsorção de HEL das microesferas de ATP-CG é de aproximadamente 340 mg / g. No entanto, uma perda de peso de 21,1% de ATP-CL é obtida antes da adsorção de HEL e 37% aparece nas microesferas adsorvidas por HEL (Fig. 8d). Portanto, a capacidade de adsorção de HEL é de 189 mg / g para microesferas de ATP-CL. Os resultados da TGA são fechados para o resultado da Fig. 7.
Espectros FT-IR e curvas TGA de microesferas antes e depois da adsorção HEL . a Espectros FTIR e c Curvas TGA de microesferas ATP-CG, b Espectros de FTIR e d Curvas TGA de microesferas ATP-CL
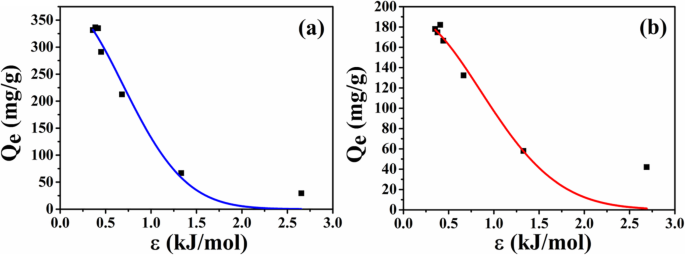
Para investigar a causa da diferença de capacidade de adsorção entre dois tipos de microesferas, os dados de adsorção de equilíbrio das microesferas são posteriormente analisados de acordo com o modelo de isoterma D-R. As curvas de ajuste são mostradas na Fig. 9 e os parâmetros de ajuste estão listados na Tabela 1, respectivamente. A partir dos resultados do ajuste, o coeficiente de correlação de ATP-CG é maior do que ATP-CL, sugerindo que o modelo D-R é adequado para descrever o comportamento de adsorção de fármaco de microesferas ATP-CG. Desde o E valor está abaixo de 8 kJ / mol, a adsorção de HEL em microesferas de ATP-CG é a sorção física. A capacidade máxima ( Q m ) de microesferas de ATP-CG para HEL pode chegar a quase 381 mg / g, o que está próximo do resultado da Fig. 7a.

a Modelo de isotermas de adsorção de HEL em microesferas ATP-CG. b Modelo de isotermas de adsorção de HEL em microesferas ATP-CL
Uma vez que a adsorção de HEL nas microesferas ATP-CG é a sorção física, o potencial de superfície das microesferas é investigado. Conforme mostrado na Fig. 10a, o valor do potencial zeta de ATP-CG, microesferas ATP-CL e HEL em água ultrapura é - 17 mV, - 22 mV e 20 mV, respectivamente. Após a adsorção de HEL, o valor do potencial zeta das microesferas ATP-CG e ATP-CL muda para 2,7 mV e 1,5 mV, respectivamente, indicando que a adsorção das moléculas HEL na superfície das microesferas através da força eletrostática atrativa. No entanto, a força eletrostática atrativa não é a principal causa da diferença de capacidade de adsorção entre dois tipos de microesferas, porque não há diferença significativa nos valores de potencial zeta (-17 mV e -22 mV) entre as microesferas.
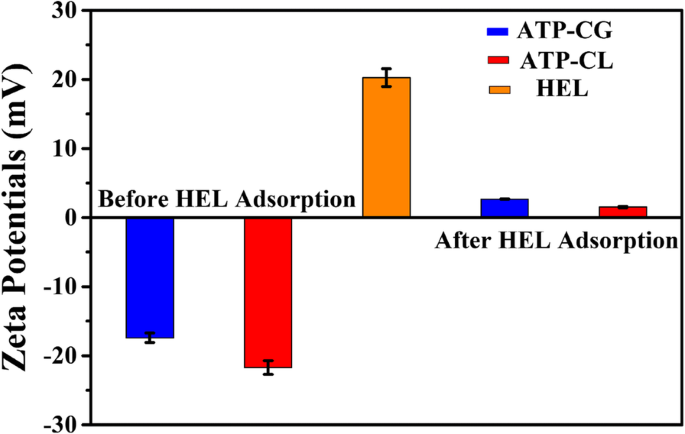
Potenciais zeta de HEL e microesferas antes e depois da adsorção de HEL
Portanto, a fim de esclarecer melhor a razão que causa a diferença na capacidade de absorção entre as microesferas, a área de superfície específica das microesferas é investigada. Como mostrado na Fig. 11a, a área de superfície específica de BET ( S APOSTA ) de microesferas ATP-CG é 143 m 2 g −1 , que é aproximadamente três vezes mais alto que as microesferas ATP-CL (55 m 2 g −1 , Mesa 2). Portanto, a área de superfície específica pode contribuir para a diferença de capacidade de absorção entre as microesferas. Essa área de superfície altamente específica das microesferas ATP-CG é atribuída principalmente à baixa cristalinidade [31]. Na Fig. 11b, as microesferas ATP-CG exibem menor cristalinidade do que as microesferas ATP-CL. Além disso, a diferença de cristalinidade entre ATP-CG e ATP-CL deve-se principalmente às diferentes condições de síntese. Geralmente, a cristalinidade do produto aumenta com a extensão da hidrólise dos reagentes sob certa pressão e temperatura. Aqui, a acidez do ácido glucônico (pKa =3,39) é maior do que o ácido l-láctico (pKa =3,86), o que causaria uma taxa de hidrólise mais lenta e, por fim, apresentaria uma cristalinidade menor. Como resultado, microesferas de ATP-CG com uma área de superfície específica superior são obtidas por alteração da fonte de cálcio.
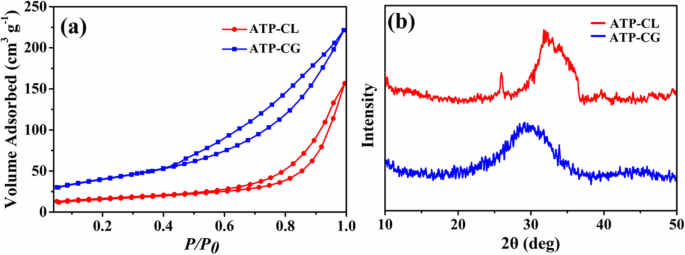
a Isotermas de adsorção-dessorção de nitrogênio. b Padrões de XRD de microesferas
Conclusões
As microesferas de casca de gema ATP-CG foram projetadas usando ATP como fonte de fósforo orgânico e CG como fonte de cálcio orgânico por meio de um método hidrotérmico assistido por micro-ondas. As microesferas exibem uma área de superfície altamente específica e alta capacidade de adsorção. As influências do Ca / P, da temperatura hidrotérmica e do tempo na morfologia e estrutura das microesferas também foram investigadas. O estudo indica que a fonte orgânica de fósforo e a fonte orgânica de cálcio têm um efeito significativo na formação de microesferas estruturadas em casca de gema. Além disso, as condições hidrotérmicas, incluindo Ca / P, hidrotérmica e temperatura, são responsáveis pela formação de microesferas de casca de gema. Além disso, descobrimos que a área de superfície específica e as propriedades químicas da superfície, como o potencial de superfície, são dois fatores-chave que afetam a capacidade de adsorção das microesferas, comparando o comportamento de adsorção de HEL de dois tipos de microesferas sintetizadas com diferentes fontes de cálcio.
Disponibilidade de dados e materiais
Todos os dados que sustentam as conclusões deste artigo estão incluídos no artigo.
Abreviações
- BET:
-
Medições Brunauer-Emmet-Teller
- FTIR:
-
Espectroscopia de infravermelho com transformada de Fourier
- TEM:
-
Microscopia eletrônica de transmissão
- XRD:
-
Difração de raios X
- TGA:
-
Análise termogravimétrica
- HRTEM:
-
TEM de alta resolução
- SAED:
-
Difração de elétrons de área selecionada
Nanomateriais
- Preparação de nanopartículas de mPEG-ICA carregadas com ICA e sua aplicação no tratamento de dano celular H9c2 induzido por LPS
- Absorvedor perfeito de banda ultra-estreita e sua aplicação como sensor plasmônico na região visível
- Síntese fácil de compósito CuSCN colorido e condutor revestido com nanopartículas de CuS
- O efeito do plasma sem equilíbrio de contato nas propriedades estruturais e magnéticas de Mn Х Fe3 - X О4 Spinels
- Efeito do tratamento de recozimento in situ na mobilidade e morfologia de transistores de efeito de campo orgânico baseados em TIPS-Pentaceno
- Ajustando as morfologias de superfície e propriedades dos filmes ZnO pelo projeto da camada interfacial
- Ajuste do desempenho tribológico de nanoplacas de fosfato de zircônio em camadas em óleo por modificações de superfície e intercamada
- Síntese de nanocristais de ZnO e aplicação em células solares de polímero invertido
- Propriedades de Lasing e Transporte de Poly [(9,9-dioctyl-2,7-divinylenefluorenylene) -alt-co- (2-methoxy- 5- (2-etilhexiloxi) -1,4-fenileno)] (POFP) para a aplicação de lasers sólidos orgânicos b…
- Os efeitos de acoplamento de polaritons de plasma de superfície e ressonâncias de dipolo magnético em metamateriais



