Toxicidade potencial para fígado, cérebro e embrião de nanopartículas de dióxido de titânio em camundongos
Resumo
Dióxido de titânio em nanoescala (nano-TiO 2 ) tem sido amplamente utilizado na indústria e na medicina. No entanto, a segurança do nano-TiO 2 a exposição permanece obscura. Neste estudo, avaliamos a toxicidade do fígado, cérebro e embrião e o mecanismo subjacente do nano-TiO 2 usando modelos de ratos. Os resultados mostraram que o titânio foi distribuído e acumulado no coração, cérebro, baço, pulmão e rim de camundongos após nano-TiO intraperitoneal (i.p.) 2 exposição, de forma dose-dependente. As relações órgão / peso corporal do coração, baço e rim aumentaram significativamente, e as do cérebro e pulmão diminuíram. Altas doses de nano-TiO 2 danificou significativamente as funções do fígado e dos rins e do metabolismo da glicose e dos lipídios, conforme demonstrado nos testes de bioquímica do sangue. Nano-TiO 2 causou danos na mitocôndria e apoptose de hepatócitos, geração de espécies reativas de oxigênio e distúrbios de expressão de genes protetores no fígado de camundongos. Encontramos células nervosas rompidas e rachadas e infiltração de células inflamatórias no cérebro. Também descobrimos que as atividades das sintases de óxido nítrico constitutivas (cNOS), NOS induzível (iNOS) e acetilcolinesterase, e os níveis de óxido nitroso e ácido glutâmico foram alterados no cérebro após nano-TiO 2 exposição. Modelos de embrião de camundongo ex vivo exibiram toxicidade genética e de desenvolvimento após altas doses de nano-TiO 2 . O tamanho do nano-TiO 2 as partículas podem afetar a toxicidade, as partículas maiores produzem maior toxicidade. Em resumo, nano-TiO 2 exibiu toxicidade em múltiplos órgãos em camundongos após exposição por via i.p. injeção e gavagem. Nosso estudo pode fornecer dados para a avaliação do risco de nano-TiO 2 exposição na saúde humana.
Histórico
Dióxido de titânio em nanoescala (nano-TiO 2 ) é amplamente utilizado na indústria alimentar. Tem sido usado para a produção de doces revestidos, frutas em conserva, gomas de mascar, bebidas carbonatadas, bebidas em pó (na forma de dosagem sem açúcar ou concentrado), leite e produtos lácteos e outras categorias de alimentos [1, 2]. A concentração de nano-TiO 2 em alimentos atinge até 0,5–9 g / kg [1, 3], e muitos produtos alimentícios que são alegados como livres de nano-TiO2 contêm nano-TiO2 [2]. Nano-TiO 2 também tem sido amplamente utilizado em biomedicina, tratamento de poluentes orgânicos, engenharia de materiais e cosméticos [4,5,6]. No entanto, a segurança do nano-TiO 2 a exposição permanece obscura.
Estudos têm mostrado que nano-TiO 2 pode se tornar enriquecido e tóxico em vários órgãos após entrar no corpo por meio de vários métodos, como administração pela cavidade abdominal ou inalação [7, 8]. Nano-TiO 2 pode ser tóxico para vários tipos de células, como células linfoblastóides humanas e células de hepatoma [9, 10]. Pode induzir uma reação de estresse agudo nas células gliais do cérebro de camundongos, levando a danos e disfunções neuronais [11]. A taxa de sobrevivência de linhas de células de neurônios expostas a nano-TiO 2 as partículas são significativamente reduzidas de uma maneira típica dependente do tempo e da dose [12].
Estudos revelaram vários mecanismos pelos quais essas nanopartículas causam toxicidade. Nano-TiO 2 partículas podem causar toxicidade genética através da mudança da estrutura do complexo molecular e da permeabilidade da membrana celular [13,14,15]. Nano-TiO 2 pode produzir estresse oxidativo. Durante o estresse oxidativo, espécies reativas de oxigênio (ROS), como os radicais hidroxila, são geradas e causam a oxidação do DNA, gerando 8-OHG, levando a erros e mutações na replicação do DNA [16, 17]. Além disso, as ROS podem induzir inflamação e interação mútua entre estresse oxidativo e inflamação, resultando em dano ao DNA e apoptose celular [18, 19]. No entanto, os dados sistemáticos abrangentes sobre a toxicidade do nano-TiO 2 permanece limitado. Nosso objetivo era revelar o efeito e o mecanismo subjacente do nano-TiO 2 exposição na saúde humana.
Neste estudo, avaliamos o efeito e o mecanismo subjacente do nano-TiO 2 exposição usando modelos de camundongos. Nossas descobertas mostraram que nano-TiO 2 pode ser enriquecido e causar toxicidade em vários órgãos, como fígado, rim, baço, coração, pulmão e cérebro, por meio da geração de um desequilíbrio de redução da oxidação e distúrbios da expressão gênica. Isso também pode causar danos ao desenvolvimento embrionário. Nosso estudo pode fornecer dados para avaliar o risco potencial para a saúde humana do nano-TiO 2 exposição.
Métodos
Produtos Químicos e Reagentes
TiO em microescala 2 (micro-TiO 2 ) e 5 nm de TiO 2 na forma de anatase foram adquiridos da Sigma-Aldrich (Shanghai, China), e 10, 60 e 90 nm de TiO 2 (anatase) foram adquiridos a Run He Ltd. (Shanghai, China). O formaldeído, ácido nítrico, peróxido de hidrogênio e heparina de sódio eram de grau reagente e foram adquiridos da Sigma-Aldrich (Shanghai, China). O tampão de fosfato (PBS), a penicilina e a estreptomicina foram adquiridos à Gibco (San Diego, EUA). Os kits de extração de RNA total foram adquiridos na Takara (Dalian, China). Os kits de ensaio de espécies reativas de oxigênio foram adquiridos de Jianchen Ltd. (Nanjing, China). Estoque TiO 2 suspensão (1%) em solução de Hank foi esterilizada a 121 ° C por 30 min. A suspensão foi sonicada e diluída até a concentração desejada imediatamente antes do uso.
Animais e modelos
Para o estudo de toxicidade hepática e cerebral, camundongos ICR (região de controle de impressão) (22 ± 3 g, metade machos e metade fêmeas) foram adquiridos do centro animal da China Medical University. Todos os procedimentos experimentais envolvendo animais foram pré-aprovados pelo Comitê de Ética Institucional da Universidade de Ciência e Tecnologia de Tianjin e foram conduzidos de acordo com as diretrizes internacionais para cuidados e uso de animais de laboratório. Para o estudo de toxicidade embrionária de camundongo, camundongos ICR (45 fêmeas, 20-35 g; 15 machos, 35-40 g) foram adquiridos de Beijing Weitong Lihua Ltd. (Pequim, China). Todos os ratos eram saudáveis e sexualmente maduros. Cinco dias antes do tratamento, os camundongos foram criados em gaiolas separadas em um galpão com boa ventilação, um ciclo claro / escuro de 12 h, 20 ± 2 ° C, 60 ± 10% de umidade relativa e acesso ad libitum a comida e água.
O regime de dosagem 1 foi projetado para um teste geral de toxicidade e toxicidade cerebral. Os camundongos foram divididos aleatoriamente em seis grupos e um grupo controle adicional, com 10 camundongos / grupo. Um TiO em nanoescala 2 (nano-TiO 2 ) a suspensão foi injetada (intraperitoneal (i.p.), 5, 10, 50, 100, 150 e 200 mg / kg) uma vez por dia durante 14 dias. Solução salina foi injetada em camundongos do grupo controle. Os ratos foram observados todos os dias e nenhum animal morreu durante o estudo. No 15º dia, amostras de sangue foram coletadas do seio orbital. Todos os ratos foram pesados individualmente, foram anestesiados com fenobarbital a 2% (60 ml / kg, i.p.) e depois foram sacrificados por deslocamento cervical. Todas as amostras de tecido foram coletadas (tecido cerebral isolado do córtex e hipocampo) e armazenadas a -80 ° C. Cada coração, fígado, baço, pulmão e rim foi cortado em duas porções. Uma porção foi embebida em solução de formalina (10%) a 4 ° C para exame anatomopatológico. A outra porção foi armazenada a −20 ° C para a determinação do teor de titânio.
O regime de dosagem 2 foi projetado para o teste de toxicidade hepática. Os camundongos foram divididos em três grupos experimentais e um grupo controle. Nano-TiO 2 (5, 10, 50 mg / kg) foi administrado uma vez por dia por gavagem durante 60 dias. Os camundongos do grupo controle receberam 0,5% de CMC (carboximetilcelulose). Os ratos foram observados todos os dias e nenhum animal morreu durante o estudo. No 60º dia, os camundongos foram anestesiados com fenobarbital 2% (60 ml / kg, ip), sendo então sacrificados por deslocamento cervical, os fígados foram imediatamente coletados e processados para exame em microscopia eletrônica, determinação de ROS e oxidação lipídica e análise da expressão gênica.
Determinação do conteúdo de titânio nos tecidos alvo
Um pedaço de amostra de tecido congelado de 0,1-0,5 g foi cortado e descongelado à temperatura ambiente e, em seguida, foi digerido em HNO 3 (0,5 mL) e H 2 O 2 (0,5 mL) a 160 ° C. Após diluição para 3 mL com ácido nítrico a 3%, a concentração de titânio na solução foi determinada por espectrometria de massa com plasma indutivamente acoplado (ICP-MS). O conteúdo de titânio nos tecidos-alvo foi então calculado.
Testes de bioquímica do sangue e cálculo da relação órgão / peso corporal
Os níveis das enzimas nas amostras de soro foram analisados por um analisador bioquímico automático (TBA-2000FR, Toshiba, Tóquio, Japão). Essas enzimas são biomarcadores relacionados à função do fígado e dos rins.
A proporção órgão / peso corporal foi calculada com base nos pesos do órgão e do corpo. Os pesos corporais foram medidos antes da anestesia e do sacrifício. Os órgãos foram pesados após o isolamento de camundongos anestesiados e sacrificados.
Exame patológico e microscopia eletrônica de transmissão
O exame patológico do fígado ou dos tecidos cerebrais embebidos em formalina foi realizado ao microscópio óptico após a coloração com hematoxilina. Para microscopia eletrônica de transmissão (TEM), os tecidos do fígado foram incluídos em resina epóxi EPON 812 e foram cortados em seções tão finas quanto <500 μM após fixação com glutaraldeído e ácido ósmico. As seções foram coradas com solução saturada de ácido acético de urânio (pH 3,5) e citrato de chumbo (pH 12) por 1–2 h. As seções coradas foram examinadas usando TEM.
Determinação dos níveis de espécies reativas de oxigênio, as atividades de suas enzimas metabólicas e os níveis de neurotransmissores
Para os tecidos do fígado, o ânion superóxido (O 2 - ) os níveis foram determinados usando XTT. A atividade da catalase (CAT) foi determinada usando valores de DO em 240 nm, seguindo procedimentos publicados [20]. Os níveis de peroxidação lipídica foram determinados pelo conteúdo de malondialdeído (MDA) seguindo procedimentos publicados [21].
Os tecidos cerebrais foram homogeneizados com solução de polivinilpolipirrolidona a 1% pré-resfriada (50 mM em pH 7,6 PBS) após o isolamento. Os sobrenadantes foram coletados após centrifugação a 15.000 rpm por 20 min (Eppendorf 5418, Hamburgo, Alemanha) e foram usados para análise subsequente das atividades da enzima superóxido (SOD), CAT, ascorbato peroxidase (APX) e glutationa peroxidase (GSHPx). A atividade da SOD foi determinada usando NBT (teste do azul de cloreto de nitro-tetrazólio). A atividade da catalase foi determinada usando um kit (kit de ensaio CAT, A007-2, Nanjing Jiancheng Bioengineering Institute, Nanjing, China). A atividade de APX foi medida usando um kit (kit de ensaio APX, A123, Nanjing Jiancheng Bioengineering Institute, Nanjing, China). A atividade GSHPx foi determinada usando um kit (kit de ensaio GSHPx, A005, Nanjing Jiancheng Bioengineering Institute, Nanjing, China). As atividades de óxido nítrico sintase constitutiva (cNOS), óxido nítrico sintase induzível (iNOS) e acetilcolinesterase (AChe) foram determinadas usando kits comerciais (kit de ensaio AChe, A024, Nanjing Jiancheng Bioengineering Institute, Nanjing, China).
Os níveis de ROS em tecidos cerebrais foram determinados pela adição de 2 ′, 7 ′ de diacetato de diclorofluorescina a uma concentração final de 10 μM em homogenato de tecido cerebral e incubando a 37 ° C por 30 min; os tecidos foram então submetidos à análise por citometria de fluxo.
Determinação dos níveis relativos de mRNA
O RNA total foi extraído de amostras de tecido hepático usando um kit comercial (TaKaRa MiniBEST Universal RNA Extraction Kit, 9767, Takara, Dalian, China). O DNA complementar foi sintetizado usando transcrição reversa com iniciador aleatório. Os níveis relativos de mRNA de SOD, CAT, GSHPx, MT, HSP70, CYPA, P53, GST e TF foram determinados usando um kit de PCR quantitativo em tempo real (qPCR) (kit One Step SYBR® PrimeScript ™ RT-PCR, PR066A, Takara, Dalian, China). Todos os primers (Tabela 1) foram sintetizados e adquiridos da Shanghai Sangon Ltd.
Teste de toxicidade embrionária ex vivo
Embriões de 8,5 dias embrionários foram isolados de camundongos fêmeas após deslocamento cervical e, em seguida, foram cultivados em solução de Hank de 50,0 mL contendo 3 mL de soro imediatamente centrifugado (ICS) de ratos, micro-TiO 2 ou nano-TiO 2 (0,0, 50,0, 100,0 e 200,0 μg / mL) com 3 embriões em cada garrafa por 48 h.
Para determinar o efeito do micro-TiO 2 ou nano-TiO 2 tempo de exposição em embriões, os embriões foram cultivados em solução de Hank de 50,0 mL contendo 3 mL de ICS de ratos, micro-TiO 2 ou nano-TiO 2 (200,0 μg / mL) com 3 embriões em cada frasco por 16, 26 e 48 h, e então foram lavados por 48 h com solução de Hank pré-aquecida a 37 ° C e cultivados em solução de Hank de 50,0 mL contendo 3 mL de ICS de ratos.
O desenvolvimento embrionário foi avaliado usando o escore Maele-Fabry Van [22]. O diâmetro do saco vitelino, comprimento embrionário coroa-nádega, comprimento da cabeça e número de seções do corpo foram examinados em um microscópio de dissecação. A taxa de malformação de embriões em desenvolvimento foi avaliada com base nas pontuações de alterações morfológicas do prosencéfalo, mesencéfalo, rombencéfalo, o botão do membro anterior, o botão do membro posterior, os sistemas auditivo e visual e o coração. Mais de 10 embriões de 2 camundongos ICR no dia embrionário 10.5 foram isolados para controle.
Análise estatística
Os dados foram analisados no SPSS 13 (IBM, Illinois, EUA). A diferença entre o grupo de tratamento e o grupo de controle foi analisada usando um t de Dunnett teste. A diferença entre os grupos foi analisada por ANOVA. A comparação entre duas de várias amostras foi analisada usando os testes LSD e SNK. Os dados categóricos foram analisados com o teste do qui-quadrado e o teste da soma de postos. Se P <0,05, a diferença foi considerada significativa.
Resultados
Distribuição de titânio nos tecidos de camundongos após exposição ao dióxido de titânio em nanoescala
Tratamos camundongos com nano-TiO 2 (i.p., 5, 10, 50, 100, 150 e 200 mg / kg) durante 14 dias e determinou o teor de titânio nos órgãos de ratinhos. Os resultados revelaram que o titânio foi acumulado nos órgãos de camundongos tratados com diferentes doses de nano-TiO 2 (Figura 1). A magnitude da acumulação foi dependente da dose (Fig. 1). O fígado foi o órgão onde o titânio foi mais enriquecido, seguido pelo rim. A magnitude do acúmulo de titânio foi aproximadamente a mesma no baço, pulmão, cérebro e coração (fig. 1). Os resultados sugerem que nano-TiO 2 pode ser absorvido através do trato gastrointestinal e distribuído aos tecidos através do sistema circulatório e depositado nos órgãos fígado, rim, baço, pulmão, cérebro e coração.
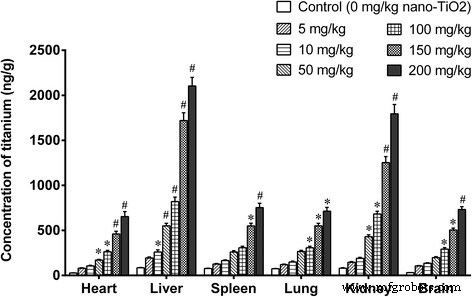
O titânio foi acumulado em órgãos de camundongos expostos ao nano-TiO 2 . Os camundongos foram tratados com nano-TiO 2 suspensão ou solução salina conforme indicado por injeção intraperitoneal uma vez ao dia durante 14 dias. * comparado ao controle, P <0,05, # comparado ao controle, P <0,01
Toxicidade geral do dióxido de titânio em nanoescala em camundongos
Tratamos camundongos com diferentes doses de nano-TiO 2 por 14 dias e descobriu que não havia diferença nos ganhos de peso corporal entre os grupos de camundongos tratados com diferentes doses (dados não mostrados). Doses baixas de nano-TiO 2 (5 e 10 mg / kg) não alterou a razão órgão / peso corporal do fígado, rim, baço, pulmão, coração e cérebro em camundongos após administração i.p. exposição por 14 dias (Fig. 2). No entanto, as altas doses de nano-TiO 2 (50, 100, 150 e 200 mg / kg) aumentou significativamente a razão órgão / peso corporal do fígado, rim, baço e coração e diminuiu os do pulmão e cérebro em camundongos de uma maneira dependente da dose (Fig. 2 )
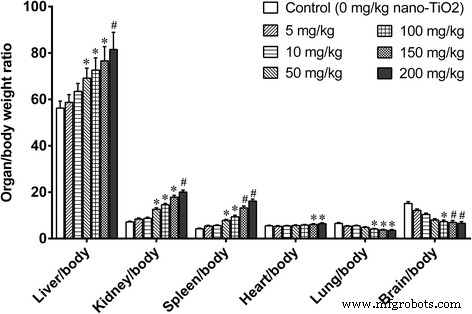
Razão de peso de órgão / corpo em camundongos expostos a nano-TiO 2 . Os camundongos foram tratados com nano-TiO 2 suspensão ou solução salina conforme indicado por injeção intraperitoneal uma vez ao dia durante 14 dias. * comparado ao controle, P <0,05; # comparado ao controle, P <0,01
Doses mais baixas (5, 10, 50 e 100 mg / kg) de nano-TiO 2 não alterou nenhum índice bioquímico do sangue (fig. 3). Altas doses de nano-TiO 2 (150 a 200 mg / kg) biomarcadores de função hepática elevados fosfatase alcalina (ALP) e alanina aminotransferase (ALT), albumina (ALB), leucina aminopeptidase (LAP), butirilcolinesterase (PChe), bilirrubina total (TBIL) e proteína total ( Níveis de TP) (Fig. 3). Doses altas diminuíram os níveis de ácido úrico sérico (UA) e nitrogênio ureico no sangue (BUN), que são biomarcadores da função renal. Eles aumentaram os níveis séricos de aspartato aminotransferase (AST), creatina quinase (CK), lactato desidrogenase (LDH) e alfa hidroxibutirato desidrogenase (HBDH), que são índices de dano miocárdico (Fig. 3).
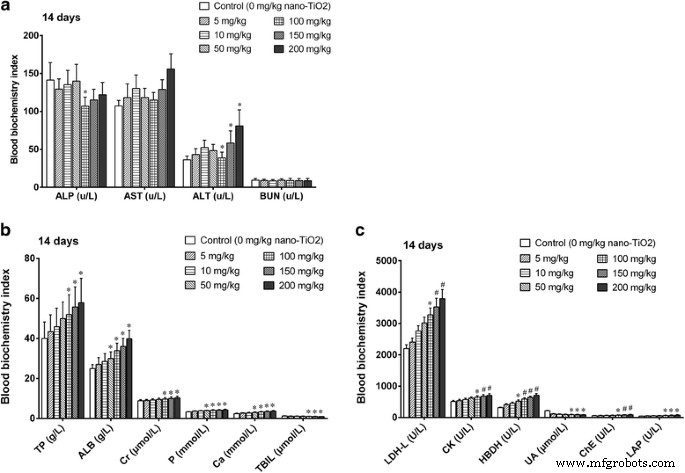
Índice de bioquímica do sangue em camundongos expostos a nano-TiO 2 . Os camundongos foram tratados com nano-TiO 2 suspensão ou solução salina conforme indicado por injeção intraperitoneal uma vez ao dia durante 14 dias. * comparado ao controle, P <0,05; # comparado ao controle, P <0,01. a Índice de bioquímica para biomarcadores de função hepática. b Índice de bioquímica para biomarcadores de função renal. c Índice bioquímico para biomarcador de dano miocárdico
Esses resultados sugerem que altas doses de TiO 2 pode causar danos graves ao fígado, rins, coração e outros órgãos de maneira dependente da dose.
Toxicidade hepática de Nano-TiO 2 em ratos
Avaliamos ainda a toxicidade hepática do nano-TiO 2 . Usando microscopia de luz, descobrimos que não houve mudança significativa nos fígados de camundongos expostos a dose baixa (i.p. por 14 dias, 5 mg / kg) nano-TiO 2 (Fig. 4a, b). Observamos obstrução e dilatação vascular acentuada (Fig. 4c, 50 mg / kg), aumento dos basófilos (Fig. 4d, 100 mg / kg), isquemia parcial no fígado (Fig. 4e, 150 mg / kg) e obstrução das veias centrais (Fig. 4f, 200 mg / kg) em camundongos expostos a nano-TiO 2 (i.p.).
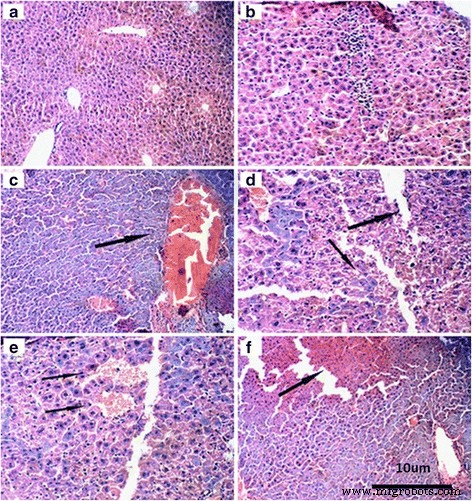
Histologia de fígados em camundongos tratados com nano-TiO 2 exposto a nano-TiO 2 . Os camundongos foram tratados com nano-TiO 2 suspensão ou solução salina conforme indicado por injeção intraperitoneal uma vez ao dia durante 14 dias. a Ao controle. b TiO 2 , 5 mg / kg. c TiO 2 , 50 mg / kg. d TiO 2 , 100 mg / kg. e TiO 2 , 150 mg / kg. f TiO 2 , 200 mg / kg
No entanto, usando TEM, encontramos um leve inchaço das mitocôndrias em hepatócitos e presença de cromatina condensada e células apoptóticas nos tecidos do fígado em camundongos expostos a baixas doses de nano-TiO 2 (gavagem por 60 dias, 5 mg / kg) (Fig. 5a, b). Observamos nano-TiO 2 nas mitocôndrias dos hepatócitos, inchaço das mitocôndrias e vacúolos nas mitocôndrias das células do fígado de camundongos tratados com 10 mg / kg de nano-TiO 2 (gavagem por 60 dias, Fig. 5c). Observamos ainda colapso do nucléolo, cromatina espalhada, apoptose óbvia e / ou corpos apoptóticos nas células do fígado de camundongos tratados com 50 mg / kg de nano-TiO 2 (gavagem por 60 dias, Fig. 5d). Os resultados indicaram que nano-TiO 2 pode levar a danos patológicos nas células do fígado nos níveis subcelular e celular.
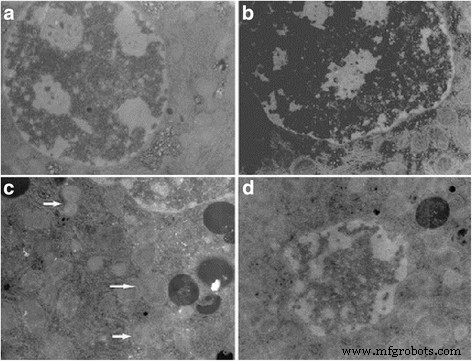
Estrutura ultramicroscópica de hepatócitos em camundongos expostos a nano-TiO 2 . Os camundongos foram tratados com nano-TiO 2 conforme indicado por gavagem uma vez por dia durante 60 dias. Os camundongos do grupo controle receberam 0,5% de CMC (carboximetilcelulose). a Controle (× 8000). b TiO 2 (5 mg / kg) (× 8000). c TiO 2 (10 mg / kg) (× 10.000). As setas indicam mitocôndrias e vacúolos nas mitocôndrias. d TiO 2 (50 mg / kg) (× 10.000)
O tratamento de camundongos com 5 mg / kg de nano-TiO 2 por 60 dias não mudou os níveis de ROS como O 2− , H 2 O 2 , óxido nítrico (NO) e MDA (Fig. 6), ou os níveis de mRNA dos genes SOD, CAT, GSHPx, MT, GST, HSP70, P53 e TF em tecidos do fígado (Fig. 7). Tratamento de camundongos com 10 ou 50 mg / kg de nano-TiO 2 por 60 dias resultou em aumentos significativos nos níveis de O 2− , H 2 O 2 , NO e MDA (Fig. 6), diminui nos níveis de mRNA dos genes SOD, CAT, MT, GST, HSP70, P53, TF e GSHPx, e aumenta nos níveis de mRNA dos genes CYP1A no fígado de camundongos ( Fig. 7). Os resultados mostraram que altas doses de nano-TiO 2 - estresse oxidativo induzido e alterações na expressão de genes protetores no fígado de camundongos expostos.
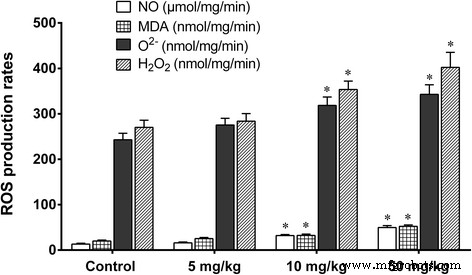
Taxas de produção de ROS e níveis de peroxidação lipídica em fígados de camundongos expostos a nano-TiO 2 . Os camundongos foram tratados com nano-TiO 2 conforme indicado por gavagem uma vez por dia durante 60 dias. Os camundongos do grupo controle receberam 0,5% de CMC (carboximetilcelulose). * comparado ao controle, P <0,05, normalizado para proteína total
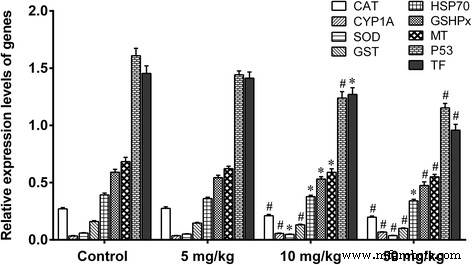
Níveis de expressão relativa de genes em fígados de camundongos expostos a nano-TiO 2 . Os camundongos foram tratados com nano-TiO 2 conforme indicado por gavagem uma vez por dia durante 60 dias. Os camundongos do grupo controle receberam 0,5% de CMC (carboximetilcelulose). * comparado ao controle, P <0,05; # comparado ao controle, P <0,01, normalizado para β-actina
Toxicidade cerebral do dióxido de titânio em nanoescala em camundongos
Avaliamos ainda a toxicidade cerebral do nano-TiO 2 . Examinamos primeiro as razões de peso do cérebro / corpo em camundongos expostos ao nano-TiO 2 (i.p. durante 14 dias). Doses baixas (5, 10, 50 mg / kg) não alteraram as razões de peso do cérebro / corpo, e doses mais altas (100, 150, 200 mg / kg) diminuíram significativamente as razões de peso do cérebro / corpo em um dependente da dose maneira (Fig. 2). A concentração de Ti nos tecidos cerebrais aumentou significativamente de maneira dependente da dose (Fig. 1).
Também examinamos as alterações histológicas no cérebro de camundongos expostos ao nano-TiO 2 (i.p. durante 14 dias) usando coloração com hematoxilina. Observamos que baixas doses de nano-TiO 2 (50 mg / kg) não alterou a histologia do tecido cerebral em ratos após i.p. exposição por 14 dias (Fig. 8a, b). Tratamento de camundongos com 100 mg / kg de nano-TiO 2 resultou em células nervosas rompidas e rachadas no tecido cerebral (Fig. 8c). Tratamento de camundongos com 150 mg / kg de nano-TiO 2 resultou na invasão de células inflamatórias no tecido cerebral (Fig. 8d). Os resultados mostraram que altas doses de nano-TiO 2 pode causar danos morfológicos ao tecido cerebral, resultando em uma reação inflamatória.
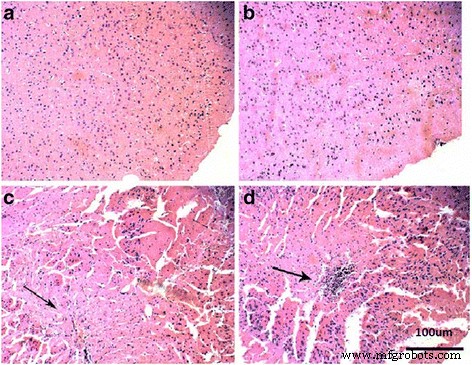
Alterações patológicas no tecido cerebral de camundongos expostos ao nano-TiO 2 . Os camundongos foram tratados com nano-TiO 2 suspensão ou solução salina conforme indicado por injeção intraperitoneal uma vez ao dia durante 14 dias. a Ao controle. b 50 mg / kg. c 150 mg / kg. d 200 mg / kg
Determinamos os efeitos do nano-TiO 2 sobre o estado redox e moléculas de sinal no tecido cerebral de camundongos expostos ao nano-TiO 2 (i.p. durante 14 dias). Observamos que uma dose baixa (5 mg / kg) de nano-TiO 2 não mudou O 2− , H 2 O 2 e os níveis de MDA, não alteraram as atividades das enzimas antioxidantes APX, CAT, GSHPx e SOD, ou os níveis dos antioxidantes não enzimáticos ASA / DASA e GSH / GSSG. Nem alterou a atividade da óxido nítrico sintase (NOS) e os níveis de NO nos tecidos cerebrais (Figs. 9 e 10). Doses mais altas de nano-TiO 2 aumentou O 2− , H 2 O 2 , e os níveis de MDA diminuíram as atividades das enzimas antioxidantes APX, CAT, GSHPx e SOD, diminuíram os níveis dos antioxidantes não enzimáticos ASA / DASA e GSH / GSSG, aumentaram os níveis de NO e atividades de NOS e diminuíram os níveis de AchE e glicose no sangue (GLU) nos tecidos cerebrais (Figs. 9 e 10). Esses resultados sugerem que nano-TiO 2 pode causar danos no cérebro de camundongos após a injeção i.p. exposição.
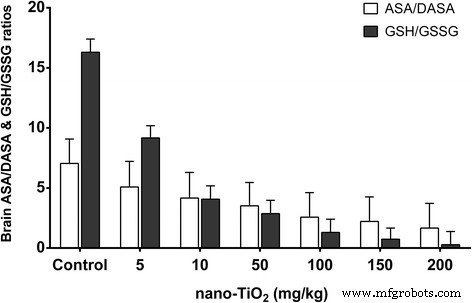
Razões ASA / DASA e GSH / GSSG do cérebro nos camundongos expostos a nano-TiO 2 . Os camundongos foram tratados com nano-TiO 2 suspensão ou solução salina conforme indicado através de injeção intraperitoneal uma vez por dia durante 14 dias
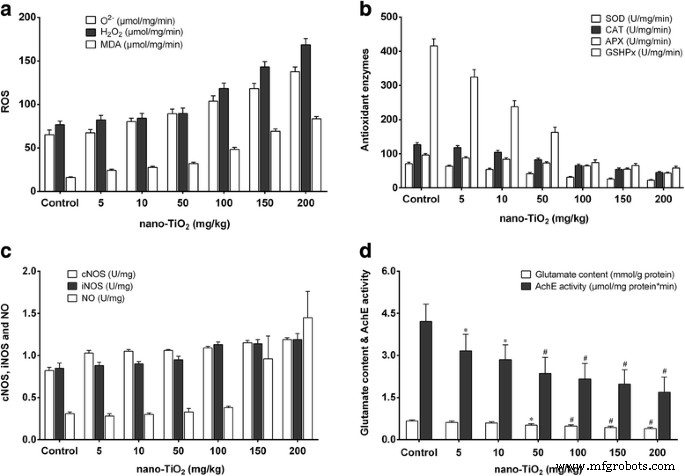
Alterações nas ROS, enzimas antioxidantes, sinalização de NO, glutamato e atividades AchE em cérebros de camundongos expostos ao nano-TiO 2 . Os camundongos foram tratados com nano-TiO 2 suspensão ou solução salina conforme indicado por injeção intraperitoneal uma vez ao dia durante 14 dias. N =10, * comparado ao controle, P <0,05; # comparado ao controle, P <0,01. a Alteração de ROS (O2-, H2O2 e MDA) em cérebros de camundongos expostos ao nano-TiO2. b Alteração das enzimas antioxidantes (SOD, CAT, APX e GSHPx) em cérebros de camundongos expostos ao nano-TiO2. c Alteração dos componentes de sinalização de NO (cNOS, iNOS e NO) em cérebros de camundongos expostos ao nano-TiO2. d Alteração do conteúdo de glutamato e atividade AchE em cérebros de camundongos expostos a nano-TiO2
Efeito tóxico do Nano-TiO 2 em embriões de mouse Ex Vivo
Para avaliar a toxicidade do desenvolvimento do nano-TiO 2 , primeiro comparamos o crescimento e o desenvolvimento de embriões in vivo e embriões ex vivo. Os resultados mostraram que o crescimento e desenvolvimento de embriões ex vivo foi semelhante ao de embriões in vivo (dados não mostrados). Portanto, usamos embriões ex vivo para estudar os efeitos tóxicos do nano-TiO 2 em embriões.
Nós investigamos os efeitos de diferentes doses (concentrações finais 0,0, 50,0, 100,0 e 200,0 μg / mL) e diferentes tempos de exposição de micro-TiO 2 / nano-TiO 2 no crescimento e desenvolvimento embrionário, bem como na morfologia dos tecidos e órgãos através do exame do diâmetro VXY embrionário, comprimento coroa-nádega, comprimento da cabeça e o número de seções do corpo. Os resultados mostraram que o micro-TiO 2 não alterou esses indicadores em nenhuma dose (Tabela 2).
Para diferentes tamanhos de nano-TiO 2 , tratamento de embriões de 5–10 nm, 60 nm, 90 nm com 50,0 μg / mL TiO 2 não teve efeito no diâmetro VXY do embrião, comprimento coroa-nádega, comprimento da cabeça e número de seções do corpo (Tabela 2). Doses mais altas (100,0 e 200,0 μg / mL) diminuíram o diâmetro VXY, o comprimento coroa-nádega, o comprimento da cabeça e o número de cortes corporais, e aumentou a taxa de malformação (Tabela 2). Para a mesma dose, não houve diferença óbvia entre os grupos tratados com tamanhos diferentes de nano-TiO 2 , 50,0 ou 100 μg / mL. Tratamento de embriões com 200 μg / mL de nano-TiO 2 diminuiu significativamente o diâmetro VXY, comprimento coroa-nádega, comprimento da cabeça e o número de seções do corpo de embriões de camundongo com o aumento do tamanho do nano-TiO 2 partículas (Tabela 2).
Tratamento de embriões de camundongos com micro-TiO 2 (200,0 μg / mL) por 16, 24 e 48 h não alterou o diâmetro VXY, comprimento coroa-nádega, comprimento da cabeça e o número de seções do corpo (Tabela 3). Tratamento de embriões de camundongos com nano-TiO 2 (5–10 nm e 60 nm, 90 nm, 200,0 μg / mL) por 16 h também não alterou o diâmetro VXY, comprimento coroa-nádega, comprimento da cabeça e o número de seções do corpo (Tabela 3). No entanto, o tratamento de embriões de camundongos com nano-TiO 2 (5–10 nm e 60 nm, 90 nm, 200,0 μg / mL) por 24 e 48 h diminuiu o diâmetro VXY, comprimento coroa-nádega, comprimento da cabeça, o número de seções do corpo e aumentou a taxa de malformação (Tabela 3). Para o mesmo tempo de exposição, não houve diferença no diâmetro VXY, comprimento coroa-nádega, comprimento da cabeça, o número de seções do corpo ou taxa de malformação entre grupos de diferentes tamanhos de nano-TiO 2 partículas (Tabela 3).
Em resumo, esses resultados indicam que nano-TiO 2 teve efeitos tóxicos no crescimento e desenvolvimento de embriões de camundongos de maneiras dependentes da dose e do tempo. The sizes of the nano-TiO2 particles may affect toxicity with a trend of increasing toxicity associated with larger nano-TiO2 particles.
Discussion
Nano-TiO2 has been widely used in industry and medicine. However, the safety of nano-TiO2 exposure remains unclear. In the present study, we investigated the potential toxicity of nano-TiO2 , using mice models. We find that nano-TiO2 accumulates in the heart, liver, kidney, spleen, lung, and brain of mice after exposure (i.p. injection) in a dose-dependent manner. High doses of nano-TiO2 significantly increase the organ/body weight ratios of the liver, kidney, spleen, and heart, and decrease those of the lung and brain in a dose-dependent manner. Moreover, high doses of nano-TiO2 significantly increase the levels of ALT, ALP, LAP, PChE, TP, ALB, and TBIL, which are indices for liver function. They decrease the levels of UA and BUN, which are renal function indicators. Further, high doses significantly increase the activities of CK, LDH, AST, and HBDH, and significantly increase the levels of GLU, trigylceride, total cholesterol, and high-density lipoprotein. Low doses of nano-TiO2 do not change these biochemical parameters. Our data support that nano-TiO2 may be toxic and may affect the liver, kidney, heart, GLU, and lipid metabolism at high doses in a dose-dependent manner.
In the present study, we investigated the mechanism of liver toxicity of nano-TiO2 . We find that high doses of nano-TiO2 may cause swelling of hepatocytes with obvious vacuoles in cells, and nuclear condensation in hepatocytes, and apoptosis and necrosis of hepatocytes in liver tissues. This is consistent with previous studies [7, 23, 24]. After the treatment of mice with high doses of nano-TiO2 , we find that the levels of CAT, GSHPx, and SOD are significantly decreased, and there is nano-TiO2 in the mitochondria of hepatocytes, revealed by TEM. This is consistent with previous studies [7, 25,26,27,28] suggesting that nano-TiO2 generates excess ROS and reduces the antioxidant capacity of the cells through damaging the mitochondria. This is further supported by observation that nano-TiO2 can significantly decrease the mRNA levels of SOD, CAT, GSHPx, MT and HSP70, CYP1A1, p53, GST, and TF genes in the mouse liver. SOD, CAT, GSH PX, and MT are involved in liver cell detoxification, CYP1A1 is involved in toxic-substance metabolism and defense against invasion from harmful substances, and HSP70 and p53 are involved in repairing liver cell DNA damage [10, 29,30,31,32,33,34,35,36,37,38,39]. These findings support that the mechanisms for nano-TiO2 liver toxicity are damaging mitochondria, generating ROS, and causing expression disorders of protective genes.
In the present study, we investigated the mechanism of brain neurotoxicity of nano-TiO2 . We find that high doses of nano-TiO2 can produce lipid peroxidation and decrease antioxidant capacity, including SOD, CAT, APX, and GSHPx activities, resulting in oxidative stress, which may damage unsaturated fatty acids and brain tissue [24, 26, 37, 40]. We observed rupture and cracking in nerve cells and the infiltration of inflammatory cells in the brain. We further found that the activities of cNOS and iNOS are increased, and NO is excessively released. Glutamic acid levels and AChe activity are decreased in the brain. This is consistent with the effect of Fe2 O 3 nanoparticles on olfactory bulb cells [40] and the effect of nano-TiO2 on mouse hippocampal neurons [31, 41]. Glutamate is the most abundant amino acid in excitatory neurotransmitters of the nervous system. It is critical for the brain’s development and function [42]. Acetylcholinesterase is a key enzyme for levels of acetylcholine, which is critical for the function of the peripheral and central nervous systems. Nitric oxide regulates many central nervous functions, such as synaptic plasticity, the sleep–wake cycle, and hormone secretion [43]. Therefore, nano-TiO2 may cause oxidative stress and may disrupt orders of neurochemical metabolism in brain tissue and therefore have neurotoxicity in the central nervous system.
We find that the micro-TiO2 and low doses of nano-TiO2 (5–10 nm and 60 nm and 90 nm) do not exhibit toxicity on ex vivo mouse embryos, while high doses of nano-TiO2 (100–200.0 μg/ml) exhibit toxicity on ex vivo mouse embryos, as revealed by evaluation of morphology of exposed embryos. Whole embryo culture is a useful tool to assess the developmental toxicity of chemicals [44, 45]. Previous studies show that exposure of 14-day pregnant mice to a single dose of nano-TiO2 in the nasal cavity increase the sensitivity of inflammatory response in F1 generation [46, 47]. Nano-TiO2 does not affect white pregnant Kunming mice but inhibits growth, increases the rate of stillbirth, and exhibits developmental toxicity [48]. These studies indicate the presence of the developmental and genetic toxicity of nano-TiO2 . This is further supported by studies that show cleavage and oxidative damage of DNA by nano-TiO2 , for example, in Zebra fish [16, 49, 50]. Additionally, another shows an increase in the sister chromatid exchange rates in Chinese hamster ovary cells [51]. Nano-TiO2 may also prevent chromosome formation during metaphase in the ovary when TiO2 concentration is high [51]. These studies consistently show that exposure to high doses of nano-TiO2 is linked with developmental and genetic toxicity. Furthermore, our data indicated that the size of nano-TiO2 particles may affect its toxicity, with the trend of increasing toxicity being associated with larger nano-TiO2 particles (Table 2).
In the current study, we found that titanium accumulates in a dose-dependent manner in the heart, liver, kidney, spleen, lung, and brain of mice after i.p. injection of nano-TiO2 . This is consistent with published reports that absorption and distribution of nano-TiO2 is dependent on blood circulation. Nanoparticles can be absorbed in mesenchymal cells through being ingested by airway epithelial cells; they can then penetrate into the blood or lymph, thus gradually being distributed to the whole body [52, 53]. It is worth noting that nano-TiO2 in the abdomen cavity can be absorbed and transported to the brain by the circulatory system, and nano-TiO2 can enter directly into the central nervous system without crossing the blood–brain barrier. This is consistent with previous studies [41, 54]. Nanoparticles can also be absorbed by the terminal nerve cell in the respiratory tract and then be transferred to the ganglion through the axon, eventually entering central nervous cells [8, 55]. Nano-TiO2 can be absorbed in the nasal cavity through the olfactory epithelium, and then be transported to other parts of the brain, such as the hippocampus, through the olfactory nerve [41, 54]. Therefore, the brain may be directly exposed to nano-TiO2 . Damage in the brain may be caused directly or indirectly by nano-TiO2 .
Conclusions
Ingested nano-TiO2 can be distributed to and accumulated in the heart, brain, spleen, lung, and kidney. It exhibits toxicity and causes disorders of the GLU and lipid metabolism. Nano-TiO2 causes liver and brain toxicity mainly through increasing oxidative stress, decreasing antioxidant levels, and changing the expression of the protective genes in the liver. In addition, nano-TiO2 has adverse effects on the growth and development of mouse embryos and the morphology of the tissues and organs. The size of nano-TiO2 particles may affect their toxicity, with a trend of increasing toxicity being associated with larger nano-TiO2 particles. These toxic effects are dose-dependent. Our study may provide data for the assessment of the risk of nano-TiO2 exposure on human health.
Abreviações
- ALB:
-
Albumin
- ALP:
-
Alkaline phosphatase
- ALT:
-
Alanine aminotransferase
- AST:
-
Aspartate aminotransferase
- BUN:
-
Blood urea nitrogen
- CK:
-
Creatine kinase
- cNOS:
-
Constitutive nitric oxide synthases
- HBDH:
-
Hydroxybutyrate dehydrogenase
- ICR:
-
Imprinting control region
- iNOS:
-
Inducible NOS
- LAP:
-
Qleucine aminopeptidase
- LDH:
-
Lactate dehydrogenase
- Nano-TiO2 :
-
Nanoscale titanium dioxide
- PChe:
-
Butyrylcholinesterase
- ROS:
-
Espécies que reagem ao oxigênio
- TBIL:
-
Total bilirubin
- TP:
-
Total protein
- UA:
-
Ácido úrico
Nanomateriais
- DIÓXIDO DE TITÂNIO - TiO2 - Preço, mercado e análise
- Preparação de nanopartículas de mPEG-ICA carregadas com ICA e sua aplicação no tratamento de dano celular H9c2 induzido por LPS
- Síntese biogênica, caracterização e avaliação do potencial antibacteriano de nanopartículas de óxido de cobre contra Escherichia coli
- Propriedades de formação e luminescência de Al2O3:Nanocompósitos de SiOC na base de nanopartículas de alumina modificados por feniltrimetoxisilano
- A preparação da nanoestrutura de casca de gema de Au @ TiO2 e suas aplicações para degradação e detecção de azul de metileno
- Adepto verde na síntese e estabilização de nanopartículas de cobre:atividades catalíticas, antibacterianas, citotoxicidade e antioxidantes
- Platycodon saponins from Platycodi Radix (Platycodon grandiflorum) para a síntese verde de nanopartículas de ouro e prata
- Síntese Verde de Nanopartículas de Metal e Óxido de Metal e Seu Efeito na Alga Unicelular Chlamydomonas reinhardtii
- Efeitos de tamanho e agregação / aglomeração de nanopartículas nas propriedades interfaciais / interfase e resistência à tração de nanocompósitos de polímero
- Blockchain e cadeias de suprimentos:Liberando o potencial



