Nanopartículas de laminarina carregadas com protoporfirina IX para tratamento anticâncer, seu comportamento celular, detecção de ROS e estudos em animais
Resumo
Partículas nanométricas à base de conjugado de laminarina foram propostas neste estudo como um sistema de entrega para protoporfirina IX (Pp IX) em terapia fotodinâmica (PDT) de células de câncer de mama humano (MCF-7). Hematin-Laminarin-Dithiodipropionic Acid-MGK, denominado HLDM, era um material carreador anfifílico com dupla sensibilidade a pH / redox que poderia ser usado para carregar fármaco hidrofóbico para melhorar sua solubilidade e aumentar a biocompatibilidade. Portanto, combinamos o fotossensibilizador (Pp IX) com HLDM para fabricar uma nova nano-micelas, aqui chamadas de micelas de HLDM carregadas com Pp IX. As micelas de HLDM carregadas com Pp IX tinham tamanho de 149,3 ± 35 nm em água neutra. Fototoxicidade, efeito PDT in vitro e sensibilidade dupla ao microambiente de pH e redox de micelas de HLDM carregadas com Pp IX foram examinadas em diferentes concentrações usando células de câncer de mama humano MCF-7. Os experimentos sobre fototoxicidade e produção de espécies reativas de oxigênio (ROS) provaram que as micelas poderiam produzir PDT para matar as células cancerosas com um determinado comprimento de onda de luz. O experimento de apoptose indicou que as micelas poderiam causar danos nucleares. O efeito de PDT in vivo das micelas foi estudado através da construção do modelo de camundongo nu com tumor de células MCF-7. Estudos in vivo mostraram que as micelas de HLDM carregadas com Pp IX podem induzir um efeito antitumoral notável. Uma plataforma de nanomedicina baseada em laminarina promissora atua como um novo sistema de entrega de drogas para aumentar a captação, o acúmulo e a eficácia da PDT de Pp IX in vitro e in vivo.
Introdução
A terapia fotodinâmica (TFD) [1,2,3] é um tipo estabelecido de terapia afetada por fonte de luz, fotossensibilizador e oxigênio molecular [4], que pode produzir espécies reativas de oxigênio (ROS) mediadas [5, 6] letais diretas efeitos em células cancerosas dentro da área iluminada sob a condição de natureza minimamente invasiva [6] e baixa toxicidade. Pode causar danos ao DNA [7], ativar vias de sinalização para facilitar a reação vasculotóxica que interdita o suprimento de sangue para a área tumoral [8] e provocar o reconhecimento e destruição das células tumorais pelo sistema imunológico [9]. O efeito final é superar a resistência aos medicamentos [10, 11] e provocar um efeito antitumoral seletivo, resultando na morte das células cancerosas.
Atualmente, os tratamentos tradicionais para tumor [12], como radioterapia, quimioterapia e cirurgia, são amplamente utilizados na clínica, mas esses métodos apresentam grandes efeitos tóxicos e colaterais, grande trauma, grande risco, certas limitações e fácil recorrência. A PDT é usada no tratamento de câncer extenso, incluindo câncer de mama [13,14,15], hepatócito [14], pulmão [16], melanoma [17] e câncer de pele [18], tornando-se o foco de pesquisadores nacionais e estrangeiros . A experiência provou que a PDT é a melhor escolha para alternar métodos convencionais como quimioterapia [19] e cirurgia na terapia de várias doenças e tumores [20], pois tem vantagens como inibir a metástase do câncer [21] e ser seletiva e adaptável. No entanto, as aplicações da maioria dos fotossensibilizadores têm sido limitadas na terapia do câncer devido ao seu acúmulo limitado no local do tumor [22].
A protoporfirina IX (Pp IX) é um fotossensibilizador hidrofóbico [23, 24] que tem grande potencial para uso em diagnóstico e PDT. Pp IX é um derivado da hematoporfirina que também pode provocar apoptose sem estímulo externo (como luz laser [25]), manifestando que é provável que tenha função de novidade para remediar o câncer [26].
O acúmulo tópico de Pp IX em lesões pré-malignas e malignas é, portanto, uma estratégia interessante a ser fornecida [27], pois sua fluorescência fornece um método conveniente para orientação do tumor [28].
Porém, o Pp IX apresenta algumas desvantagens que precisam ser resolvidas [29], como por exemplo, ter baixa solubilidade e ser fácil de agregar em solução aquosa, resultando em uma eficácia reduzida. Portanto, a laminarina [30] é um biomaterial carreador de nanomedicina marinha que é utilizado como carreador de grupo hidrofílico para melhorar as características desfavoráveis dos fotossensibilizadores. Foi comprovado que a laminarina possui atividades biológicas eficazes, incluindo antitumoral, antiviral e assim por diante. O acúmulo de evidências sugere [31] que ele tem boa eficiência terapêutica em diferentes tipos de células cancerosas in vitro e in vivo (como células de câncer de mama e cólon [32]).
Nanopartículas de polímero responsivas à estimulação, como lipossomas e micelas, podem garantir ainda mais a administração do medicamento e reduzir os efeitos colaterais. Os lipossomas [33] podem ser usados como ferramentas diagnósticas e terapêuticas, e a anfotericina B pode ser incorporada aos lipossomas para tratar as infecções fúngicas [34]. Nanopartículas micelares poliméricas [35] são uma distribuição inteligente de drogas [36]. As micelas de Hematina-Laminarina-Ácido Ditiodipropiônico-MGK (HLDM) carregadas com Pp IX com dupla sensibilidade a pH / redox e fotorresposta contêm um núcleo hidrofóbico para carregar Pp IX, bem como uma camada hidrofílica de laminarina. Eles têm sido uma das mais importantes administrações de medicamentos nanoscópicos para melhorar as características desfavoráveis dos fotossensibilizadores [37], como a biodistribuição do medicamento, efeitos adversos e liberação carregada de medicamento [38, 39].
Em relação a isso, projetamos uma nanoplataforma de entrega de medicamento multifuncional [40] com base na laminarina em resposta ao pH [41] e propriedades redox [42], que poderia manter a solubilidade em água e extinguir o Pp IX na circulação sanguínea de um corpo humano enquanto dequenching o Pp IX em sites-alvo [43]. O tipo de entrega de drogas responsivo a estímulos internos e externos tem recebido grande atenção, como temperatura [44], ultrassom [45], pH e redox. Um sistema termorresponsivo foi estudado para controlar a entrega de drogas, mostrando potencial para uma melhor entrega de drogas [46]. O sistema de entrega de drogas responsivo a estímulos tem promovido a liberação contínua de drogas sob demanda [47] de forma irreversível e distribuída rapidamente.
Neste estudo, micelas de HLDM carregadas com Pp IX foram preparadas para superar algumas desvantagens de Pp IX [48], como instabilidade e agregação na solução aquosa. Nossa hipótese é que as micelas HLDM carregadas com Pp IX, auto-montadas a partir de nanocarreadores HLDM [49], devem ser acumuladas e liberadas Pp IX no microambiente tumoral [50]. O Pp IX foi estimulado para facilitar a geração de ROS após o acúmulo de Pp IX nas células tumorais, o que pode causar a morte das células cancerosas (como na Fig. 1). A síntese e caracterização de materiais HLDM foram comprovadas por 1H-NMR, conforme relatado anteriormente [51]. Assim, no presente trabalho, a captação celular, fototoxicidade, geração de ROS, observação morfológica nuclear e efeito da PDT in vivo de micelas de HLDM carregadas com Pp IX foram estudadas.
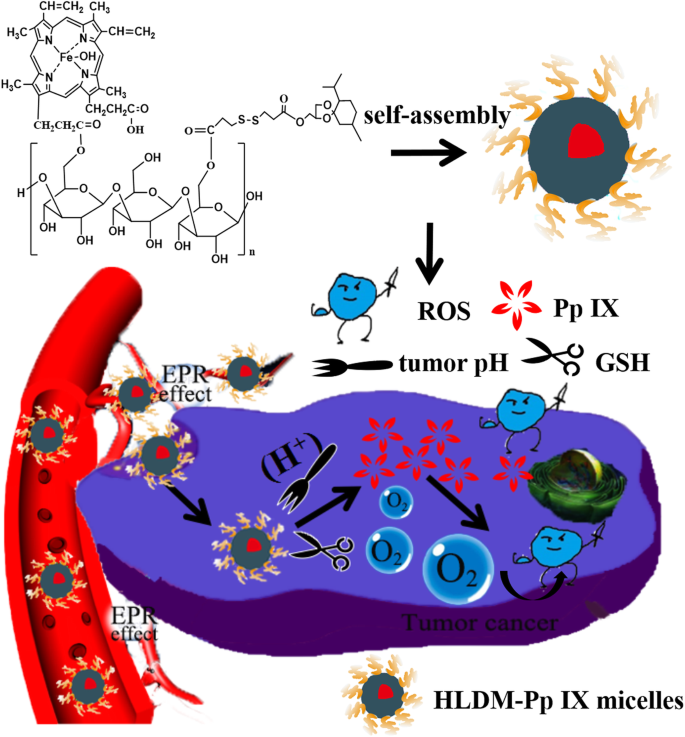
Ilustração esquemática da nanomedicina à base de laminarina (HLDM) usada para fornecer o fotossensibilizador para terapia de tumor
Métodos
Materiais
A laminarina foi adquirida da Sigma-Aldrich (Shanghai, PR China). Dimetilsulfóxido (DMSO) foi fornecido por Tianjin Bodi Co. Ltd. l-glutationa (GSH), Hoechst 33342 foi fornecido por Sigma-Aldrich (Shanghai, PR China). Meio Eagle modificado por Dulbecco (DMEM) e soro fetal bovino (FBS) foram obtidos da Science Biotechnology Co. Ltd. (Shangdong, Yantai, China). O kit de ensaio de espécies reativas de oxigênio (ROS) foi fornecido pela Beyotime Biotechnology (Shanghai, China). H & E foram adquiridos da Bioworld Technology Co. Ltd. (Nanjing, China). O Pp IX foi fornecido pela Aladdin Reagent Net (Shanghai, China). Todos os outros reagentes e solventes eram de qualidade química.
As células de câncer de mama humano (MCF-7) foram fornecidas pelo Laboratório de Farmacologia Molecular da Escola de Farmácia da Universidade de Yantai (Shandong, China).
Camundongos nus fêmeas pesando 14-18 g (3-4 semanas) foram adquiridos de Beijing Vital River Laboratory Animal Technology Co. Ltd.
Síntese e caracterização de materiais HLDM
Os materiais HLDM foram sintetizados e fornecidos usando os métodos apresentados em relatórios anteriores [51]. Em primeiro lugar, o cloreto de oxaloílo foi usado para ativar o ácido ditiopropiônico em cloreto de acila, que foi acilado com MGK para obter HOOC-S-S-MGK. Depois disso, cloridrato de 1-etil-3- (3-dimetilaminopropil) carbodiimida (EDCI) e 4-dimetilaminopiridina (DMAP) foram usados para ativar HOOC-S-S-MGK e, em seguida, a reação de esterificação foi realizada com laminarina a 40 ° C. Finalmente, sintetizamos os materiais HLDM por esterificação usando EDC / DMAP como catalisador. O DMSO-D 6 e D 2 O foram escolhidos como solvente para analisar a composição dos compostos. E 1 Os espectros de H-NMR (Advance Bruker 400M; Switzerland Bruker Company, Madison, WI, EUA), espectros de IV e de absorção de UV-visível (200-700 nm) para materiais HLDM foram testados e determinados em temperatura ambiente.
Preparação de micelas de automontagem (micelas de HLDM carregadas Pp IX)
As micelas de HLDM carregadas com Pp IX foram exploradas através do método de diálise. Em suma, um núcleo hidrofóbico consiste em MGK, ácido ditiodipropiônico e hematina, bem como uma camada hidrofílica de laminarina pode se automontar em água para formar polimicelas. Pp IX foi carregado no núcleo hidrofóbico durante a agitação para ganhar micelas de HLDM carregadas com Pp IX. HLDM e Pp IX foram dialisados em água desionizada (MWCO 2000 Da) em 90-1 agitador a 600 rpm após agitação por um tempo razoável em reagente orgânico para dissolver, seguido por processamento subsequente, para ganhar micelas de HLDM carregadas com Pp IX. Todo o procedimento ocorreu à temperatura ambiente.
Caracterização de Micelas
O tamanho de partícula e o potencial zeta para as micelas de HLDM carregadas com Pp IX foram determinados usando Beckman Coulter Particle Analyzer (número de peça:A35878) à temperatura ambiente. A morfologia das micelas HLDM carregadas com Pp IX foi visualizada por um microscópio eletrônico de transmissão H-600 (H-600 TEM; Hitachi, Tóquio, Japão). Para determinar a capacidade de carregamento, as micelas de HLDM carregadas com Pp IX foram quebradas por um aparelho ultrassônico em um reagente orgânico. A concentração de Pp IX livre nas micelas foi medida por espectros de absorção no UV-visível a 630 nm. A eficiência de aprisionamento (EE) e o conteúdo de carga de droga (DL) foram calculados de acordo com a fórmula.
EE (%) =(peso de Pp IX nas micelas de HLDM carregadas com Pp IX / peso do Pp IX geral) × 100%
DL (%) =(peso de Pp IX nas micelas de HLDM carregadas com Pp IX / peso das micelas) × 100%
Cultura de células
As linhas de células de câncer de mama humano (MCF-7), linhas de células de câncer de cólon (CT-26) (Fig. 5) e linhas de células de câncer de pulmão (A549) (Fig. 5) foram usadas para determinar micelas de HLDM carregadas com Pp IX por microscópio de fluorescência invertido (AxioVert.A1). Foi amplamente provado preliminarmente que esses materiais tinham efeito antitumoral. Mas o experimento demonstrou que o MCF-7 poderia ter mais absorção do que as outras duas linhagens de células cancerígenas. Portanto, MCF-7, cultivado em DMEM (Hyclone) com 10% de soro fetal bovino, foi selecionado para monitorar o efeito curativo a 37 ° C em uma atmosfera umidificada contendo 5% de CO 2 .
Captação de células
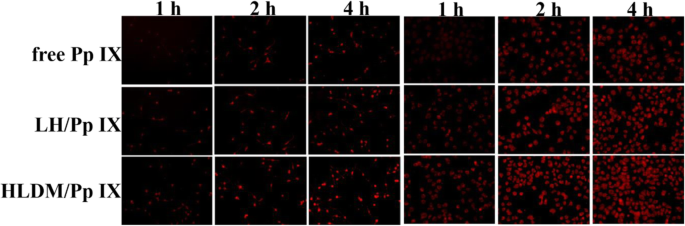
O meio fresco contendo Pp IX livre, micelas de laminarina-hematina (LH) carregadas com Pp IX ou micelas de HLDM carregadas com Pp IX foram adicionados para substituir o meio original após 24 h, respectivamente. As células MCF-7 foram então cultivadas por 1 h, 2 h e 4 h (concentração de Pp IX:20 μg / mL) ou por 4 h com as seguintes concentrações diferentes de Pp IX:10 μg / mL, 20 μg / mL, e 50 μg / mL na atmosfera acima. A consequência da captação celular foi observada por microscópio de fluorescência invertido (Eclipse E400; Nikon Corporation, Tóquio, Japão) para ter uma análise qualitativa [52].
Estudo de localização celular
Neste estudo, a Pp IX não foi apenas uma droga anticâncer para induzir a morte de células cancerosas, mas também uma sonda de fluorescência vermelha para localizar a captação. As células MCF-7 em meio fresco contendo Pp IX livre, micelas de LH carregadas com Pp IX ou micelas de HLDM carregadas com Pp IX foram cultivadas por 4 h em concentração de 20 μg / mL acima da atmosfera. Após fixação com paraformaldeído 4%, o fixador foi substituído por Hoechst 33342 (10 μg / mL) para tingir o núcleo por 15 min. O resultado da localização foi visualizado em microscópio invertido de fluorescência.
Medição da geração de espécies reativas de oxigênio
A capacidade de geração de espécies reativas de oxigênio (ROS) foi medida intracelularmente usando microscópio de fluorescência, que utilizou a sonda ROS 2 ′, 7′-diacetato de diclorofluorescina (DCFH-DA). MCF-7 foi semeado em placas de seis poços e incubado. Após 24 h, o meio foi removido e substituído por meio fresco contendo Pp IX livre ou micelas de HLDM carregadas com Pp IX (20 μg / mL) por 2 h. As células foram lavadas com meio DMEM, seguido de irradiação de meia hora (630 nm). Depois de lavar duas vezes, as células MCF-7 foram incubadas com DCFH-DA (10 μmol / L) na atmosfera acima por 30 min, que foram então fotografadas por microscópio de fluorescência (comprimento de onda de excitação:488 nm, comprimento de onda de emissão:525 nm) após a lavagem novamente com meio DMEM.
Ensaios de fototoxicidade e viabilidade
MCF-7 foi inoculado em planta de 96 poços para detectar a citotoxicidade de diferentes formas de dosagem para os ensaios de viabilidade. Em seguida, o DMEM fresco incluindo diferentes concentrações de Pp IX livre, micelas de LH carregadas com Pp IX ou micelas de HLDM carregadas com Pp IX (1, 2, 5 e 10 μg / mL) foram adicionados em cada poço. Para o grupo de fototoxicidade, as células foram incubadas por 4 h para absorção, sendo posteriormente irradiadas por 30 min, seguidas de incubação por 24 h na atmosfera acima. Por outro lado, os poços foram preparados para analisar a citotoxicidade e viabilidade no escuro como grupo controle. Eles foram posteriormente inoculados por 24 horas acima da atmosfera.
Vinte microlitros de solução de brometo de 3- (4,5-dimetiltiazol-2-il) -2,5-difenil-tetrazólio (MTT) (5 mg / mL) e 180 μL de PBS (pH 7,4) foram adicionados em 96 poços placa e posteriormente incubado por mais 3 h. Posteriormente, 150 μL de DMSO foram usados para soluir o produto de formazan e a absorbância (DO) foi medida usando um instrumento marcado com enzima (SpectraMax M 5) a 490 nm. A viabilidade de MCF-7 foi expressa usando a seguinte fórmula:
Viabilidade =((amostra OD - preto OD) / (controle OD - preto OD)) × 100%.
Os valores da amostra de OD foram fornecidos pelas células tratadas com o fármaco, enquanto os valores do controle de OD foram fornecidos pelas células sem fármaco, e os valores de OD preto foram obtidos dos poços sem fármaco e células.
Observação Morfológica Nuclear
A linha celular MCF-7 foi incubada por 24 h e, em seguida, estimulada com micelas de HLDM carregadas com Pp IX por 4 h. Após enxágue e fixação, as células foram coradas com sonda de fluorescência nuclear por 20 min a 37 ° C, seguida da remoção do corante do ambiente com PBS. As imagens de fluorescência correspondentes foram visualizadas usando uma microscopia de fluorescência.
Avaliação de eficácia e segurança In Vivo
Ratinhos nus fêmeas foram posteriormente usados para investigar a viabilidade anticancerígena de micelas de HLDM carregadas com Pp IX in vivo. Células MCF-7 (1,5 × 10 6 células / 0,1 mL) foram injetados em oxter de camundongos nus fêmeas como modelos animais e, em seguida, o estrogênio foi dado por gavagem intragástrica para promover o crescimento do tumor. Os ratos foram divididos aleatoriamente em cinco grupos, uma vez que o volume dos tumores atingiu aproximadamente 70-100 mm 3 , que foram denotados como solução salina normal, Pp IX livre (5 mg / kg), micelas de HLDM carregadas com Pp IX (5 mg / kg de equivalentes de Pp IX livres), Pp IX livre (5 mg / kg) mais irradiação de luz, e Micelas de HLDM carregadas com Pp IX (5 mg / kg de equivalentes de Pp IX livres) mais irradiação de luz. Os grupos tratados com luz foram expostos a laser de 630 nm com 30 minutos e 24 horas após a injeção. A eficácia terapêutica foi avaliada monitorando os volumes do tumor em cinco grupos tratados em dias alternados e analisando a lâmina histopatológica após 20 dias. E os pesos corporais foram medidos para avaliar a segurança do medicamento em cinco grupos tratados a cada 2 dias [53].
Análise estatística
Todos os dados neste estudo foram registrados como médias ± desvio padrão ( n =3). Além disso, as diferenças significativas entre os diferentes grupos foram analisadas usando uma análise de variação unilateral (ANOVA). As diferenças foram consideradas estatisticamente significativas em níveis de probabilidade de * P < 0,05 (significativo), ** P < 0,01 (altamente significativo).
Resultados e discussão
Caracterização de materiais HLDM
1 Os espectros de H-NMR para os materiais HLDM foram mostrados em relatórios anteriores [51]. O pico de metil para MGK foi observado em cerca de δ:0,8 (Fig. 2h). 1 Os espectros de H-NMR revelaram pico de absorção em cerca de δ:2,8 (Fig. 2g), que foi CH 2 em ácido 3,3-ditiodipropiônico. O aparecimento do pico do sinal em δ:6,5 (Fig. 2j) verificou a presença de hematina. O pico característico da laminarina em materiais poliméricos anfifílicos foi encontrado na região entre 3 e 4 ppm, indicando que o novo produto do HLDM foi sintetizado com sucesso.
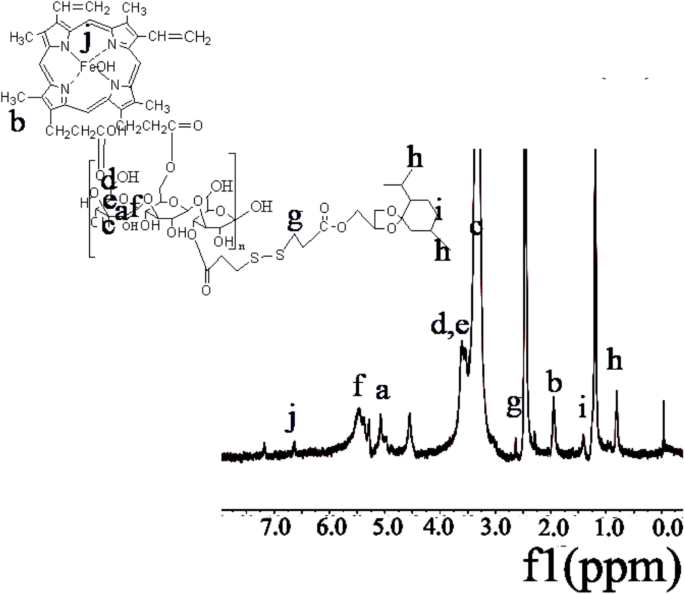
O 1 Espectro H-NMR de HLDM
Espectros de IV para HLDM
Os espectros de IV de materiais HLDM foram mostrados em relatórios anteriores [51]. O pico duplo na imagem testemunhou a conexão do MCK. Além disso, o pico caracterizado do grupo carbonil éster foi observado em espectros de IV.
Espectros de absorção UV-visíveis de HLDM
Na Fig. 3a, a hematina teve um comprimento de onda de absorção ultravioleta (cerca de 580 nm) e na Fig. 3b, Laminarina-ácido ditiodipropiônico-MGK não teve absorção na mesma posição. Os espectros de absorção de UV-visível foram realizados para verificar a ligação da hematina com base nisso. O resultado indicou que o comprimento de onda de absorção caracterizado em 580 nm foi observado em materiais HLDM (Fig. 3c). A hematina foi conectada com sucesso aos materiais HLDM.
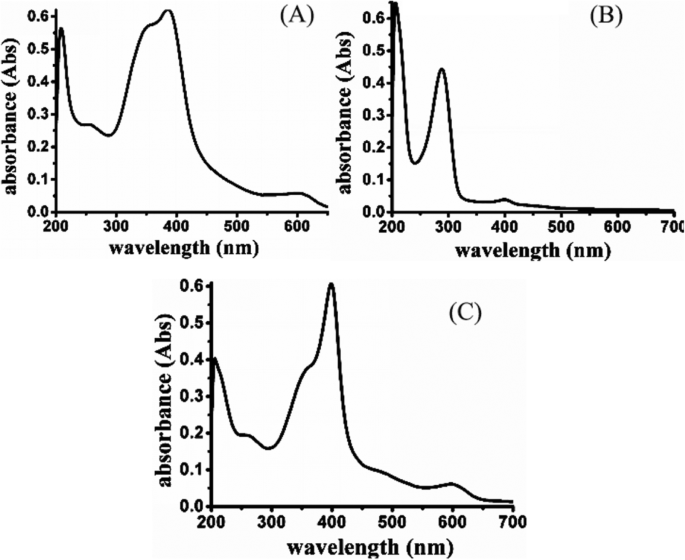
Espectro de absorção UV-visível da hematina ( a ), Laminarin-S-S-MGK ( b ) e HLDM ( c )
Caracterização de micelas carregadas Pp IX
O tamanho e o potencial zeta de micelas de HLDM carregadas com Pp IX são mostrados na Fig. 4a, b. Foi demonstrado que as micelas foram melhor absorvidas pelas células cancerosas, para aumentar a eficiência e reduzir os efeitos colaterais (maior permeabilidade e efeito de retenção, EPR). As micelas foram vistas a olho nu após filtro de membrana Millipore na Fig. 4c. Nesta base, a imagem de micelas de HLDM carregadas com Pp IX foi varrida por microscópio eletrônico de transmissão (TEM), como mostrado na Fig. 4d. A morfologia era de partículas não uniformes, porque o tempo para ultrassom era deficiente. Por outro lado, a aglomeração de partículas foi observada na foto, provavelmente devido à maior concentração (Fig. 5).
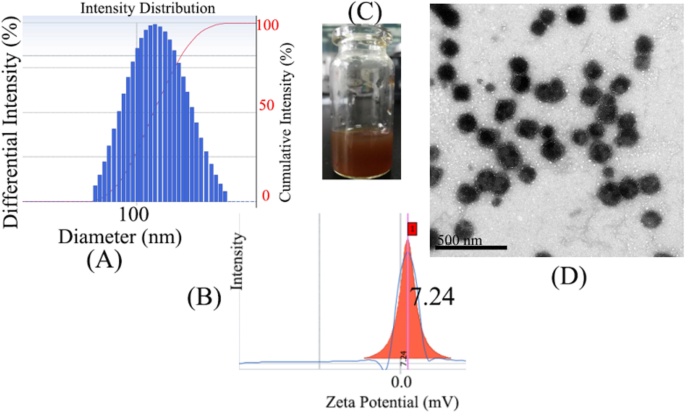
a , b O tamanho e o potencial zeta de micelas de HLDM carregadas com Pp IX. c As micelas de HLDM carregadas com Pp IX na água. d A imagem TEM de micelas HLDM carregadas com Pp IX
Captação de Pp IX livre, LH carregado com Pp IX e micelas de HLDM carregados com Pp IX em CT-26 (esquerda) e A549 (direita)
A eficiência de aprisionamento (EE) e o conteúdo de carga de droga (DL) foram calculados pela fórmula (Tabela 1). Foi descoberto depois de muitos experimentos que a flutuação de EE e DL eram instáveis, já que havíamos especulado que as micelas de HLDM carregadas com Pp IX poderiam se agregar em solução aquosa.
Captação celular
Neste estudo, a fluorescência de Pp IX foi detectada para investigar a dependência do tempo e da concentração. Como pode ser visto no diagrama, as micelas de HLDM carregadas com Pp IX foram absorvidas em células MCF-7 e sua intensidade de fluorescência aumentou com o tempo e a concentração. Ao comparar as três micelas na Fig. 6a, as células cancerosas que receberam micelas de HLDM carregadas com Pp IX tinham mais fluorescência. Isso ocorreu porque frações pH / redox foram ligadas aos materiais para responder ao microambiente do tumor. As células cancerosas que receberam Pp IX livre tinham fluorescência mais fraca devido à agregação em DMEM.
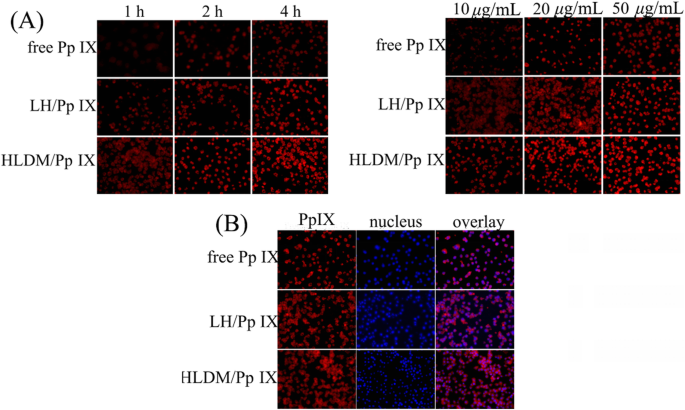
a Absorção de micelas de HLDM carregadas com Pp IX, LH com Pp IX e carregadas com Pp IX livres. b Localização celular de micelas HLDM carregadas com Pp IX
Do que foi discutido acima, podemos chegar com segurança à conclusão de que materiais HLDM, incluindo pH e frações de sensibilidade à redução, podem melhorar a aglomeração de Pp IX e aumentar sua absorção e liberação em células tumorais.
Estudo de localização celular
Conforme mostrado na Fig. 6b, o núcleo foi corado por corante fluorescente, e então pudemos ver o fenômeno fluorescência vermelha apresentado fora da fluorescência azul. Havíamos especulado que a captação celular poderia estar relacionada ao citoplasma, então essa hipótese foi verificada pelo estudo anterior de que a Pp IX havia se acumulado e localizado na mitocôndria e no citoplasma das células tumorais [54].
Medição da geração de espécies reativas de oxigênio
Conforme mostrado na Fig. 7, as espécies reativas de oxigênio (ROS) em células MCF-7 foram monitoradas usando DCFH-DA como um indicador, que foi observado para ter fluorescência verde em microscopia de fluorescência. Micelas de HLDM carregadas com Pp IX tinham maior intensidade de fluorescência verde sob a luz, enquanto Pp IX livre quase não tinha fluorescência. Especulamos que o Pp IX livre poderia se aglomerar para causar o efeito de autoextingimento no DMEM. A fluorescência verde de três grupos era insignificante sem luz (como o grupo de controle). Esses resultados confirmaram que o Pp IX poderia estimular o oxigênio a gerar ROS como fotossensibilizador sob a condição de luz.
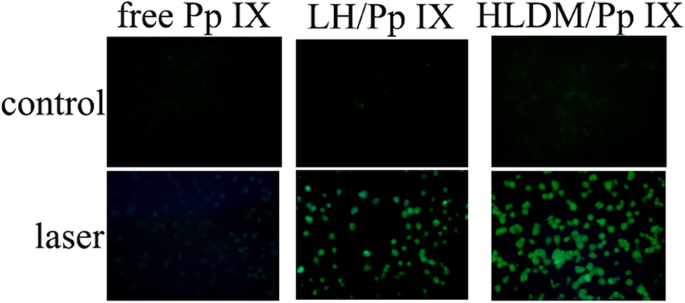
Geração de espécies reativas de oxigênio (ROS) sob condições de luz
Ensaio de fototoxicidade e viabilidade
A citotoxicidade celular e o ensaio de viabilidade foram realizados com células de câncer de mama humano MCF-7 em dois ambientes externos diferentes, usando o ensaio MTT. Conforme mostrado na Fig. 8a, a diferença significativa de dano celular foi insignificante em todas as amostras no escuro. Quando a concentração de Pp IX foi aumentada para 50 μg / mL, a viabilidade das células MCF-7 que detectamos permaneceu em alto nível. O fenômeno mostrou que a citotoxicidade para células ou órgãos não aumentou significativamente com o aumento da concentração de Pp IX.
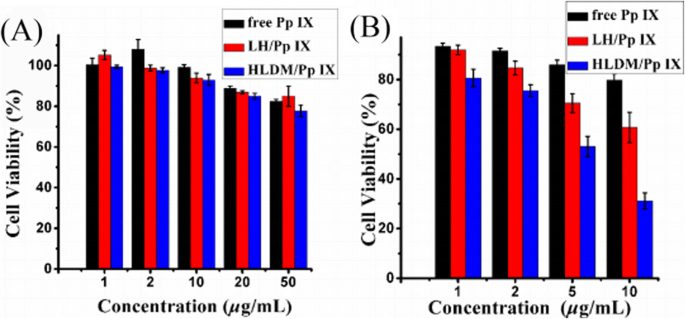
a Viabilidade das células MCF-7 de Pp IX livre, micelas de LH carregadas com Pp IX ou micelas de HLDM carregadas com Pp IX sob condição de luz. b Toxicidade relativa à luz de Pp IX livre, micelas de LH carregadas com Pp IX ou micelas de HLDM carregadas com Pp IX após irradiação. n =3; * indica P < 0,05
Conforme representado na Fig. 8b, 5 μg / mL de Pp IX teve diferença significativa nos grupos de drogas livres e micelas. A citotoxicidade para células ou órgãos aumentou significativamente no grupo das micelas, à medida que a concentração de Pp IX aumentou sob a luz, enquanto os grupos de Pp IX livre apresentaram pouca alteração até a concentração de 10 μg / mL. Estes dados mostraram que a eficiência fototóxica de micelas carregadas com Pp IX era claramente maior do que a de Pp IX livre. Mais uma vez, o experimento demonstrou que o fotossensibilizador livre pode se acumular para causar o efeito de auto-extinção. Portanto, podemos concluir que as micelas de HLDM carregadas com Pp IX têm um enorme potencial para matar células cancerosas com irradiação de luz.
Observação Morfológica Nuclear
No estudo de localização de células, descobrimos involuntariamente que o núcleo corado apresentava manchas brancas, e a maior concentração de Pp IX era mais evidente com esse fenômeno. Talvez seja por causa do dano ao DNA no núcleo. Como mostrado na Fig. 8, micelas de HLDM carregadas com Pp IX de 20 μg / mL podem causar danos ao DNA em comparação com o controle correspondente em MCF-7. Quando a concentração atingiu 50 μg / mL, o dano seria sério nas células cancerosas. O estudo de observação morfológica nuclear sugeriu que o dano ao DNA foi um marcador precoce para a morte de células MCF-7 induzida por Pp IX [26] (Fig. 9).
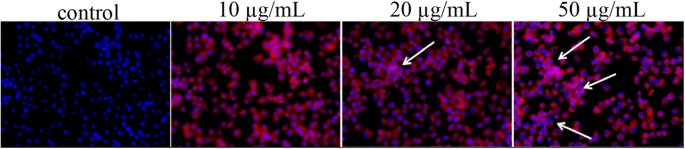
Dano de DNA de células MCF-7 após tratamento com Pp IX
Avaliação de eficácia e segurança In Vivo
Como mostrado na Fig. 10a, b, o crescimento do tumor de cinco grupos foi medido para avaliar a eficácia in vivo. O grupo tratado com solução salina exibiu crescimento contínuo a uma taxa relativamente alta. Não houve diferença significativa entre os grupos tratados com Pp IX livre e micelas de HLDM carregadas com Pp IX e o grupo de solução salina. Estes dados indicaram que o volume do tumor foi menos afetado pelo Pp IX sem irradiação. Enquanto isso, o grupo tratado com Pp IX livre mais luz produziu ligeira alteração no volume do tumor. O que causou esse fenômeno foi que a droga livre era instável in vivo e, portanto, fácil de coletar no sangue. Portanto, pode ter sido eliminado antes de chegar ao tecido tumoral. Em contraste, o crescimento do tumor tratado com micelas de HLDM carregadas com Pp IX foi significativamente inibido na Fig. 10a. Este fenômeno provou que as micelas exibiram efeito antitumoral significativo após fornecer um determinado comprimento de onda de luz para estimular. Resumindo, esta experiência demonstrou que os efeitos antitumorais de micelas de HLDM carregadas com Pp IX melhoraram obviamente sob a condição de luz.
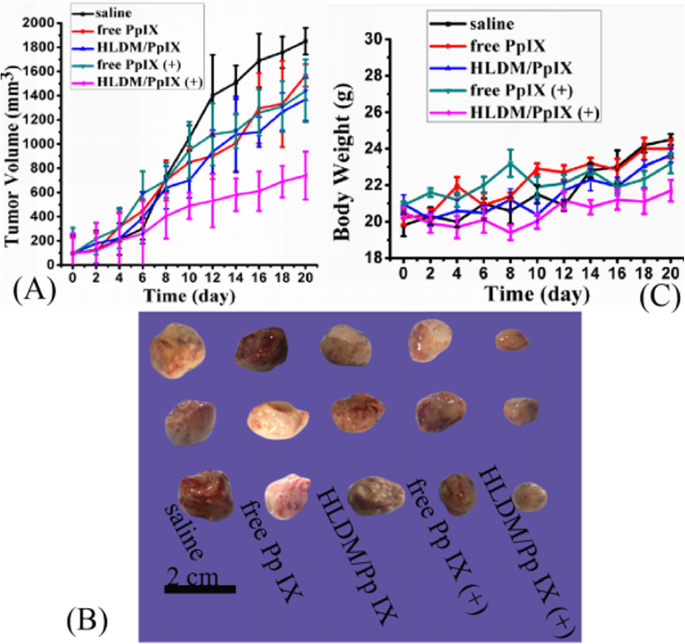
Atividade antitumoral in vivo e avaliação de segurança. a O volume do tumor muda com o tempo de tratamento. b Volume do tumor de cinco grupos:( a ) solução salina normal, ( b ) Pp IX livre (5 mg / kg), ( c ) Micelas de HLDM carregadas com Pp IX (5 mg / kg de equivalentes de Pp IX livres), ( d ) Pp IX livre (5 mg / kg) mais irradiação de luz, e ( e ) Micelas de HLDM carregadas com Pp IX (5 mg / kg de equivalentes de Pp IX livres) mais irradiação de luz. c A mudança corporal de camundongos nus portadores de tumor
Por outro lado, o peso corporal relativo foi medido para avaliar a segurança de micelas de HLDM carregadas com Pp IX (Fig. 10c). Não houve perda de peso corporal evidente e mudanças desprezíveis em todos os grupos, sugerindo a boa biossegurança desses tratamentos para os camundongos.
Além disso, a lâmina histopatológica mostrou um polimorfismo nuclear claro no grupo de solução salina na Fig. 11. As alterações patológicas no tecido tumoral corado com hematoxilina e eosina (H&E) tiveram diferença significativa em cinco grupos. Os resultados mostraram uma ligeira condensação nuclear nas micelas HLDM carregadas com Pp IX e grupos Pp IX livres. Os tecidos tumorais do grupo de micelas HLDM carregadas com Pp IX (mais luz) exibiram um dano nuclear óbvio. Portanto, concluímos que esses resultados foram consistentes com os resultados acima para eficácia in vivo e avaliação de segurança.
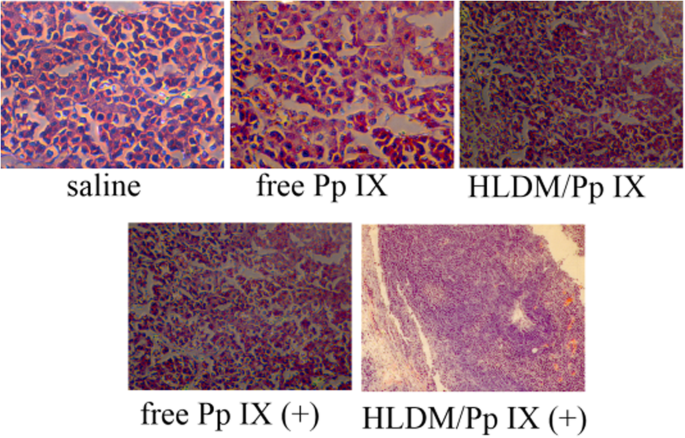
Coloração de tumor H&E com diferentes formulações. Todos os dados são relatados como uma média ± DP. n =3; * indica P < 0,05
Até o momento, uma variedade de materiais tem sido estudada para a entrega de drogas [55]. No estudo anterior, sintetizamos com sucesso conjugados duplos de polissacarídeo marinho sensíveis a pH / redox [56] e laminarina e, nesta pesquisa, os conjugados foram usados como sistema de entrega para Pp IX, para atingir efeitos antitumorais. Experimentos in vivo manifestaram que micelas de HLDM carregadas com Pp IX poderiam efetivamente entregar Pp IX em células cancerosas e gerar efeitos letais diretos mediados por ROS em células cancerosas. Os experimentos de citotoxicidade mostraram que as micelas tinham leve citotoxicidade sem irradiação de luz, enquanto soluções de baixa concentração de micelas tinham um impacto perceptível na viabilidade celular dentro de uma determinada iluminação. Em nível animal, as micelas de HLDM carregadas com Pp IX exerceram efeito fototóxico para produzir um efeito antitumoral relevante. Portanto, as atividades de micelas de HLDM carregadas com Pp IX foram convincentemente certificadas in vitro e in vivo.
Conclusões
A novel laminarin-based nanomedicine platform to address undesirable characteristics of Pp IX such as instability and astatic distribution was successfully studied in this research. The photosensitivity and phototoxicity of Pp IX-loaded HLDM micelles were detected and evaluated in vitro and in vivo. Nuclear morphological observation of Pp IX showed that the Pp IX-loaded HLDM micelles could effectively deliver and accumulate Pp IX to cancer cells and cause nuclear damage. The research on phototoxicity and ROS production manifested that Pp IX-loaded HLDM micelles exhibited a relevant PDT effect, exerting anti-tumor activity with a certain wavelength light. Likewise, the in vivo research testified that the Pp IX-loaded HLDM micelles could induce PDT effect under the light condition, which could remarkably enhance the anti-tumor effect of Pp IX. To sum up, the results for in vitro and in vivo studies indicated that Pp IX-loaded HLDM micelles could effectively produce PDT effect and can be applied in the future in tumor treatment in the next research. This promising laminarin-based nanomedicine platform will have great potential for becoming new drug delivery system [57] to deliver hydrophobic photosensitizer for cancer photodynamic therapy (PDT).
Disponibilidade de dados e materiais
Os conjuntos de dados que suportam as conclusões deste artigo estão incluídos no artigo.
Abreviações
- HLDM:
-
Hematin-Laminarin-Dithiodipropionic acid-MGK
- LH:
-
Laminarin-Hematin
- Pp IX:
-
Protoporphyrin IX
- PDT:
-
Terapia fotodinâmica
- ROS:
-
Espécies que reagem ao oxigênio
Nanomateriais
- Demonstração de um biossensor flexível à base de grafeno para detecção sensível e rápida de células cancerosas do ovário
- Nanopartículas multifuncionais de ouro para aplicações diagnósticas e terapêuticas aprimoradas:uma revisão
- Nanopartículas para terapia do câncer:progresso e desafios atuais
- Preparação de nanopartículas de mPEG-ICA carregadas com ICA e sua aplicação no tratamento de dano celular H9c2 induzido por LPS
- Bioflavonóide direcionado ao receptor de folato Nanopartículas de quitosana carregadas com genisteína para efeito anticâncer avançado em cânceres cervicais
- Novel Biocompatible Au Nanostars @ PEG Nanopartículas para imagens In Vivo CT e propriedades de depuração renal
- A preparação da nanoestrutura de casca de gema de Au @ TiO2 e suas aplicações para degradação e detecção de azul de metileno
- Propriedades das nanopartículas de óxido de zinco e sua atividade contra micróbios
- Síntese fácil de nanopartículas de irídio livres de ligante e sua biocompatibilidade in vitro
- Síntese one-pot de nanopartículas de núcleo-shell monodispersas CoFe2O4 @ Ag e sua caracterização



