Abordagem fácil para preparar microesferas rGO @ Fe3O4 para a terapia combinada quimio-fototérmica com alvo magnético e responsiva a NIR
Resumo
O grafeno responsivo à luz do infravermelho próximo (NIR) demonstrou um efeito estimulante na terapia de ablação fototérmica do câncer. Aqui, relatamos a preparação de Fe 3 O 4 microesferas ocas de grafeno decoradas (rGO @ Fe 3 O 4 ) por uma secagem por pulverização fácil e método de coprecipitação para a terapia de combinação quimio-fototérmica magneticamente direcionada e responsiva a NIR. As microesferas exibiram uma área de superfície específica muito alta (~ 120,7 m 2 g −1 ) e grande volume de poro (~ 1,012 cm 3 g −1 ), demonstrando vantagens distintas para uma alta capacidade de carregamento de DOX (~ 18,43%). NIR desencadeou efeito fototérmico do rGO @ Fe 3 O 4 microesferas responderam de uma maneira on-off e induziram uma alta eficiência de conversão fototérmica. Além disso, The Fe 3 O 4 nas microesferas exibiu uma excelente capacidade de direcionamento de células tumorais. O tratamento quimio-fototérmico baseado em rGO @ Fe 3 O 4 / DOX mostrou citotoxicidade superior para células Hela in vitro. Nossos estudos indicaram que rGO @ Fe 3 O 4 / DOX microcápsulas têm grande potencial no tratamento combinado de câncer quimio-fototérmico.
Introdução
O câncer é uma das doenças mais malignas do mundo e uma das principais causas de morte humana [1, 2]. Embora a quimioterapia seja comumente usada no tratamento clínico do câncer, várias questões importantes, incluindo baixa eficiência terapêutica e efeitos colaterais extensos, limitam seriamente sua aplicação [3]. Os sistemas de liberação de drogas (DDS) têm mostrado grandes vantagens em aumentar a solubilidade, a biodisponibilidade e o acúmulo de tumor de drogas, o que se espera que melhore de forma proeminente sua eficiência antitumoral [4]. Recentemente, microesferas ocas empregando como sistemas de liberação de drogas têm ganhado atenção crescente devido à sua grande área de superfície e estruturas porosas abundantes [5,6,7,8], e vários materiais de microesferas ocas foram projetados com tecnologias inovadoras [9,10,11 , 12,13].
O óxido de grafeno (GO), um novo tipo de material metálico livre inorgânico, tem sido amplamente investigado na liberação de fármacos devido às suas características únicas, como boa biocompatibilidade, baixo custo e preparo simples [14,15,16,17]. Notavelmente, o óxido de grafeno pode efetivamente transformar luz em calor quando acionado por irradiação NIR [18,19,20], tornando-se uma estratégia promissora para melhorar o efeito da terapia fototérmica do câncer. O grupo Chen relatou que o GO poderia entregar as drogas anticâncer por interação não covalente, como empilhamento π-π, ligação de hidrogênio e adsorção eletrostática [21]. No entanto, a nanofolha de óxido de grafeno 2D tende a se aglomerar devido à grande superfície específica, bem como às ligações de van der Waals entre as camadas de grafeno [17, 22], resultando em baixa solubilidade em água e diminuindo a capacidade de carga de droga. Algumas estratégias foram exploradas para superar essas deficiências. O grupo Tsukruk desenvolveu cápsulas ocas de grafeno usando tecnologia de montagem camada por camada [23], que mostrou uma carga de droga extremamente alta em comparação com outros materiais GO. Isso pode ter contribuído para a alta área de superfície específica e grande volume de poro da cápsula oca estabilizada por GO. No entanto, poucos relatos se referem ao estudo do GO com uma estrutura de poros conectada tridimensionalmente para a administração de drogas.
Embora muitos sistemas de entrega de drogas relatados tenham exibido capacidade superior de carregamento de drogas e comportamento de liberação controlada de drogas, suas pesquisas e aplicações pré-clínicas também são limitadas devido a uma especificidade insuficiente para os tecidos tumorais alvo [24]. Entre vários sistemas de distribuição de drogas, Fe 3 O 4 , um material de alvo magnético é amplamente utilizado na terapia do câncer por suas altas respostas magnéticas, qualidade estável e fácil realização [25,26,27,28,29]. O grupo Ni desenvolveu um Fe 3 O 4 @SiO 2 nanopartículas de estrutura núcleo-casca com propriedade superparamagnética para direcionamento magnético de tumores [30]. Além disso, Fe 3 O 4 nanopartículas de GO ancoradas foram bem estudadas em combinação de distribuição de alvo magnético e terapia fototérmica [31,32,33,34].
No presente estudo, relatamos uma estratégia avançada para o desenvolvimento de uma plataforma DDS compreendendo microesferas ocas rGO decoradas com óxido de ferro (rGO @ Fe 3 O 4 ) para a terapia fototérmica (PTT) com alvo magnético e desencadeada por NIR. Conforme descrito no Esquema 1, rGO @ Fe 3 O 4 microesferas ocas foram preparadas em três etapas. Em primeiro lugar, rGO-SiO 2 é sintetizado pelo método de secagem por pulverização usando SiO 2 como um modelo e, em seguida, microesferas ocas rGO foram obtidas removendo SiO 2 com corrosão HF. Depois, Fe 3 O 4 nanopartículas foram ancoradas em microesferas ocas de rGO para construir rGO @ Fe 3 O 4 microesferas. Neste sistema, rGO é servido como um agente PTT acionado por NIR e Fe 3 O 4 pode oferecer a propriedade de direcionamento magnético para a célula Hela. Doxorrubicina (DOX), microesferas encapsuladas (rGO @ Fe 3 O 4 / DOX) com base na adsorção de poros e empilhamento π-π, espera-se que exiba capacidade de carga de droga ultra-alta e comportamento de liberação de droga responsivo ao pH, e pode aumentar significativamente o efeito anticâncer para a combinação de fototérmico-quimioterapia.
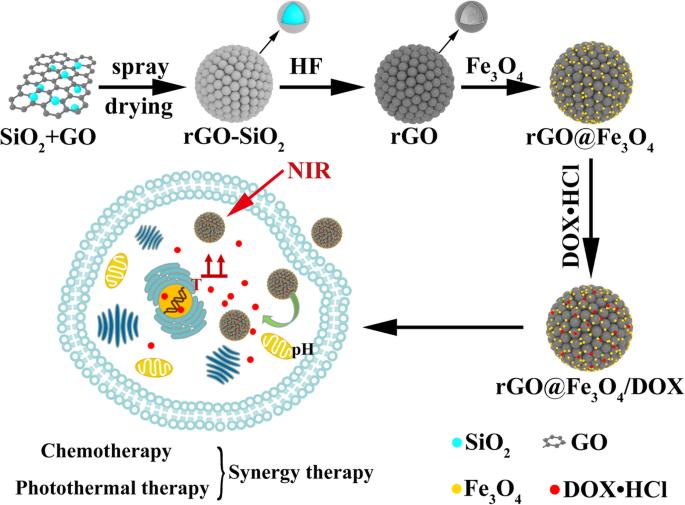
Ilustração esquemática de rGO @ Fe 3 O 4 / DOX microesferas e a fototermal quimioterapia combinada para inibição de tumor
Materiais e métodos
Materiais
Cloreto de ferro hexahidratado (FeCl 3 · H 2 O), hidróxido de sódio (NaOH) e sulfato ferroso heptahidratado (FeSO 4 · 7H 2 O) foram adquiridos de Sinopharm Chemical Reagent Co., Ltd. As células Hela são de Tianjin Cancer Hospital. Solução salina tamponada com fosfato (PBS) , O cloridrato de doxorrubicina (DOX · HCl), o meio essencial mínimo de Dulbecco (DMEM), 4 ', 6-diamidino-2-fenilindol (DAPI) e o kit de contagem de células-8 (CCK-8) foram adquiridos de Solarbio Science and Technology Co. , Ltd. SiO 2 (~ 300 nm) foi adquirido da Shanghai Yuanjiang Chemical Company. A solução aquosa de óxido de grafeno (2 mg / ml) era um produto comercialmente disponível da Nanjing Xianfeng Company.
Preparações de rGO @ Fe 3 O 4 Microesferas
Microesferas ocas de grafeno foram preparadas através do método de secagem por pulverização usando SiO 2 (300 nm) como o modelo. Resumidamente, 100 mL SiO 2 suspensão líquida (50 mg mL −1 ) foi lentamente colocado em 300 mL de solução aquosa GO (2 mg mL −1 ) sob agitação drástica, a solução misturada foi seca por pulverização a 200 ° C em uma unidade de secagem por pulverização. Posteriormente, o produto foi mantido a 300 ° C sob proteção de Ar por 2 h e rGO-SiO 2 foi obtido. Para remover SiO 2 , rGO-SiO 2 foi colocado em solução de HF (10%) por 48 h a 60 ° C. O produto sólido foi lavado várias vezes e seco em um forno de secagem a vácuo a 60 ° C por 12 h, rGO foi finalmente obtido com um rendimento de 75%.
O rGO @ Fe 3 O 4 nanopartículas foram preparadas pelo método de coprecipitação. Em um processo típico para a síntese de rGO @ Fe 3 O 4 nanopartículas, 0,27 g FeCl 3 · H 2 O, 0,28 g FeSO 4 · 7H 2 O, e 0,1 g de microesferas ocas de rGO foram dissolvidas em 10 mL de água desionizada e agitadas durante 30 min a 50 ° C. Em seguida, 60 mL de NaOH (0,15 mol L −1 ) foi adicionado lentamente sob agitação contínua a 50 ° C durante 12 h. Os produtos foram finalmente separados magneticamente e lavados várias vezes com água desionizada e etanol, seguidos de secagem a 60 ° C sob vácuo durante 12 h.
Caracterização estrutural
O tamanho e a morfologia da amostra foram analisados por meio de microscopia eletrônica de varredura por emissão de campo (FE-SEM, Hitachi, S-4800) e microscopia eletrônica de transmissão (TEM, JEM2100F, JEOL). A composição dos produtos foi analisada via sistema de difração de raios-X (XRD, D8 Focus, radiação Cu Ka, Bruker, Alemanha) a uma taxa de varredura de 12 ° / min na faixa de 10 a 80 °. Além disso, a espectroscopia de fotoelétrons de raios X (XPS) foi realizada em um espectrômetro XPS (Thermo Fisher Scientific, ESCALAB 250Xi, America). Os FTIR (FT-IR, AVATAR360, Nicolet) foram registrados de 500 a 4000 cm -1 com uma resolução de 4 cm −1 . As medições magnéticas foram realizadas usando um magnetômetro de dispositivo de interferência quântica supercondutor (SQUID, Quantum Design MPMS) em temperatura ambiente (300 K). Os espectros Raman foram coletados usando um espectroscópio Raman (Renishaw, inVia Reflex, Inglaterra) com um laser de comprimento de onda de 532 nm. O conteúdo de rGO foi avaliado usando um analisador termogravimétrico (TGA, TA Instruments-water LLC, SDTQ-600). A área de superfície específica foi medida usando a técnica Brunauer-Emmett-Teller (BET). Os espectros de UV-Vis foram registrados usando um analisador de ácido nucléico / proteína Beckman DU 800 (Beck-man Instruments, Inc., Rosemead, CA).
Carregamento e liberação de DOX
DOX, um modelo de droga quimioterápica doxorrubicina, foi encapsulado nos núcleos de rGO @ Fe 3 O 4 para avaliar o comportamento de carga e liberação de drogas anticâncer in vitro. rGO @ Fe 3 O 4 / DOX foi preparado de acordo com a referência anterior. Em resumo, 10 mL (0,2 mg mL −1 ) de solução aquosa de DOX foi adicionado a 10 mg de rGO @ Fe 3 O 4 solução, a mistura foi ultrassonicamente homogeneizada para garantir que não haja precipitação significativa. Em seguida, a mistura foi equilibrada em um agitador alternativo (SK-O180-Pro) a uma velocidade de 150 rpm por 24 h. Após centrifugação a 6000 rpm por 10 min, o DOX não carregado foi removido, o sobrenadante de rGO @ Fe 3 O 4 / DOX foi medido por meio de espectrofotômetro UV-Vis para determinar a quantidade de DOX carregada. O OD de DOX foi registrado em 490 nm, as seguintes equações foram usadas para calcular a eficiência de carregamento (LE) e capacidade de carregamento (LC) do DOX:
$$ \ mathrm {LE} =\ left (\ mathrm {total} \ \ mathrm {quantidade} \ \ mathrm {of} \ \ mathrm {DOX} - \ mathrm {Livre} \ \ mathrm {DOX} \ right) / \ mathrm {total} \ \ mathrm {quantidade} \ \ mathrm {de} \ \ mathrm {DOX} $$$$ \ mathrm {LC} =\ left (\ mathrm {total} \ \ mathrm {quantidade} \ \ mathrm {of} \ \ mathrm {DOX} - \ mathrm {Livre} \ \ mathrm {DOX} \ right) / \ mathrm {quantidade} \ \ mathrm {of} \ mathrm {rGO} @ {\ mathrm {Fe}} _ 3 {\ mathrm {O}} _ 4 / \ mathrm {DOX} $$
Os estudos de liberação in vitro de DOX foram realizados colocando rGO @ Fe 3 O 4 / DOX (10 mg) em um saco de diálise (MWCO =1000) com solução salina tamponada com fosfato (PBS, 30 mL) a pH 5,4, 6,5 ou 7,4, colocando-o em um banho de água a 37 ° C e agitando a 80 rpm. Em intervalos predeterminados, 3 mL do meio de liberação foram coletados e a quantidade de DOX liberada foi calculada medindo o UV-Vis a 480 nm.
Efeito fototérmico disparado por NIR de rGO @ Fe 3 O 4 Microesferas
Para monitorar a influência de rGO @ Fe 3 O 4 dose no efeito fototérmico desencadeado por NIR, o rGO @ Fe 3 O 4 soluções com diferentes concentrações (0,0625, 0,125, 0,25, 0,5 e 1 mg mL −1 ) foram irradiados com laser NIR a 2 W cm −2 por 5 min, respectivamente. Além disso, a influência da energia NIR no efeito fototérmico foi avaliada por irradiação de rGO @ Fe 3 O 4 (0,25 mg mL −1 ) com poderes diferentes (1 W cm −2 , 1,5 W cm −2 , 2 W cm −2 ) por 5 min. A temperatura em tempo real foi medida usando uma câmera térmica infravermelha FLIR I5.
Captação In Vitro
As células Hela foram semeadas em 35 mm 2 pratos confocais a uma densidade de 1 × 10 5 células / poço. Após incubar por 24 h em uma incubadora (5% CO 2 , 37 ° C), o meio foi removido e o meio fresco contendo rGO @ Fe 3 O 4 Microesferas / DOX e rGO @ Fe 3 O 4 / DOX com ímã foram adicionados e cultivados por mais 5 h. O rGO @ Fe 3 O 4 / A concentração de DOX era de 0,1 mg mL −1 . As células foram então lavadas três vezes com PBS frio (pH =7,4) e fixadas com solução de paraformaldeído a 4% por 20 min (CLSM, TCSSP5II, Leica, Ernst-Leitz-Strasse, Alemanha).
Ensaios de viabilidade celular
A citotoxicidade dessas microesferas foi avaliada por um ensaio CCK-8 após o tratamento NIR. As células HeLa foram semeadas em placas de 96 poços (5 × 10 3 células / poço) em 100 μL do meio e cultivadas em 5% de CO 2 a 37 ° C durante 24 h. Para a avaliação de biocompatibilidade, rGO @ Fe 3 O 4 foram adicionados ao poço com uma faixa de concentração de 0,01 a 0,2 mg mL −1 ; para o grupo de terapia fototérmica única, rGO @ Fe 3 O 4 foi adicionado com uma faixa de concentração de 0,01 a 0,2 mg mL −1 , e aplicando irradiação de luz NIR por 10 min (2 W cm −2 , 808 nm); para o grupo combinado de fototermal-quimioterapia, rGO @ Fe 3 O 4 / DOX foi adicionado com uma faixa de concentração de rGO @ Fe 3 O 4 / DOX de 0,01 a 0,2 mg mL −1 , e aplicando iluminação de luz NIR por 10 min (2 W cm −2 , 808 nm). As células continuaram incubadas por 24h ou 48h. Posteriormente, as células foram lavadas com PBS e incubadas em 100 μL de meio DMEM contendo 10 μL de solução de CCK-8 por mais 40 min. A viabilidade foi detectada usando um leitor de microplaca no comprimento de onda de 450 nm. Todas as experiências foram realizadas em triplicado.
Resultados e discussões
Caracterização de síntese e morfologia
A preparação de rGO @ Fe 3 O 4 microesferas foi realizada em três etapas. Em primeiro lugar, rGO-SiO 2 microesferas foram sintetizadas por secagem por pulverização usando SiO 2 como um modelo. A morfologia de rGO-SiO 2 as microesferas foram caracterizadas por SEM e TEM. Conforme mostrado na Fig. 1a, o rGO-SiO 2 microesferas com diâmetros de 3 μm exibiram forma esférica uniforme e compostas por muitos SiO 2 aglomerados nanopartículas (~ 300 nm). Os dados TEM e o diâmetro hidrodinâmico medido por espalhamento dinâmico de luz também confirmaram os resultados. (Fig. 1d, g). Em seguida, microesferas ocas de rGO foram obtidas removendo SiO 2 de rGO-SiO 2 com aquecimento a 300 ° C e corrosão HF. Poros óbvios com um tamanho de poro de cerca de 300 nm podem ser observados devido ao SiO 2 dissolução (Fig. 1b, e). Finalmente, Fe 3 O 4 em virtude da capacidade de direcionamento magnético, foi decorado no rGO poroso pelo método de coprecipitação. A observação de SEM e TEM ilustrou que a diminuição notável do tamanho dos poros após Fe 3 O 4 carga foi obtida, (Fig. 1c, f), proporcionando a viabilidade de entrega do medicamento e a liberação controlada do medicamento. Notavelmente, o tamanho de partícula e a distribuição hidrodinâmica do tamanho de rGO-SiO 2 , rGO, rGO @ Fe 3 O 4 não têm mais alterações visíveis durante esses tratamentos (Fig. 1g, h, i).
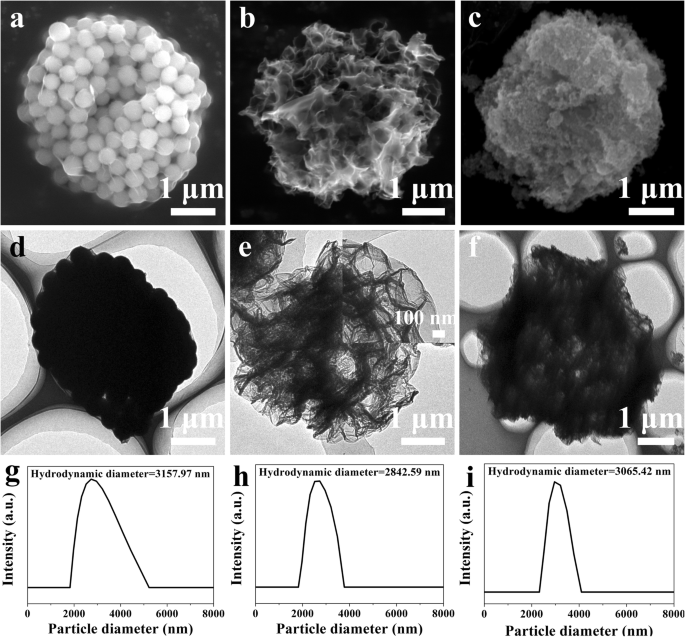
Caracterização morfológica de microesferas. Imagens SEM de ( a ) rGO-SiO 2 , ( b ) rGO, ( c ) rGO @ Fe 3 O 4 ; Imagens TEM de ( d ) rGO-SiO 2 , ( e ) rGO, ( f ) rGO @ Fe 3 O 4 ; distribuição hidrodinâmica do tamanho das amostras correspondentes ( g ) rGO-SiO 2 , ( h ) rGO, ( i ) rGO @ Fe 3 O 4
Caracterização da Estrutura e Composição
Para confirmar ainda mais a preparação bem-sucedida de rGO @ Fe 3 O 4 , SEM com EDS foi empregado para investigar a estrutura e composição das microesferas. As imagens EDS de rGO @ Fe 3 O 4 foram caracterizados por visualizar os elétrons dispersos inelasticamente nas janelas de perda de energia para O, Fe e C elementais, e as áreas de cores diferentes representam locais enriquecidos com O, Fe e C em estruturas reais, respectivamente. Conforme mostrado nas Fig. 2a e b, Fe e O foram amplamente distribuídos em rGO @ Fe 3 O 4 microesferas com alta densidade de carregamento. A Figura 2d confirmou que o Fe 3 O 4 nanopartículas dispersas uniformemente no rGO com um diâmetro de cerca de 18 nm, resultando em uma diminuição acentuada do tamanho dos poros em rGO @ Fe 3 O 4 microesferas. O padrão de difração de elétrons de área selecionada (SAED) verificou ainda mais a presença de Fe 3 O 4 em rGO (Fig. 2e), a ressonância característica em 2,98 nm, 2,53 nm, 2,09 nm, 1,62 nm e 1,49 nm de espaçamento de face atribuído aos planos 220, 311, 400, 511 e 440 da face centrada-cúbica fase de Fe 3 O 4 , respectivamente. Os picos apareceram em 220, 311, 400, 511 e 440 correspondendo a Fe 3 O 4 também foram detectados nos espectros de XRD, o que foi consistente com os resultados do SAED (Fig. 2c). No entanto, é relatado que Fe 3 O 4 e γ-Fe 2 O 3 não pode ser distinguido pelo padrão XRD independentemente para a mesma localização de picos característicos [35]. O resultado de XPS mostrou que os picos predominantes em 725,9 / 724,5 eV e 714,1 / 711,0 eV, correspondendo a Fe2p 1/2 e Fe 2p 3/2 do rGO @ Fe 3 O 4 (Fig. 2g, h), respectivamente, indicando a coexistência de Fe 3+ e Fe 2+ em Fe 3 O 4 [36]. A análise termogravimétrica (TGA) foi realizada para monitorar o comportamento de degradação térmica de rGO em rGO @ Fe 3 O 4 microesferas por aquecimento da amostra a 800 ° C e resfriamento até 100 ° C em uma atmosfera de ar (Fig. 2f). A curva de perda de massa mostrou duas regiões distintas de perda de massa, incluindo a região de desidratação (40-300 ° C) e a região de desvolatilização (300-800 ° C) de rGO em rGO @ Fe 3 O 4 , o teor de carbono calculado a partir da amostra era de 25,6% em peso.
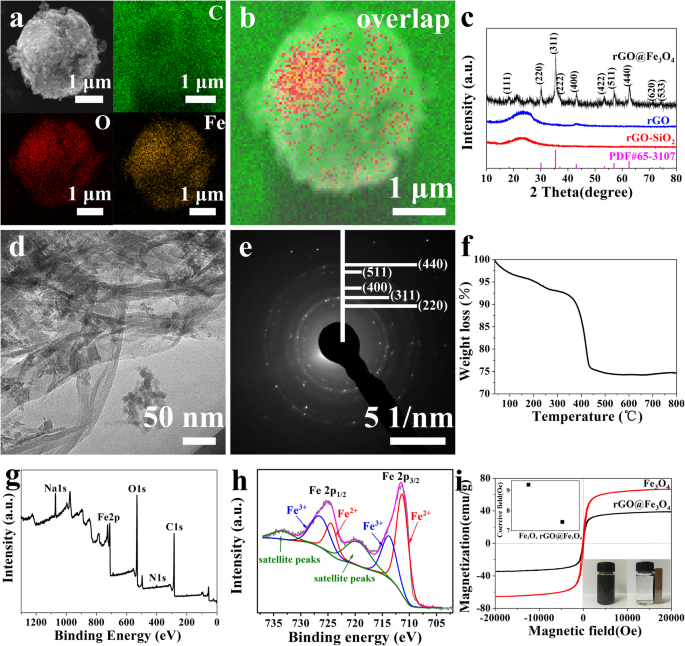
Caracterização da estrutura e composição de rGO @ Fe3O4. ( a , b ) SEM com imagens de mapeamento EDS de rGO @ Fe 3 O 4 microesferas:elementos C, Fe e O; ( c ) Padrões de XRD de rGO-SiO 2 , rGO e rGO @ Fe 3 O 4 microesferas; ( d , e ) Imagens SEAD de rGO @ Fe 3 O 4 microesferas; ( f ) Curvas TG de rGO @ Fe 3 O 4 microesferas; ( g , h ) Espectros XPS de rGO @ Fe 3 O 4 microesferas; ( eu ) Loops de histerese magnética do Fe 3 O 4 e rGO @ Fe 3 O 4 microesferas (a inserção do topo mostra os valores de campo coercivo (Hc) das amostras, e a inserção da parte inferior mostra suas suspensões antes e depois da separação magnética por um ímã externo)
As propriedades magnéticas de rGO @ Fe 3 O 4 microesferas foram investigadas usando um dispositivo de interferência quântica supercondutor. O campo magnético foi conduzido com uma faixa de varredura de -20.000 a 20.000 Oe em temperatura ambiente. A Figura 2i mostra o valor da magnetização de saturação (Ms) e o valor do campo coercivo (Hc) de Fe 3 O 4 são 66,6 emu g −1 e 9,3 Oe. Depois de carregar Fe 3 O 4 em rGO, o valor Ms e o valor Hc do rGO @ Fe 3 O 4 as microesferas diminuíram para 33,9 emu g −1 e 7,44 Oe. A diminuição notável da saturação magnética pode contribuir para as propriedades diamagnéticas de rGO em rGO @ Fe 3 O 4 microesferas. Além disso, a capacidade de aglomeração seletiva de rGO @ Fe 3 O 4 microesferas foi realizado intuitivamente por experiência de separação magnética. As suspensões do Fe 3 O 4 e rGO @ Fe 3 O 4 microesferas foram colocadas no frasco com um ímã externo por 2 min, as suspensões podem ser concentradas para o lado do ímã e a solução aquosa tornou-se transparente. Quando o ímã foi retirado, o rGO @ Fe 3 O 4 microesferas foram dispersas uniformemente novamente após agitação lenta, indicando que rGO @ Fe 3 O 4 microesferas com o mérito de boa capacidade de dispersão em água. A excelente capacidade de dispersão de água e propriedade de resposta magnética abriram caminho para a aplicação direcionada magnética de rGO @ Fe 3 O 4 como a droga carrega no tratamento do câncer.
Análise do efeito fototérmico
Considerando a penetração mais profunda no tecido e menos danos aos tecidos circundantes do NIR, a terapia fototérmica responsiva ao NIR foi frequentemente empregada para o tratamento do tumor. Conseqüentemente, o comportamento de transformação fototérmica de rGO @ Fe 3 O 4 soluções aquosas em diferentes concentrações e diferentes densidades de potência foram registradas sob irradiação com laser NIR a 808 nm por 5 min. A Figura 3a, b mostrou que o aumento da temperatura de rGO @ Fe 3 O 4 era altamente dependente da concentração e da densidade de potência do laser. Quando a concentração das microesferas era de até 1 mg mL −1 , a temperatura aumentou de 27,9 para 70,3 ° C sob irradiação de laser NIR por 5 min a 2 W cm −2 , enquanto a temperatura para o grupo PBS subiu apenas de 31,7 para 36,2 ° C. A alta eficiência de conversão fototérmica de rGO @ Fe 3 O 4 terá um grande potencial para terapia fototérmica tumoral de acordo com relato anterior de que degeneração de proteínas e danos ao DNA em células acontecerão (acontecerão) após exposição a 50 ° C por 4 a 6 min [21, 37]. Para exibir intuitivamente o comportamento de transformação fototérmica de rGO @ Fe 3 O 4 , A termografia IV foi realizada e os resultados foram mostrados na Fig. 4c. O rGO @ Fe 3 O 4 solução com a concentração de 1 mg mL −1 foi rapidamente aumentado para 70,3 ° C após a irradiação NIR por 5 min, enquanto o grupo da água não apresentou alterações óbvias, o que foi consistente com os resultados da termometria. Além disso, a estabilidade fototérmica do rGO @ Fe 3 O 4 foi estudado realizando o procedimento de ativação / desativação do laser com um laser de 808 nm a 2 W cm −2 por seis ciclos (Fig. 3d). O aumento de temperatura idêntico foi obtido, indicando a estabilidade fototérmica NIR perfeita de rGO @ Fe 3 O 4 compósitos. Esses resultados demonstraram que rGO @ Fe 3 O 4 microesferas que são uma grande promessa como um agente fototérmico para terapia fototérmica no câncer.
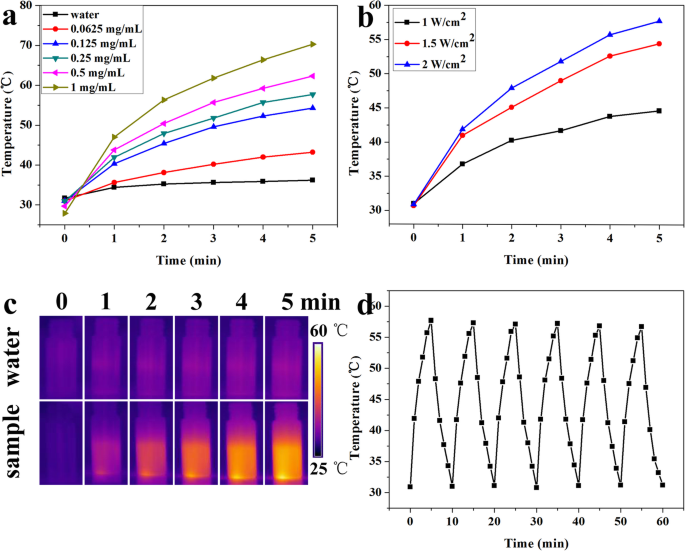
Efeitos fototérmicos de rGO @ Fe3O4. a Mudança de temperatura dependente da concentração de rGO @ Fe 3 O 4 soluções em diferentes concentrações (0,0625, 0,125, 0,25, 0,5 e 1 mg mL −1 ) sob irradiação de 808 nm a 2 W cm −2 por 5 min. b Resposta de temperatura dependente de energia de 0,25 mg mL −1 rGO @ Fe 3 O 4 solução sob a irradiação de um laser NIR de 808 nm por 5 min (1 W cm −2 , 1,5 W cm −2 , 2 W cm −2 ) c Imagens térmicas infravermelhas de rGO @ Fe 3 O 4 solução em intervalos de 0, 1, 2, 3, 4 e 5 min estimulados a 808 nm (2 W cm −2 ) d Aumentos de temperatura de rGO @ Fe 3 O 4 (0,25 mg mL −1 ) solução durante 6 ciclos sucessivos de ativação / desativação do laser sob irradiação de 808 nm a 2 W cm −2
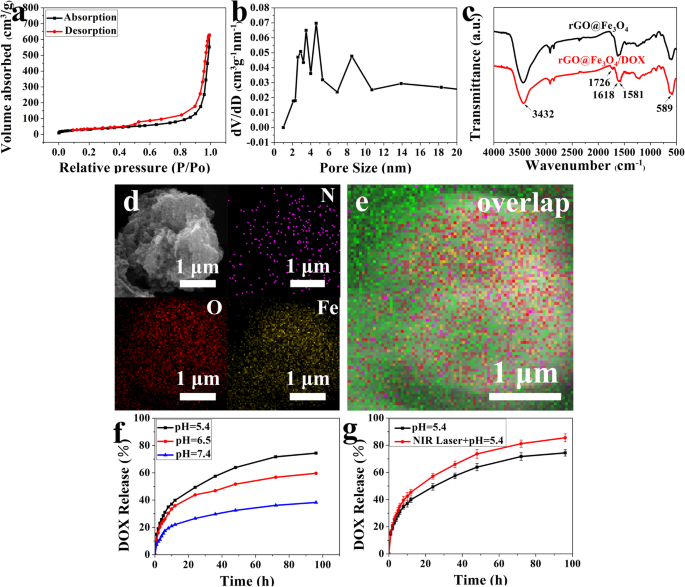
A área de superfície e o tamanho dos poros das microesferas rGO @ Fe3O4, carregamento de DOX e comportamentos de liberação. a Isotermas de adsorção-dessorção de nitrogênio de rGO @ Fe 3 O 4 . b Distribuição de tamanho de poro de rGO @ Fe 3 O 4 . c Espectros FTIR de rGO @ Fe 3 O 4 e rGO @ Fe 3 O 4 / DOX. d , e SEM e imagens de mapeamento de N, Fe e O de rGO @ Fe 3 O 4 / DOX microesferas. f Curvas cinéticas de liberação de drogas obtidas em diferentes valores de pH de rGO @ Fe 3 O 4 microesferas. g Curvas cinéticas de liberação DOX responsivas a NIR
Carregamento e liberação de drogas
A área de superfície e o tamanho dos poros de rGO @ Fe 3 O 4 foram avaliados por análises BET e BJH (Fig. 2a, b). N 2 O tipo de curva de adsorção-dessorção era do tipo IV isotérmico, e a área de superfície e o tamanho dos poros eram 120,7 m 2 g −1 , 2-8 nm e 1,012 cm 3 g −1 , respectivamente. Os resultados mostraram que rGO @ Fe 3 O 4 possuía canais mesoporosos e distribuição média de tamanho de poro, exibindo grande potencial para carga de fármaco antitumoral. Então, o rGO @ Fe 3 O 4 microesferas com estrutura porosa foram servidas para carregar um modelo de droga quimioterápica doxorrubicina simplesmente misturando e levemente sonicação. A análise ATR-FTIR verificou ainda a incorporação estável de DOX em rGO @ Fe 3 O 4 devido à ressonância característica de grupos -COOH e benzeno de DOX em 1726 cm −1 e 1618 cm −1 (Fig. 4c). A observação de microscopia eletrônica de varredura (SEM) mostrou que os novos sinais de N elementos atribuídos a DOX se distribuíram uniformemente na microesfera após o carregamento de DOX (Fig. 4d, e). Além disso, a eficiência de carregamento DOX (LE) e capacidade de carregamento (LC) de rGO @ Fe 3 O 4 / DOX foram 92,15% e 18,43%, respectivamente. Os LCs incrivelmente mais altos de rGO @ Fe 3 O 4 / DOX do que muitos portadores de drogas pode contribuir para áreas de superfície extremamente altas e tamanhos de poros [19]. O LE alto de rGO @ Fe 3 O 4 / DOX pode ser atribuído a dois aspectos, um é que rGO @ Fe 3 O 4 pode interagir com DOX por forte empilhamento π – π entre ligações π hibridizadas com sp2 de rGO @ Fe 3 O 4 e a porção de quinino de DOX [21], e outro pode ser que eles podem formar ligações de hidrogênio entre os grupos de ácido carboxílico (–COOH), hidroxil (–OH) de rGO @ Fe 3 O 4 e a amina (–NH 2 ), grupos hidroxil (-OH) de DOX. Em seguida, monitoramos o comportamento de liberação de DOX em PBS em pH 7,4, 6,5 e 5,4, para imitar os ambientes extracelulares de tecidos tumorais e normais. Conforme indicado na Fig. 4f, a taxa de liberação de DOX foi acelerada quando o pH foi ajustado de 7,4 para 5,4, e a liberação sustentada de DOX em pH 5,4 pode ser de até 73% após 98 h de tratamento. Portanto, o perfil de liberação cumulativa de DOX de rGO @ Fe 3 O 4 exibiu uma maneira dependente do pH. Esta liberação acelerada em condições ácidas pode ser devido à protonação parcial dos grupos hidroxila e amina do DOX, levando a uma maior solubilidade do fármaco e enfraquecimento das ligações de hidrogênio entre DOX e grafeno [38]. Além disso, também estudamos o comportamento de liberação de DOX responsivo a NIR in vitro. Conforme indicado na Fig. 4g, a liberação de DOX foi acelerada pela radiação NIR e a taxa de liberação de DOX foi de até 85%. Este comportamento responsivo a estímulos de pH e NIR desempenha um papel importante na entrega eficaz do medicamento para o local do tumor.
Captação de células in vitro
Para verificar a capacidade de direcionamento magnético de Fe 3 O 4 em rGO @ Fe 3 O 4 microesfera, os experimentos de captação celular com ou sem tratamento de campo magnético foram investigados qualitativamente por microscopia confocal de varredura a laser (CLSM). As células Hela foram incubadas com rGO @ Fe 3 O 4 / DOX por 4 he os núcleos de Hela foram corados por DAPI. Os resultados na Fig. 5 mostraram que a mancha preta correspondente a rGO @ Fe 3 O 4 microesfera e sinais de fluorescência vermelha intracelular óbvios atribuídos a DOX foram observados no rGO @ Fe 3 O 4 grupo com um tratamento de campo magnético. Em contraste, houve menos manchas pretas e fluorescência DOX mais fraca pode ser encontrada quando rGO @ Fe 3 O 4 grupo sem carregamento de campo magnético. A explicação pode ser que o ponto preto atribuído a rGO @ Fe 3 O O4 internalizado na célula pode ser promovido por ímã. Os resultados indicam que Fe3O4 em rGO @ Fe 3 O4 / DOX pode ter como alvo específico as células Hela de forma eficiente e aumentar significativamente a internalização celular de microesferas, demonstrando a capacidade de direcionamento magnético favorável do sistema de distribuição de drogas na terapia do câncer.
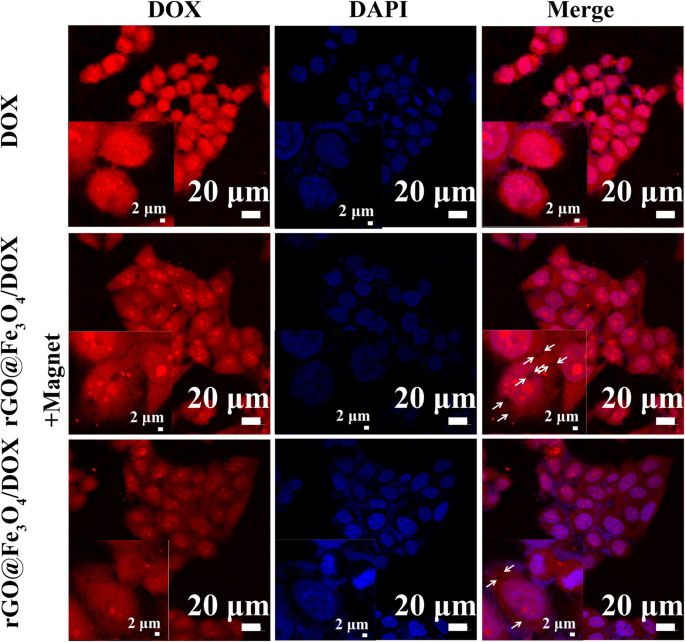
Avaliação do alvo magnético de microesferas rGO @ Fe3O4-DOX. Imagens CLSM de rGO @ Fe 3 O 4 / DOX incubou células HeLa com e sem ímã (as inserções mostram a imagem em alta ampliação)
Análises de citotoxicidade in vitro
A biocompatibilidade de rGO @ Fe 3 O 4 foi avaliada usando o ensaio CCK-8 para células Hela. Conforme mostrado na Fig. 6a, após incubação com rGO @ Fe 3 O 4 em uma ampla faixa de diferentes concentrações, a viabilidade celular também era superior a 90%, mesmo em altas concentrações de até 200 μg mL −1 , os resultados indicaram que rGO @ Fe 3 O 4 exibe uma alta biocompatibilidade e pode ser servido como uma plataforma de entrega de drogas eficiente. A eficácia da terapia fototérmica de rGO @ Fe 3 O 4 foi investigado posteriormente após incubação com células Hela por 24 he 48 h sob irradiação de luz NIR (laser NIR de 808 nm, 10 min). Como mostrado na Fig. 6b, a fototoxicidade era claramente dependente da dose da estimulação NIR e a viabilidade celular diminuiu de 90,37 para 35,52% em 24 h, e de 93,77 para 31,75% em 48 h, implicando que rGO @ Fe 3 O 4 teve excelente fototoxicidade e é uma grande promessa na terapia fototérmica. Para estimar a eficácia terapêutica sinérgica da quimioterapia fototérmica, a citotoxicidade de rGO @ Fe 3 O 4 / DOX para células Hela com e sem irradiação NIR foram estudados. Conforme mostrado na Fig. 6c, d, a viabilidade celular mostrou forma dependente da concentração e controlada pelo tempo. Aproximadamente 65% e 80% das células Hela foram mortas por rGO @ Fe 3 O 4 / DOX sem irradiação NIR e DOX em 24 h, a diminuição da capacidade de matar o tumor de rGO @ Fe 3 O 4 / DOX em comparação com DOX livre pode ser devido ao comportamento de lançamento de DOX atrasado de rGO @ Fe 3 O 4 / DOX microesferas. Após a irradiação do laser NIR (laser NIR de 808 nm, 10 min), rGO @ Fe 3 O 4 / DOX com grupo de laser matou mais de 86% das células com uma dose equivalente de DOX (30 μg mL −1 ) Resultados semelhantes puderam ser observados após as mesmas células de tratamento por 48 h, a diminuição na viabilidade celular de DOX, rGO @ Fe 3 O 4 / DOX, rGO @ Fe 3 O 4 / DOX com grupo de irradiação NIR foi de 80%, 76% e 90%, respectivamente, indicando um efeito sinérgico da terapia fototérmica combinada e quimioterapia.
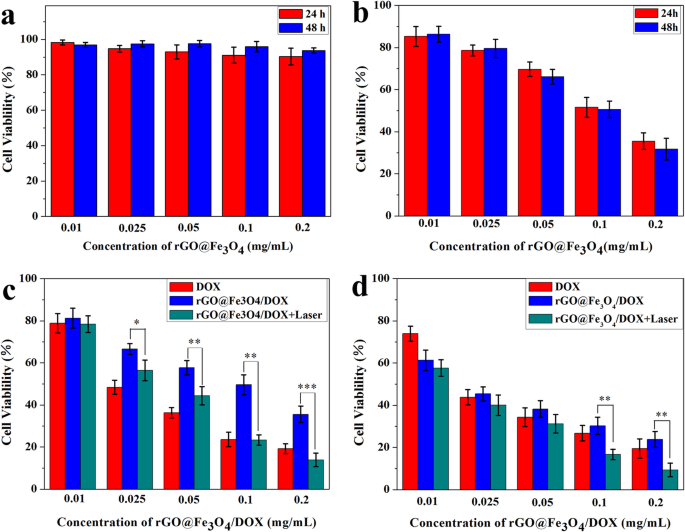
The biocompatibility and the therapeutic efficacy of single photothermal therapy or combined photothermal-chemotherapy. a Cell viability of Hela cells cultured with rGO@Fe3 O 4 for 24 h and 48 h. b Cell viability of Hela cells cultured with or without NIR irradiation at different concentrations of rGO@Fe3 O 4 for 24 h and 48 h. ( c , d ) Cell viability of Hela cells cultured with free DOX, rGO@Fe3 O 4 /DOX microspheres for 24 h and 48 h with and without NIR irradiation (808 nm, 2 W cm −2 ) (*p <0.05, **p <0.01, ***p <0.001)
Conclusions
In summary, we explored a facile strategy to construct rGO-based drug delivery platform rGO@Fe3 O 4 /DOX for synergistic photothermal-chemotherapy. rGO@Fe3 O 4 /DOX microsphere exhibited excellent NIR-triggered PTT effect and perfect NIR photothermal stability. The Fe 3 O 4 on the microspheres ensured excellent tumor cells targeting ability. DOX could be encapsulated into rGO@Fe3 O 4 with an ultrahigh drug-loading capacity and a pH-responsive drug release behavior could be simultaneously achieved. In addition, an enhanced antitumor efficiency was achieved when a combination of chemotherapy and photothermal therapy. Therefore, this multifunctional drug delivery platform could be a promising candidate for tumor targeting and combinatorial cancer therapy in the future.
Disponibilidade de dados e materiais
The data and the analysis in the current work are available from the corresponding authors on reasonable request.
Abreviações
- DDS:
-
Sistema de entrega de drogas
- NIR:
-
Próximo ao infravermelho
- GO:
-
Óxido de grafeno
- DOX:
-
Doxorrubicina
- DMEM:
-
Dulbecco’s minimum essential medium
- DAPI:
-
4',6-diamidino-2-phenylindole
- CCK-8:
-
Cell counting kit-8
- SEM:
-
Microscopia eletrônica de varredura
- TEM:
-
Microscopia eletrônica de transmissão
- XRD:
-
Sistema de difração de raios X
- XPS:
-
espectroscopia de fotoelétrons de raios-X
- FTIR:
-
Espectroscopia de infravermelho com transformada de Fourier
- TGA:
-
Thermogravimetric analyzer
- LE:
-
Loading efficiency
- LC:
-
Loading capacity
Nanomateriais
- Nanofibras e filamentos para entrega aprimorada de drogas
- Nanopartículas para terapia do câncer:progresso e desafios atuais
- Estruturas Metálicas-Orgânicas de Meio Ambiente como Sistema de Administração de Medicamentos para Terapia de Tumor
- Nanopartículas lipídicas de PLGA rastreadas com 131I como transportadores de administração de drogas para o tratamento quimioterápico direcionado do melanoma
- Nanopartículas de albumina carregadas de resveratrol com circulação sanguínea prolongada e biocompatibilidade aprimorada para terapia de tumor pancreático direcionada altamente eficaz
- Nanomontagens de ácido 5-aminolevulínico-esqualeno para fotodetecção e terapia de tumor:estudos in vitro
- Nanobastões de ouro modificados com sílica conjugada com anticorpo para o diagnóstico e terapia fototérmica de Cryptococcus neoformans:um experimento in vitro
- Uma abordagem fácil para a preparação de óxido de zinco de tamanho nanométrico em água / glicerol com fontes de zinco extremamente concentradas
- Maneiras de resistir à tempestade econômica e se preparar para o crescimento
- A abordagem de segurança de gás e chama para a indústria de geração de energia



