Nanocristal Sb2O3 dopado com S:um catalisador de luz visível eficiente para degradação orgânica
Resumo
O Sb dopado com S 2 O 3 nanocristais foram sintetizados com sucesso usando SbCl 3 e tioacetamida (TAA) como precursores por meio de um método hidrotérmico fácil de uma etapa. Os efeitos do pH da solução de reação do precursor sobre a composição e propriedade do produto foram determinados. Os resultados indicaram que a quantidade de dopagem de S poderia ser ajustada ajustando o pH da solução precursora. Além disso, o S entrou no site intersticial de Sb 2 O 3 cristais como S 2− , que ampliou a faixa de comprimento de onda de absorção do Sb 2 O 3 nanocristal. O Sb dopado com S 2 O 3 exibiu uma excelente atividade fotocatalítica conduzida pela luz visível na decomposição de laranja de metila e 4-fenilazofenol. Por último, um possível mecanismo fotocatalítico do Sb dopado com S 2 O 3 sob irradiação de luz visível foi proposto.
Histórico
A oxidação fotocatalítica de semicondutores é uma técnica de purificação ambiental ideal devido à sua utilização de energia solar, alta estabilidade e não toxicidade. Pode efetivamente remover poluentes orgânicos, mesmo em concentrações extremamente baixas, sem causar qualquer poluição secundária [1,2,3,4,5,6]. Entre vários tipos de fotocatalisadores semicondutores, TiO 2 é amplamente investigado devido ao seu excelente desempenho sob irradiação UV na mineralização de uma variedade de compostos orgânicos. No entanto, a estreita lacuna de banda do TiO 2 (3,2 eV) limita sua eficiência de utilização da energia solar [7, 8]. Portanto, o desenvolvimento de novos fotocatalisadores acionados por luz visível é de grande importância na purificação ambiental.
Atualmente, os fotocatalisadores acionados por luz visível podem ser preparados por meio de duas estratégias principais:uma é desenvolver novos fotocatalisadores monofásicos, como CdS, Sn 2 Nb 2 O 7 , CaBi 2 O 4 , BiWO 4 e SnIn 4 S 8 [9,10,11,12,13], e a outra é modificar os fotocatalisadores UV-ativos. A modificação pode ser realizada por dopagem de elementos estranhos, acoplando fotocatalisadores ativos em UV com semicondutores de banda estreita, bem como formando hibridização inorgânico-orgânica [14,15,16,17,18,19,20,21,22,23, 24,25,26,27,28,29,30]. Enxofre (S), um elemento não metálico, é geralmente usado para dopar semicondutores de gap de banda larga, como TiO 2 [18,19,20], In (OH) 3 [21] e Zn 2 SnO 4 [22], para obter os fotocatalisadores de luz visível desejados. No entanto, a condição de dopagem pode afetar significativamente o estado de valência e a forma de S nos produtos, resultando em várias atividades fotocatalíticas. Por exemplo, Umebayashi et al. preparou o TiO dopado com S 2 pelo recozimento por oxidação de TiS 2 , onde os átomos de S ocuparam os sítios de átomos de O em TiO 2 para formar ligações Ti – S [18]. Ohno et al. alcóxido de titânio hidrolisado na presença de tioureia e o produto da hidrólise foi calcinado ao ar para proporcionar S 4+ e S 6+ TiO substituído 2 [19]. Devi et al. preparou o TiO dopado com S 2 por um método sol-gel usando pó de enxofre como fonte de S. Eles descobriram que S 6+ foi incorporado ao Ti 4+ rede do TiO 2 cristal [20]. Zn dopado com ânion 2 SnO 4 foi preparado pela calcinação da mistura de tioureia e espinélio Zn 2 SnO 4 sob atmosfera de argônio, durante a qual S 2− íon entrou no site intersticial de Zn 2 SnO 4 cristal [22].
Os óxidos e óxidos complexos de antimônio de metal do bloco p, como Sb 2 O 3 [31], M 2 Sb 2 O 7 (M =Ca e Sr) [32, 33], NaSbO 3 [32], Sr 1,36 Sb 2 O 6 [34], ZnSb 2 O 6 [35] e GaSbO 4 [36], possuem estruturas cristalinas únicas e estruturas eletrônicas que podem promover a separação de cargas fotogeradas e reduzir a recombinação de elétrons e lacunas fotogeradas e, portanto, têm atraído atenção considerável como novos materiais fotocatalíticos. No entanto, a maioria deles responde apenas à luz ultravioleta, o que limita suas futuras aplicações. No presente trabalho, S 2− -dopado Sb 2 O 3 nanocristal foi preparado usando SbCl 3 e tioacetamida (TAA) como fonte de enxofre por um método de síntese hidrotérmica. Os efeitos do doping S na atividade fotocatalítica induzida pela luz visível de Sb 2 O 3 para a degradação de laranja de metila (MO) e 4-fenilazofenol também foram avaliados. Os resultados indicaram que o S 2− o doping foi capaz de reduzir efetivamente a lacuna de banda de Sb 2 O 3 e, assim, melhorou a atividade fotocatalítica conduzida pela luz visível do Sb 2 O 3 . Nosso trabalho forneceu uma rota de síntese viável dos fotocatalisadores de óxido composto Sb dopado com S dopado com luz visível para a utilização eficiente da energia solar.
Métodos
Síntese de S-dopado com Sb 2 O 3 Nanocristais
Todos os produtos químicos usados neste trabalho foram adquiridos do reagente Aladdin e usados diretamente. O Sb dopado com S 2 O 3 nanocristais foram sintetizados por um método hidrotérmico usando SbCl 3 e tioacetamida (TAA) como precursores. Resumidamente, 3 mmol SbCl 3 foi adicionado a um reator autoclave de aço inoxidável revestido de Teflon de 100 mL contendo 70 mL de água desionizada e agitado mecanicamente durante 15 min. Em seguida, 4 mmol de TAA foram adicionados à solução misturada sob agitação constante. O pH da solução precursora foi ajustado para 2, 5, 10, 12 e 14 usando solução de HCl ou NaOH. A solução precursora foi aquecida a 120 ° C em um forno por 12 h. O precipitado produzido foi lavado várias vezes com água destilada e etanol absoluto e seco ao ar a 70 ° C. Os produtos obtidos em diferentes pH foram denotados como Sb 2 O 3 -S-pH (pH =2, 5, 10, 12 e 14). O puro Sb 2 O 3 foi preparado na ausência de TAA usando o procedimento semelhante. Resumidamente, 3 mmol SbCl 3 foi dissolvido em 50 mL de água desionizada e 20 mL de etanol absoluto em um reator autoclave de aço inoxidável revestido de Teflon de 100 mL sob agitação vigorosa e aquecido a 120 ° C por 12 h. O precipitado produzido foi lavado várias vezes com água destilada e etanol absoluto. Os produtos obtidos foram obtidos após secagem a 70 ° C.
Caracterização do material
Os padrões de difração de raios-X de pó (XRD) do Sb conforme preparado 2 O 3 os nanocristais foram registrados em um difratômetro de raios-X Bruker D8 Advance usando CuK α radiação operada na tensão de aceleração de 40 kV e a corrente aplicada de 40 mA. Os espectros de reatância difusa ultravioleta-visível (UV-vis DRS) foram coletados em um espectrômetro de UV-vis (Cary 500 Scan Spectrophotometer, Varian, EUA) usando BaSO 4 como o padrão de refletância. As imagens de microscopia eletrônica de transmissão (TEM) e microscopia eletrônica de transmissão de alta resolução (HRTEM) foram capturadas usando um instrumento JEOL modelo JEM 2010 EX operado na tensão de aceleração de 200 kV. Os espectros de fotoelétrons de raios-X (XPS) foram registrados em um sistema PHI Quantum 2000 XPS equipado com um Al K monocromático α fonte e um neutralizador de carga. O pó da amostra foi disperso ultrassonicamente em etanol, e uma gota da suspensão foi derramada sobre um filme de carbono revestido em uma grade de cobre de malha fina de 3 mm de diâmetro. O pico C 1s em 284,8 eV do carbono adventício da superfície foi usado como referência para todas as energias de ligação. Os espectros de espalhamento Raman foram obtidos usando um microscópio Renishaw inVia Raman em temperatura ambiente.
Medições de atividade fotocatalítica
A atividade fotocatalítica das amostras foi realizada em um vaso de fotorreação. Uma lâmpada de halogênio de 500 W (Philips Electronics) foi posicionada ao lado do vaso de reação cilíndrico com um lado plano como fonte de luz visível. Dois filtros de corte de 420 e 800 nm foram colocados entre a lâmpada e o vaso para garantir que apenas a luz visível passasse para atingir o vaso. O recipiente foi mantido à temperatura ambiente por circulação de água. O fotocatalisador (80 mg) foi pulverizado e adicionado ao recipiente contendo 80 mL 3 × 10 −5 mol L −1 MO ou p -hidroxiazobenzeno (1,2 × 10 −4 mol L −1 ) solução aquosa. A mistura foi agitada no escuro por 1 h para atingir o equilíbrio de adsorção / dessorção no fotocatalisador e então exposta à luz visível. Uma suspensão de 4 mL foi retirada em certos intervalos de tempo e centrifugada. O sobrenadante foi coletado e medido com um espectrofotômetro Shimadzu UV-1750 UV-Vis-NIR. A absorbância na absorção máxima foi registrada.
Resultados e discussão
Os padrões de XRD do controle Sb 2 O 3 e Sb 2 O 3 -S-pH (pH =2, 5, 10, 12 e 14) são mostrados na Fig. 1. Todos os picos da amostra de controle e Sb 2 O 3 -S-pH (pH =10, 12 e 14) foram indexados para Sb 2 O 3 (Cartão JCPDS 11-0689). Os baixos pHs (2 e 5) da solução precursora diminuíram a cristalinidade do produto e causaram a formação de fases impuras. Estas observações indicaram que o pH da solução precursora pode afetar significativamente a composição dos produtos, e o Sb puro 2 O 3 fase só pode ser obtida em condições alcalinas. As intensidades de todos os picos de XRD característicos de Sb 2 O 3 foram maiores do que aqueles de Sb 2 O 3 -S-pH (pH =10, 12 e 14), indicando que TAA inibiu o crescimento de Sb 2 O 3 cristalite.
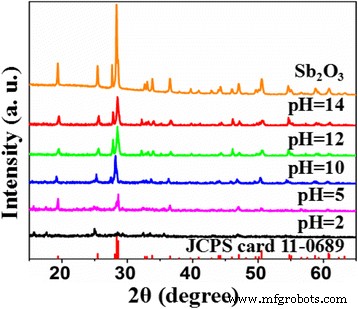
Padrões de XRD de Sb 2 O 3 e Sb dopado com S 2 O 3 sintetizado em vários pHs (pH =2, 5, 10, 12 e 14)
A Figura 2 mostra os espectros de refletância difusa de UV-vis de Sb 2 O 3 e Sb 2 O 3 -S-pH (pH =10, 12 e 14). A absorção máxima de Sb 2 O 3 apareceu em ca. 380 nm, sugerindo que Sb 2 O 3 respondeu apenas à irradiação UV. Comparado com o do Sb 2 puro O 3 , as transições de intervalo de banda de Sb 2 O 3 -S-pH (pH =10, 12 e 14) exibiu desvios para o vermelho óbvios, e o desvio para o vermelho aumentou com o aumento do pH da solução precursora. Portanto, é razoável acreditar que o estreitamento do gap foi atribuído predominantemente ao doping S. Os estados S 3p se misturaram com a banda de valência (VB), o que aumentou a largura da VB e diminuiu o deslocamento de energia na absorção óptica [18]. É bem conhecido que TAA pode ser hidrolisado para gerar S 2− em uma solução alcalina e o aumento do pH pode promover a produção de S 2− . Portanto, os aumentos no redshift da transição band-gap com o pH da solução do precursor podem ser atribuídos às maiores quantidades de S dopado em Sb 2 O 3 em pHs mais elevados. Portanto, a quantidade de dopagem de S pode ser controlada simplesmente ajustando o pH da solução precursora.
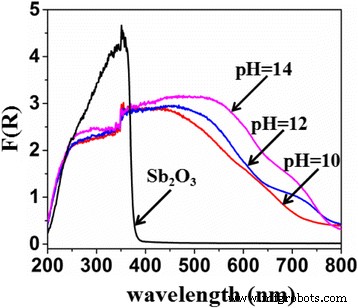
Espectro de absorção de refletância difusa de Sb 2 O 3 e Sb 2 O 3 -S-pH (pH =10, 12 e 14)
TEM foi feito para identificar a morfologia e estrutura cristalina de Sb dopado com S 2 O 3 . Conforme mostrado na Fig. 3a, o Sb 2 O 3 -S-12 era em forma de bastonete com um diâmetro de ~ 40 nm e comprimento variando de 100 a 200 nm. A imagem HRTEM revelou que os nanobastões eram compostos por muitas nanopartículas montadas aleatoriamente com um diâmetro médio de ~ 5 nm (Fig. 3b). Padrões claros de difração com distâncias interplanares de 0,25 e 0,27 nm foram observados nas imagens HRTEM, que podem ser atribuídos aos planos (200) e (131) de Sb 2 O 3 , respectivamente. A análise EDS (Fig. 3c) revelou que os elementos Sb, O e S existiam nas amostras, indicando que o Sb dopado com S 2 O 3 foi preparado com sucesso.

a TEM. b Imagens HRTEM e c Espectro EDS de Sb 2 O 3 -S-12
Os espectros XPS e Sb 3d de alta resolução e os espectros O 1s XPS de Sb 2 O 3 e Sb 2 O 3 -S-pH (pH =10 e 12) são exibidos na Fig. 4a. O pico Sb 3d 3/2 de Sb 2 O 3 apareceu em 539,8 eV e o pico em 530,5 eV foram atribuídos a Sb 3d 5/2 e O 1s, sugerindo que o estado de oxidação de Sb é + 3 em vez de + 5 com energias de ligação ligeiramente mais altas [37, 38]. O doping S reduziu as energias de ligação do Sb 3d, porém não apresentou efeitos significativos no estado químico do Sb. Esses resultados indicaram que o doping S alterou os ambientes químicos dos íons Sb e aumentou as densidades eletrônicas em torno dos íons Sb devido à menor eletronegatividade do S [39]. Comparado com Sb 2 O 3 -S-10, Sb 2 O 3 -S-12 continha mais S. A densidade de elétrons em torno de seu Sb era maior do que a de Sb 2 O 3 -S-10 e, portanto, a energia de ligação Sb 3d de Sb 2 O 3 -S-12 mudou para a direção de baixa energia. Os espectros de XPS de alta resolução S 2p na Fig. 4b revelaram dois picos em 161,5 e 162,7 eV que foram atribuídos a S 2− [22, 40, 41]. O raio de S 2− (184 pm) é muito maior do que O 2− (132 pm). Portanto, era difícil para S 2− para substituir o O 2− em Sb 2 O 3 [22, 42]. É mais provável que S 2− inserido no site intersticial do Sb 2 O 3 cristal [18]. A análise XPS indicou que Sb 2 O 3 -S-12 continha mais S do que Sb 2 O 3 -S-10, confirmando ainda que o pH da solução precursora pode ser usado para controlar a quantidade de dopagem S.
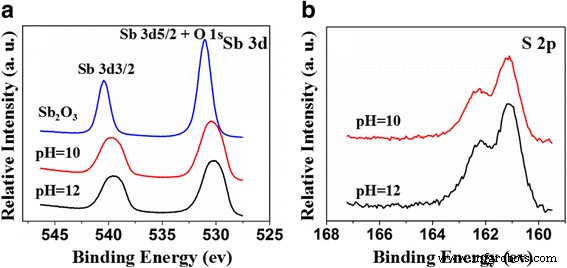
Espectros XPS de Sb 2 O 3 e Sb 2 O 3 -S-pH (pH =10 e 12). a Sb 3d. b S 2p
A Figura 5 mostra os espectros Raman do Sb 2 O 3 e Sb 2 O 3 -S-12. Sb 2 O 3 exibiu sinal em 216, 257, 293, 442, 498, 593 e 680 cm −1 . Um novo pico apareceu em 1440 cm −1 no espectro de Sb 2 O 3 -S-12, que pode ser o resultado do doping S. Além disso, em comparação com os picos de Sb 2 O 3 , a largura do pico dos picos de Sb 2 O 3 -S-12 aumentou e a simetria de seus formatos de pico diminuiu, indicando que o doping S aumentou os defeitos internos [43]. O S dopou no site intersticial de Sb 2 O 3 cristais causaram a deformação da rede.
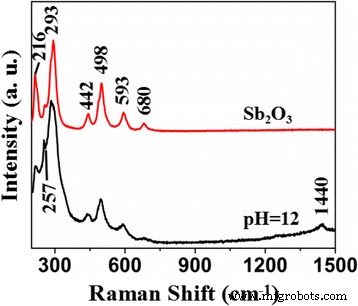
Espectros Raman de Sb 2 O 3 e Sb 2 O 3 -S-12
As atividades fotocatalíticas conduzidas por luz visível de Sb puro e dopado com S 2 O 3 para a degradação de MO foram determinados. As mudanças temporais na concentração de MO foram monitoradas medindo-se a absorção de UV-vis da solução de MO no fotocatalisador a 464 nm (Fig. 6a). MO parece muito estável sob luz visível com quase nenhuma degradação. Desde o Sb 2 O 3 não pôde ser excitado sob luz visível, a degradação de MO foi insignificante na presença de Sb 2 O 3 . A dopagem com certa quantidade de S aumentaria a absorção de luz visível, aumentaria os defeitos internos e promoveria a taxa de separação dos pares elétron-buraco fotogerados. Como resultado, a atividade fotocatalítica conduzida por luz visível das amostras pode ser melhorada, o que pode ser demonstrado pelo Sb dopado com S 2 O 3 . É digno de nota que as atividades fotocatalíticas do Sb dopado com S 2 O 3 preparados em diferentes pHs eram diferentes. Sb 2 O 3 -S-10 exibiu a menor atividade fotocatalítica dirigida por luz visível. Pode ser explicado que a hidrólise do TAA em condições alcalinas fracas é fraca, produzindo menos S 2− . O Sb 2 O 3 -S-14 com mais S produzido sob forte condição alcalina exibe uma atividade fotocatalítica mais baixa em comparação com o Sb 2 O 3 -S-12 com relativamente menos S, o que pode ser atribuído ao excesso de dopagem S causando muitos defeitos que eram os centros de recombinação do par elétron-buraco fotogerado. Em comparação com as contrapartes, Sb 2 O 3 -S-12 exibiu a maior atividade fotocatalítica conduzida por luz visível e foi capaz de degradar 99,2% MO em 40 min sob irradiação de luz visível. A Figura 6b mostra os padrões espectrais de absorção temporal de MO durante a fotodegradação sobre Sb 2 O 3 -S-12. A absorção de MO foi em 464 nm, o que foi atribuído à sua unidade –N =N–. A intensidade de absorção diminuiu conforme a irradiação de luz visível prosseguia, indicando que as ligações duplas –N =N– foram gradualmente decompostas [44].
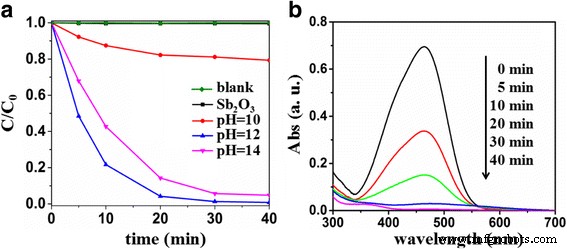
a Mudanças temporais de concentração de MO monitoradas pelos espectros de absorção de UV-vis em 464 nm em Sb 2 O 3 e Sb 2 O 3 -S-pH (pH =10, 12 e 14). b Padrões espectrais de absorção temporal de MO durante o processo de fotodegradação sobre Sb 2 O 3 -S-12
O desempenho fotocatalítico de Sb 2 O 3 -S-12 para a degradação de p-hidroxiazobenzeno também foi determinado. A Figura 7a, b apresenta a atividade fotocatalítica de Sb 2 O 3 -S-12 para a degradação de p-hidroxibenzobenzeno e os espectros de absorção UV-vis correspondentes de p-hidroxibenzobenzeno durante a degradação. Nenhuma degradação de p-hidroxiazobenzeno foi observada sob a irradiação de luz visível na ausência de Sb 2 O 3 -S-12. Em contraste, 94,3% do p-hidroxiazobenzeno foi degradado sob a irradiação de luz visível por 150 min na presença de Sb 2 O 3 -S-12. Além disso, a absorção de p-hidroxibenzobenzeno a 347 nm diminuiu com o prolongamento da irradiação. Estes resultados indicaram que Sb dopado com S 2 O 3 poderia ser implementado na degradação de diferentes poluentes.
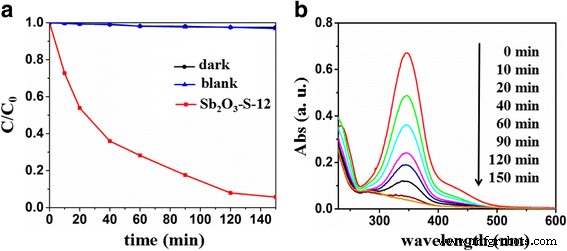
a Mudanças temporais da concentração de 4-fenilazofenol conforme monitorado pelo espectro de absorção de UV-vis a 347 nm em Sb 2 O 3 -S-12. b Padrões espectrais de absorção temporal de 4-fenilazofenol durante o processo de fotodegradação em Sb 2 O 3 -S-12
Para explorar o mecanismo fotocatalítico do Sb dopado com S 2 O 3 nanocristais, as principais espécies oxidativas na reação fotocatalítica foram capturados usando p -benzoquinona (BZQ, um O 2 - · Eliminador de radicais), dissódio etileno diamina tetraacetato (Na 2 -EDTA, um eliminador de buraco) e terc-butanol (t-BuOH, um eliminador de radical OH ·) [39, 45]. Como mostrado na Fig. 8, a adição de t-BuOH não mostrou nenhum efeito deletério na atividade fotocatalítica de Sb 2 O 3 -S-12 e a presença de BZQ ou Na 2 -EDTA desacelerou significativamente sua eficiência de degradação fotocatalítica de MO e 4-fenilazofenol. Portanto, pode-se concluir que h + e O 2 - · Os radicais foram as espécies oxidativas dominantes do Sb dopado com S 2 O 3 fotocatálise e o radical OH · não foi envolvido.
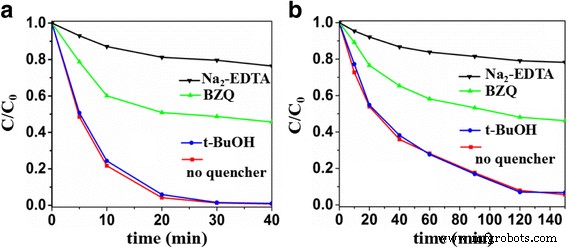
Experiência de captura de espécies ativas em Sb 2 O 3 -S-12 durante a degradação fotocatalítica de a MO. b 4-fenilazofenol
Com base nessas discussões, um possível mecanismo para degradação fotocatalítica de MO sobre Sb dopado com S 2 O 3 nanocristais foi proposto como segue (Esquema 1). Sb dopado com S 2 O 3 pode ser eficientemente excitado para criar buracos no VB e elétrons na banda de condução (CB) sob irradiação de luz visível. O doping S aumentou a largura VB de Sb 2 O 3 . Os elétrons têm vida longa o suficiente para reagir com O 2 adsorvido para produzir O 2 - · Radicais. O h + fotogerado e O 2 - · Exibiu um forte potencial de oxidação que pode oxidar diretamente MO e 4-fenilazofenol em produtos degradados.
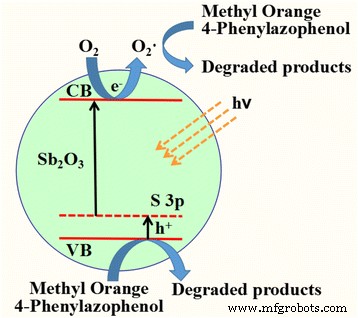
Possível mecanismo de degradação fotocatalítica de MO ou 4-fenilazofenol sobre Sb 2 O 3 -S-12 fotocatalisador de luz visível
Conclusões
O Sb dopado com S 2 O 3 nanocristais foram preparados com sucesso a partir de SbCl 3 e TAA por meio de um método hidrotérmico fácil de uma etapa sob condições alcalinas. S entrou no site intersticial de Sb 2 O 3 cristais como S 2− , que ampliou sua faixa de absorção de luz visível. O pH da solução precursora pode afetar significativamente a quantidade de dopagem de S, que ainda alterna a atividade fotocatalítica conduzida por luz visível do Sb dopado com S 2 O 3 nanocristal. O nanocristal preparado em pH 12 exibiu a maior atividade fotocatalítica dirigida por luz visível e foi capaz de degradar 99,2% MO e 94,3% p-hidroxibenzobenzeno em 40 e 150 min, respectivamente, sob irradiação de luz visível. A degradação fotocatalítica de luz visível de MO e p -hidroxiazobenzeno por Sb dopado com S 2 O 3 foram alcançados por h + e O 2 - ·.
Abreviações
- BZQ:
-
p -Benzoquinona
- MO:
-
Laranja de metila
- Na 2 -EDTA:
-
Etilenodiamina tetracetato dissódico
- S:
-
Enxofre
- TAA:
-
Tioacetamida
- t-BuOH:
-
Tert-butanol
Nanomateriais
- Use listas de verificação para uma planta mais eficiente
- S, N Co-dopado de grafeno Quantum Dot / TiO2 Compósitos para geração eficiente de hidrogênio fotocatalítico
- Síntese One-Pot Green da Microsfera SnO2 Decorada com Ag:um Catalisador Eficiente e Reutilizável para Redução de 4-Nitrofenol
- Um novo método sem solvente orgânico para nanofármaco direcionado para eficácia anticâncer aprimorada
- Exploração de Zr – Metal – Estrutura Orgânica como Fotocatalisador Eficiente para Produção de Hidrogênio
- Hierarquia hierárquica de esferas ocas de ZnO @ TiO2 para evolução de hidrogênio fotocatalítico altamente eficiente
- Polímero poroso funcional à base de trifenilfosfina como um catalisador heterogêneo eficiente para a síntese de carbonatos cíclicos de CO2
- Desempenho aprimorado de um novo catalisador PdAu / VGCNF anódico para eletro-oxidação em uma célula de combustível de glicerol
- Um Projeto Eficiente e Eficaz de Nanofios InP para Captação Máxima de Energia Solar
- Diretrizes de programação CNC para processos CNC eficientes



