Síntese One-Pot Green da Microsfera SnO2 Decorada com Ag:um Catalisador Eficiente e Reutilizável para Redução de 4-Nitrofenol
Resumo
Neste artigo, SnO decorado com Ag hierárquico 2 microesferas foram sintetizadas por um método hidrotérmico fácil de um recipiente. Os compósitos resultantes foram caracterizados por análise de XRD, SEM, TEM, XPS, BET e FTIR. Os desempenhos catalíticos das amostras foram avaliados com a redução de 4-nitrofenol a 4-aminofenol por boro-hidreto de potássio (KBH 4 ) como uma reação modelo. Experimentos dependentes do tempo indicaram que as microesferas hierárquicas montadas a partir de SnO 2 e nanopartículas de Ag podem ser formadas quando o tempo de reação é inferior a 10 h. Com o aumento do tempo hidrotérmico, SnO 2 as nanopartículas irão se automontar em SnO 2 nanofolhas e nanopartículas de Ag decoradas com SnO 2 nanofolhas foram obtidas. Quando avaliado como catalisador, o SnO decorado com Ag obtido 2 microesfera preparada por 36 h exibiu excelente desempenho catalítico com constante de taxa normalizada ( κ nem ) de 6,20 min −1 g −1 L, que é muito melhor do que alguns catalisadores relatados anteriormente. Além disso, este SnO decorado com Ag 2 microesfera demonstra boa reutilização após os primeiros cinco ciclos. Além disso, especulamos o mecanismo de formação do SnO decorado com Ag hierárquico 2 microesfera e discutiu a possível origem da excelente atividade catalítica.
Histórico
SnO 2 é um importante semicondutor do tipo n com grande bandgap (Eg =3,6 eV, a 300 K), alta mobilidade de elétrons e baixo custo, o que o habilita com excelentes propriedades em detecção de gás [1], baterias de íon de lítio [2], optoeletrônica dispositivos e células solares sensibilizadas com corantes [3,4,5,6,7,8]. Nas últimas duas décadas, o robusto SnO 2 o material atraiu atenção considerável e várias nanoestruturas foram relatadas [9, 10]. Entre as quais, estruturas hierárquicas tridimensionais (3D) auto-montadas por blocos de construção de nanofolhas são muito mais interessantes devido à sua estrutura especial e propriedades fascinantes [11, 12]. No entanto, existem apenas alguns relatórios sobre o desempenho catalítico do SnO 2 e a eficiência catalítica é relativamente baixa [13,14,15]. Portanto, é importante sintetizar SnO hierárquico 2 estruturas e estudar o desempenho catalítico. Especialmente, como sabemos, nanopartículas de metal nobre (NPs), tais como estruturas hierárquicas 3D modificadas com Au-, Ag-, Pt- e Pd mostrarão um desempenho catalítico muito melhorado [16]. No entanto, a maioria dos processos de síntese dos óxidos modificados por metais nobres acima são processos de múltiplas etapas mais complicados e geralmente tóxicos e prejudiciais ao meio ambiente [17]. Portanto, desenvolver métodos fáceis e eficientes para fabricar SnO hierárquico NP-modificado de metal nobre 2 e estudar o desempenho catalítico são altamente desejáveis.
O aumento da contaminação de nossos recursos hídricos limitados devido à ampla dispersão de vários corantes industriais, íons de metais pesados e outros poluentes aromáticos estão colocando nosso planeta em perigo [18]. O 4-nitrofenol (4-NP), um conhecido poluente tóxico, está amplamente presente em efluentes industriais e águas residuais agrícolas [19]. Dentre várias técnicas de tratamento, como filtração por membrana [20], fotodegradação [21], adsorção [22] e redução química [23,24,25,26,27,28,29,30], a redução química de 4 -NP para 4-aminofenol (4-AP) é uma via favorável, devido ao produto (4-AP) que é um importante intermediário para a fabricação de analgésicos e antipiréticos, revelador fotográfico, inibidor de corrosão, lubrificante anticorrosivo e capilar -agente de tingimento [31, 32]. Portanto, a redução de 4-NP para 4-AP possui grande significado para a redução da poluição e regeneração de recursos [33].
Neste artigo, relatamos uma síntese verde de SnO modificado com nanopartículas de Ag de metal nobre (NP) 2 arquiteturas hierárquicas por uma rota hidrotérmica simples de um único recipiente sem o assistente de quaisquer modelos e surfactantes em temperatura amena. Os efeitos do tempo de reação nas morfologias de SnO decorado com Ag 2 microesferas foram investigadas, e um possível mecanismo de crescimento de SnO decorado com Ag 2 estruturas hierárquicas foram propostas. Os resultados catalíticos indicam que os produtos sintetizados exibem excelente desempenho catalítico para a redução de 4-NP a 4-AP, com constante de taxa normalizada ( κ nem ) de 6,20 min −1 g −1 L. Além disso, o SnO decorado com Ag 2 estruturas hierárquicas sustentam alta eficiência catalítica em dez ciclos e mostram estabilidade após os primeiros cinco ciclos. Este obteve SnO decorado com Ag 2 estruturas hierárquicas podem ter aplicações potenciais de tratamento de contaminantes de água, e esta rota hidrotérmica simples de uma etapa poderia ser estendida para projetar outro composto de metal nobre modificado NP com uma ampla gama de aplicações práticas para o futuro.
Métodos
Materiais
Nitrato de prata (AgNO 3 , 99,8%), ureia (CO (NH 2 ) 2 , 99%), solução de amônia (NH 3 · H 2 O, 25 ~ 28%) e boro-hidreto de potássio (KBH 4 , 97%) foram adquiridos da Sinopharm Chemical Reagent Co. Ltd. Estanato de sódio reidratado (Na 2 SnO 3 · 3H 2 O, 98%) e 4-nitrofenol (C 6 H 5 NÃO 3 , 98%) foram fornecidos por Aladdin Reagent Co. Ltd. Todos os materiais foram usados sem purificação adicional.
Síntese de SnO decorado com Ag 2 Microsfera
SnO decorado com Ag 2 pó (proporção molar de Ag:SnO 2 =1:1) foi sintetizado pelo método hidrotérmico de um recipiente. Em um procedimento típico, 2,67 g de estanato de sódio reidratado e 0,2 g de ureia foram dissolvidos em 25 mL de água ultra-pura e agitados vigorosamente por 30 min para formar uma mistura. Em seguida, 1,69 g de nitrato de prata foram dispersos em 25 mL de água ultra pura e, em seguida, 2,4 mL de hidróxido de amônio foram adicionados à solução de nitrato de prata para formar a solução de prata-amônia. Após agitação por 5 min, a solução de prata-amônia recém-preparada foi adicionada à mistura sob agitação magnética por 1 h. Subsequentemente, a mistura resultante foi migrada para uma autoclave revestida com Teflon de 50 mL e aquecida a 150 ° C durante 5, 10, 24 e 36 h. Após o procedimento hidrotérmico, a autoclave foi resfriada naturalmente até a temperatura ambiente e o SnO 2 / O produto Ag foi coletado por centrifugação, seguido de enxágue com água desionizada e etanol e secagem em estufa a vácuo a 60 ° C. SnO 2 / Microesfera Ag com diferentes razões molares (1,5:1, 1:1, 0,5:1, 0,01:1) de Ag para SnO 2 são sintetizados de maneira semelhante, exceto para as quantidades de AgNO 3 e NH 3 · H 2 O. Para comparação, SnO puro 2 e Ag também foram sintetizados por procedimento semelhante sem a adição de AgNO 3 e Na 2 SnO 3 .
Amostra de caracterizações
A fase cristalina das amostras preparadas foram investigadas por difração de pó de raios-X (XRD, radiação Cu Kα ( λ =1,5418 Å)). As medições de microscopia eletrônica de varredura (SEM) foram realizadas em um microscópio SEM de emissão de campo SU-70 com uma tensão de aceleração de 20 kV. Micrografia eletrônica de transmissão (TEM) e microscopia eletrônica de transmissão de alta resolução (HRTEM) foram obtidas em um microscópio eletrônico de transmissão Tecnai G2 F20 S-TWIN com uma tensão de aceleração de 200 kV. A espectroscopia de fotoelétrons de raios-X (XPS) foi realizada para identificar a composição química da superfície e os estados químicos dos catalisadores em um espectrômetro de fotoelétrons de raios-X MARK II usando radiação de Mg Kα. A área de superfície específica da amostra foi avaliada pelo modelo Langmuir e modelo Brunauer – Emmett – Teller (BET) com base na isoterma de adsorção de nitrogênio obtida com uma série V-sorb X2008, enquanto a distribuição do tamanho dos poros foi estimada por Barrett – Joyner – Halenda (BJH) teoria.
Atividade catalítica de SnO decorado com Ag 2 Microsfera
A redução de 4-NP com KBH 4 solução foi usada como uma reação modelo para estudar a atividade catalítica de SnO decorado com Ag 2 compósitos. O processo de redução catalítica foi realizado em uma célula de quartzo padrão com um comprimento de caminho de 1 cm e volume de cerca de 4 mL com 0,3 mL de soluções aquosas recém-preparadas de 4-NP (20 mg / L) e KBH 4 (1,5 mg). A alta razão molar de KBH 4 a 4-NP garantiu uma quantidade excessiva do anterior e, portanto, sua concentração permaneceu essencialmente constante durante a reação de redução. Após a adição de KBH 4 na solução 4-NP, sua cor mudou imediatamente de amarelo claro para amarelo escuro devido à formação do íon 4-nitrofenolato (formado a partir da alta alcalinidade do KBH 4 ) Mais tarde, a cor amarela escura desbotou com o tempo (devido à conversão de 4-NP em 4-AP) após a adição de 1,5 mg de SnO decorado com Ag 2 híbridos. Os espectros de absorção de UV-Vis foram registrados por um espectrômetro de UV-Vis em uma faixa de varredura de 250-500 nm em temperatura ambiente em um intervalo de tempo de 1 min. Várias rodadas de reação consecutivas foram medidas para determinar a estabilidade do catalisador.
Resultados e discussão
Caracterização de SnO decorado com Ag 2 Microsfera
A composição e estrutura de fase do SnO decorado com Ag sintetizado 2 pós para tempos diferentes foram investigados por XRD, e os padrões correspondentes são mostrados na Fig. 1. Pode ser visto que os picos de difração característicos combinam bem com a fase rutilo tetragonal SnO 2 (Arquivo JCPDS nº 41-1445, a =4.738Å e c =3,187 Å) e fase Ag cúbica centrada na face (fcc) (arquivo JCPDS nº 04-0783). Nenhum pico de difração de quaisquer outras impurezas foi detectado, indicando que os pós são uma mistura de SnO puro 2 e Ag. Para a amostra reagida por 5 h, os picos de difração característicos em 38,12 ° e 44,2 °, correspondentes aos planos (111) e (200) de Ag, são relativamente fracos. Com o aumento do tempo hidrotérmico, as intensidades de pico de Ag aumentam e as larguras totais do pico de difração também diminuem, indicando a cristalinidade aumentada de nanopartículas de Ag ou o peso aumentado de Ag. Isso pode ser verificado posteriormente pelos padrões de XRD das amostras obtidas sob diferentes temperaturas e diferentes razões molares de Ag e SnO 2 (Arquivo adicional 1:Figura S1).
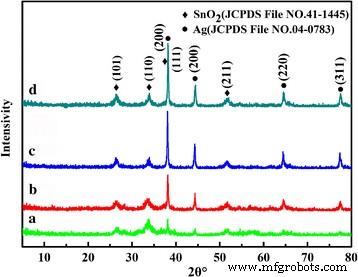
Padrões de XRD do SnO decorado com Ag 2 microesferas preparadas a 150 ° C para tempos diferentes ( a ) 5 h, ( b ) 10 h, ( c ) 24 h, e ( d ) 36 h
As imagens SEM na Fig. 2 mostram a evolução morfológica interessante de amostras preparadas em diferentes tempos hidrotérmicos de 5 a 36 h. A amostra preparada por 5 h era microesfera irregular, e a visão ampliada da superfície das microesferas no inset que ilustra a microesfera é montada por nanopartículas (Fig. 2a). Com o aumento do tempo hidrotérmico, a microesfera tornou-se mais regular. Após o aumento do tempo hidrotérmico para 24 h (Fig. 2c), a microesfera cresceu às custas das nanopartículas menores e das nanopartículas de superfície automontadas em nanofolhas. Essas nanofolhas montadas para formar uma estrutura hierárquica de microesferas. Ao aumentar ainda mais o tempo hidrotérmico para 36 h, as nanofolhas grosseiras tornaram-se alisadas e as microesferas com diâmetros variando de 2 a 4 μm são mais uniformes. O aumento adicional do tempo hidrotérmico não levou a nenhuma mudança óbvia da morfologia e do cristalino (não mostrado neste artigo). A morfologia da amostra preparada por 36 h foi posteriormente observada via TEM e HRTEM. Conforme mostrado na Fig. 2e, o SnO obtido 2 / Ag é de morfologia de microesfera com diâmetro de ~ 5 μm e a microesfera é montada a partir de nanofolhas. Na imagem HRTEM típica (Fig. 2f), Ag NPs com um tamanho médio de cerca de 5 nm foram formados e homogeneamente distribuídos para SnO 2 . As franjas da rede de d =0,26 nm espaçamento pode ser atribuído aos planos Ag (111) enquanto as franjas da rede de d =0,33 nm pode ser atribuído ao plano (110) de SnO 2 , respectivamente. Para ilustrar ainda mais as distribuições uniformes de nanopartículas de Ag na microesfera, análise de mapeamento de elemento do SnO 2 / Ag microesfera foi realizada (Fig. 3). Conforme mostrado na Fig. 3, o mapa dos elementos Ag, Sn e O são ajustados na morfologia da amostra, indicando que as nanopartículas de Ag estão uniformemente dispersas nas microesferas.
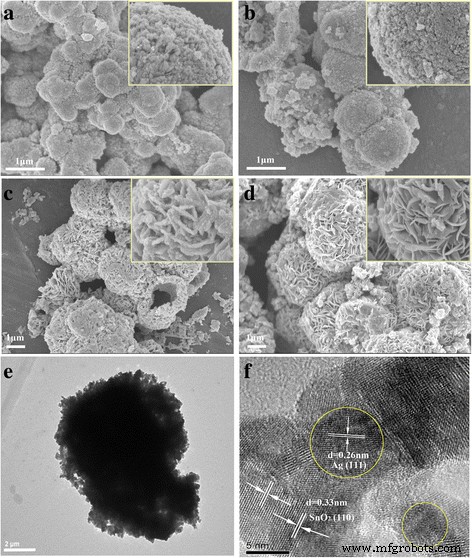
Imagens representativas da FESEM e imagens TEM do SnO decorado com Ag 2 microesferas preparadas a 150 ° C para diferentes tempos hidrotérmicos a 5h, b 10h, c 24h e d 36h e e , f imagem TEM de baixa ampliação e TEM de alta resolução (HRTEM) da amostra preparada por 36 h
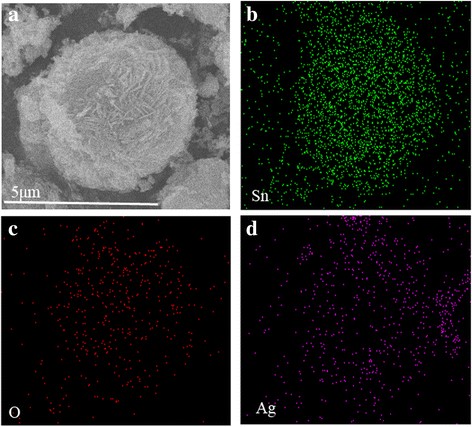
Mapeamento de elemento EDS de SnO 2 / Microesferas Ag. a Imagem SEM e mapas de elemento de b Sn, c O e d Ag
O N 2 As isotermas de adsorção-dessorção de amostras e sua distribuição de tamanho de poro correspondente são ilustradas na Fig. 4. Todas as amostras exibiram isotermas de tipo IV com H 3 loop de histerese, significando estruturas mesoporosas típicas de tamanho de poro uniforme [34]. As áreas de superfície específicas de BET foram determinadas como 21,8, 22,4, 24,6. e 25,7 m 2 g −1 , respectivamente. A inserção mostra as distribuições de tamanho de poro das amostras. A distribuição do tamanho dos poros é mono-modal para todas as amostras. O diâmetro médio do poro é de ~ 2 nm para o SnO decorado com Ag como hierárquico 2 pós. É de notar que a área de superfície BET calculada e o diâmetro médio dos poros não tem alteração óbvia com o aumento do tempo hidrotérmico.
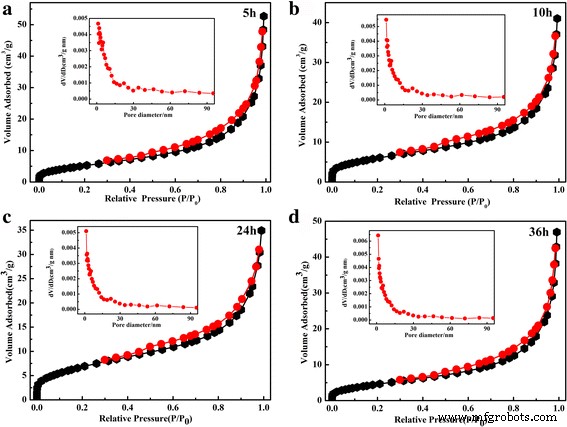
Isoterma de adsorção-dessorção de nitrogênio típica do SnO 2 preparado / Microesferas de Ag preparadas a 150 ° C para diferentes tempos hidrotérmicos a 5 h, b 10 h, c 24 h e d 36 h
O XPS foi usado para examinar os estados químicos e a composição da superfície do SnO decorado com Ag 2 microesferas. Varreduras amplas foram registradas primeiro, seguidas por uma varredura detalhada das bordas de cada elemento, como Sn 3d, Ag 3d e O 1s (Fig. 5). Pode-se mencionar que o efeito de carga na amostra foi corrigido definindo a energia de ligação do carbono (C 1s) em 284,6 eV e este pico de carbono foi usado como uma posição de referência para escalonar todos os outros picos. Conforme mostrado na Fig. 5b, o pico aparece como um dupleto spin-órbita em 369,1 eV (Ag 3d 5/2 ) e 375,2 eV (Ag 3d 3/2 ) para Ag 0 [35, 36] no produto. Os dois picos de satélite em 366,5 e 372,3 eV podem ser responsáveis por Ag 3d em SnO decorado com Ag 2 nanocompósitos [37]. Além disso, dois picos XPS localizados em 488 e 496,7 eV são relevantes para Sn 3d 5/2 e Sn 3d 3/2 , indicando a presença de Sn 4+ em SnO 2 . E os picos em torno de 485,7 e 494,7 eV podem ser causados pela ligação entre Sn e Ag [38, 39]. A ligeira mudança de energia desses elementos em SnO decorado com Ag 2 microesfera significa que os elétrons podem se transferir entre Ag e SnO 2 , demonstrando forte interação entre nanopartículas de Ag e SnO 2 nanofolhas em vez de simplesmente contato físico. A forte interação é vantajosa para a transferência de elétrons entre as partículas adjacentes, o que pode melhorar as atividades catalíticas e ser benéfico para algum fenômeno semelhante, o que foi observado em outras literaturas [38,39,40]. Na Fig. 5d, os espectros de O 1s em 530,5 eV corresponderam ao oxigênio da rede, enquanto o pico em 532,6 eV corresponde ao oxigênio adsorvido quimicamente ou íons hidroxila, como O - , O 2 - , ou OH - na superfície do SnO 2 [41,42,43,44].
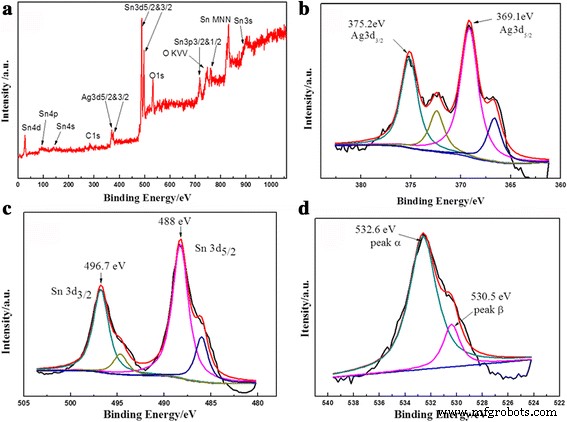
Espectros XPS representativos de SnO 2 / Ag microesferas preparadas a 150 ° C por 36 h. a Espectro completo de XPS. Espectros de alta resolução dos elementos b Ag, c Sn e d O
Redução catalítica de 4-NP
A redução de 4-NP por KBH 4 na presença de catalisador é uma reação química verde bem estudada e foi escolhida como a reação modelo para estudar a atividade catalítica do SnO decorado com Ag conforme preparado 2 compósitos. O espectro de absorção UV-Vis com uma absorção máxima em 400 nm é formado devido ao composto nitro. Com SnO decorado com Ag 2 catalisador adicionado, o pico de absorção em 400 nm, atribuído aos compostos nitro, diminuiu drasticamente em 1 min e um novo pico em 300 nm correspondente a 4-AP apareceu, indicando que a redução catalítica de 4-NP havia ocorrido com sucesso (Fig. 6a) . Considerando o excesso de KBH 4 , sua concentração pode ser considerada uma constante durante a reação. Portanto, uma equação cinética de pseudo primeira ordem pode ser aplicada para avaliar a taxa catalítica. A equação cinética da redução pode ser escrita da seguinte forma:
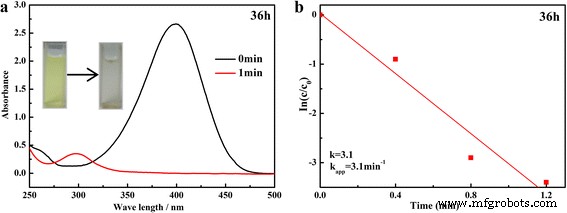
a , b Espectros de absorção de UV-Vis dependentes do tempo e o gráfico de ln ( C t / C 0 ) versus tempo de reação para a redução de 4-NP da amostra preparada a 150 ° C por 36 h
onde as razões de concentrações de 4-NP C t (no momento t ) para seu valor inicial C 0 ( t =0) foram dados diretamente pela intensidade relativa da respectiva absorbância A t / A 0 , κ aplicativo corresponde à constante de taxa aparente. A constante de taxa aparente, κ aplicativo , foi calculado como 3,10 min −1 para a redução de 4-NP do SnO decorado com Ag preparado 2 microesfera a 150 ° C durante 36 h (Fig. 6b). A fim de avaliar melhor o desempenho catalítico do SnO decorado com Ag 2 , todas as amostras preparadas para diferentes tempos hidrotérmicos foram conduzidas para redução catalítica do 4-NP. Os espectros de absorção UV-Vis da redução são mostrados no arquivo adicional 1:Figura S2-S5, e os gráficos correspondentes de ln ( C t / C 0 ) versus tempo são mostrados na Fig. 7. É claro que quase 100% de 4-NP pode ser reduzido dentro de 1 minuto do primeiro ciclo. Com o aumento dos tempos de ciclo, o tempo fica mais longo. No entanto, mais de 80% do 4-NP pode ser reutilizado em 8 minutos. Pode-se observar que ln ( C t / C 0 ) os valores mostram uma boa correlação linear com o tempo de reação para todos os catalisadores, indicando que a redução segue uma lei de reação de primeira ordem. As constantes de taxa aparentes calculadas κ aplicativo de diferentes ciclos para todas as amostras são mostrados na Tabela 1.
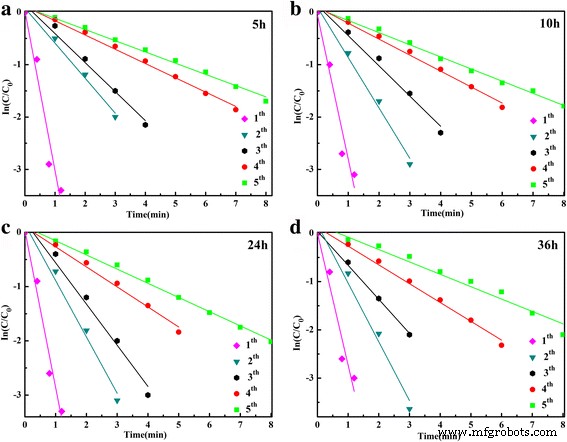
Plot de ln ( C t / C 0 ) versus tempo de reação na presença de SnO decorado com Ag 2 microesferas preparadas para diferentes tempos hidrotérmicos a 5 h, b 10 h, c 24 h e d 36 h
Conforme mostrado na Fig. 7 e Tabela 1, as constantes de taxa aparentes ( κ aplicativo ) aumentam com a extensão do tempo hidrotérmico e diminuem com os tempos dos ciclos, principalmente para o primeiro e segundo ciclos. As diminuições da constante de taxa podem ser devido ao descolamento e coagulação de Ag NPs da microesfera durante a centrifugação. Para comprovar a estabilidade da amostra preparada no trabalho, o catalisador separado (preparado por 36 h) foi reaproveitado para redução catalítica do 4-NP por mais de cinco ciclos. Os espectros de absorção de UV-Vis dependentes do tempo do sexto ao décimo ciclo são mostrados no arquivo adicional 1:Figura S6. As constantes de taxa aparentes correspondentes ( κ aplicativo ) mostrado na Fig. 8 mostra que há apenas uma ligeira diminuição no κ aplicativo valor com o aumento dos ciclos sucessivos, indicando que após os primeiros cinco ciclos, os catalisadores são muito mais estáveis do que as amostras preparadas de fresco. Isso prova que o SnO decorado com Ag conforme preparado 2 as amostras possuem boa estabilidade para a redução catalítica de 4-NP a p-AP por KBH 4 e pode ser usado como um catalisador ativo e estável alternativo para a redução catalítica de 4-NP.
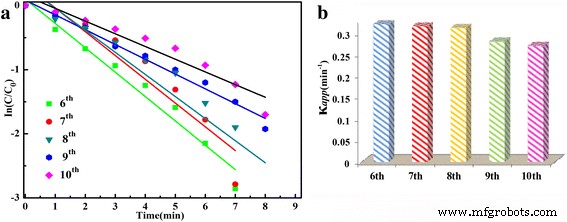
a , b Plot de ln ( C t / C 0 ) versus tempo de reação do sexto ao décimo ciclos para a amostra de 36 h
Além disso, os espectros de FTIR do catalisador antes e depois de cinco ciclos e dez ciclos de redução catalítica foram mostrados em ESI. Conforme mostrado no arquivo adicional 1:Figura S7, após cinco e dez ciclos de redução catalítica, os picos principais das amostras foram quase os mesmos com a amostra preparada e isso ilustra que os catalisadores são muito estáveis.
A fim de comparar nossos resultados com outros catalisadores na literatura, avaliamos a capacidade catalítica do SnO decorado com Ag 2 normalizando o κ aplicativo valores para κ nem [45, 46]. A constante de taxa normalizada κ nem ( κ nem = κ aplicativo / c gato , onde c gato é a concentração do catalisador) é um indicador chave para estimar a atividade catalítica. As constantes de taxa normalizadas κ nem foram calculados em 6,20, 0,64 e 0,54 min −1 g −1 L do primeiro ciclo, quinto ciclo e décimo ciclo para o SnO 2 / A microesfera Ag reagiu por 36 h, respectivamente. A comparação de κ nem do SnO 2 / Ag (36 h) e outros catalisadores na literatura são mostrados na Tabela 2. A partir da Tabela 2, é óbvio que a constante de taxa aparente normalizada κ nem da amostra neste trabalho é muito maior do que a de alguns catalisadores relatados na literatura [47,48,49,50,51,51,52,53,54,55,56,57,58], como núcleo-casca Ag @ Pt (0,92 min −1 g −1 L), AgNPs / GR-G3.0PAMAM (0,78 min −1 g −1 L), rGO / Fe 3 O 4 / Au (0,52 min −1 g −1 EU). Além disso, para o quinto e décimo ciclos, o κ calculado nem (0,64 e 0,54 min −1 g −1 L) são ainda maiores do que esses catalisadores [51,52,53,54,55,56,57,58]. Todos esses resultados ilustram que o SnO preparado 2 / A microesfera Ag pode ser considerada um potencial catalisador eficiente para a redução de 4-NP.
Com base nos resultados anteriores e na teoria tradicional sobre a redução catalítica de p-NP por metais nobres, o mecanismo de formação e a origem da excelente eficiência catalítica do SnO decorado com Ag hierárquico 2 microesferas foram especuladas e o esquema é mostrado nas Figs. 9 e 10. No método hidrotérmico fácil de um recipiente, o Ag e SnO 2 NPs foram formados simultaneamente na solução e as superfícies recém-nascidas tendem a se ligar umas às outras. Com o aumento do tempo hidrotérmico, o SnO 2 nanopartículas montadas em nanofolhas [59] e nanopartículas de Ag dispersas na microesfera. Durante a redução catalítica, as nanopartículas de Ag iniciam a redução catalítica retransmitindo elétrons do BH doador 4 - ao aceitador 4-NP nos locais de adsorção das amostras, que foi acelerado pela ligação íntima entre SnO 2 e Ag NP. Além disso, os Ag NPs dispersos na microesfera podem evitar a aglomeração durante a reação catalítica devido ao efeito de impedimento estérico. Além disso, o efeito sinérgico de Ag NPs e SnO 2 nanofolhas co-contribuem para a excelente atividade catalítica de SnO decorado com Ag 2 compósitos. A fim de verificar a suposição, puro SnO 2 e Ag NPs foram sintetizados por procedimentos semelhantes sem a adição de AgNO 3 e Na 2 SnO 3 , respectivamente, e então serviram para a redução catalítica de 4-NP. Os espectros de UV-Vis dependentes do tempo e os gráficos correspondentes de ln ( C t / C 0 ) versus tempo para SnO 2 e Ag NPs são mostrados no arquivo adicional 1:Figura S8 e Figura S9. Pode-se observar que a redução também segue uma lei de reação de primeira ordem. A constante de taxa ( κ aplicativo ) os valores calculados a partir da inclinação da região linear foram encontrados em 1,24 min −1 , e 1,16 min −1 para SnO 2 e Ag, que é menor do que SnO 2 / Ag. Portanto, a excelente atividade catalítica do SnO 2 / Ag pode surgir do efeito sinérgico entre nanopartículas de Ag e SnO 2 nanofolhas. No entanto, o mecanismo preciso precisa ser mais explorado.
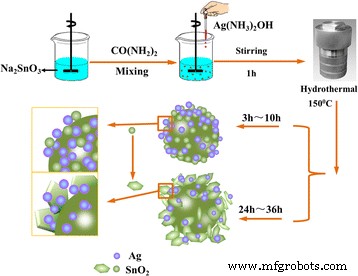
Ilustrações esquemáticas da síntese de SnO decorado com Ag 2 microesfera
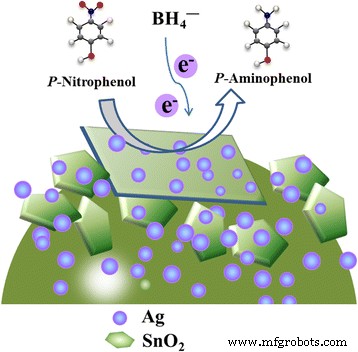
Ilustrações esquemáticas da redução catalítica de 4-NP a 4-AP sobre SnO decorado com Ag 2 microesfera
Conclusões
Em conclusão, SnO decorado com Ag hierárquico 2 microesfera com nanopartículas de Ag uniformes e SnO 2 nanofolhas foram preparadas com sucesso por um método fácil de um recipiente. Os catalisadores preparados por este método simples, mas eficaz, exibem excelente desempenho catalítico para a redução de 4-NP a 4-AP com κ nem de 6,20 min −1 g −1 L. Além disso, o catalisador pode sustentar alto desempenho catalítico após os primeiros cinco ciclos e pode-se esperar que atue como catalisadores de alta eficiência para a redução de 4-NP. Além disso, acreditamos que este método pode ser usado como uma nova estratégia para preparar outros compósitos semicondutores modificados por partículas de metal.
Nanomateriais
- Avanços e desafios dos nanomateriais fluorescentes para aplicações biomédicas e de síntese
- Nanopartículas de sílica para entrega de proteína intracelular:uma nova abordagem de síntese usando proteína fluorescente verde
- Polímero poroso funcional à base de trifenilfosfina como um catalisador heterogêneo eficiente para a síntese de carbonatos cíclicos de CO2
- Um Projeto Eficiente e Eficaz de Nanofios InP para Captação Máxima de Energia Solar
- Síntese e desempenho in vitro de nanopartículas de ferro-platina revestidas com polipirrole para terapia fototérmica e imagem fotoacústica
- Síntese de um vaso de nanoplacas Cu2ZnSnSe4 e sua atividade fotocatalítica orientada por luz visível
- Adepto verde na síntese e estabilização de nanopartículas de cobre:atividades catalíticas, antibacterianas, citotoxicidade e antioxidantes
- Platycodon saponins from Platycodi Radix (Platycodon grandiflorum) para a síntese verde de nanopartículas de ouro e prata
- Nanocristal Sb2O3 dopado com S:um catalisador de luz visível eficiente para degradação orgânica
- Novo suporte de catalisador anódico para célula de combustível de metanol direto:caracterizações e desempenho de célula única



