Síntese e caracterização de BiOCl modificado e sua aplicação na adsorção de corantes de baixa concentração de solução aquosa
Resumo
A síntese e caracterização de BiOCl e Fe 3+ -enxertado BiOCl (Fe / BiOCl) é relatado que são desenvolvidos como adsorventes eficientes para a remoção de corantes catiônicos rodamina B (RhB) e azul de metileno (MB), bem como corantes aniônicos laranja de metila (MO) e laranja ácida (AO) de soluções aquosas com baixa concentração de 0,01 ~ 0,04 mmol / L. As caracterizações por várias técnicas indicam que Fe 3+ enxertia induziu estrutura porosa mais aberta e área de superfície específica mais alta. Ambos BiOCl e Fe / BiOCl com superfícies carregadas negativamente mostraram excelente eficiência de adsorção em direção a corantes catiônicos, que poderia atingir nitidamente 99,6 e quase 100% em 3 min em BiOCl e 97,0 e 98,0% em 10 min em Fe / BiOCl para remover RhB e MB, respectivamente. No entanto, Fe / BiOCl apresentou maior capacidade de adsorção do que BiOCl para corantes iônicos. A influência da concentração inicial do corante, temperatura e valor do pH na capacidade de adsorção é amplamente estudada. O processo de adsorção de RhB está em conformidade com a isoterma de adsorção de Langmuir e o recurso cinético de pseudo-segunda ordem. As excelentes capacidades de adsorção dos adsorventes preparados em relação aos corantes catiônicos são racionalizadas com base na atração eletrostática, bem como na estrutura porosa aberta e na área de superfície específica elevada. Em comparação com Fe / BiOCl, BiOCl exibe maior eficiência seletiva para corantes catiônicos em soluções de corantes mistos.
Histórico
Um sério risco ambiental, causado pela poluição da água com corantes tóxicos, contaminantes orgânicos e íons metálicos, veio a público [1,2,3,4]. As águas residuais descartadas são principalmente tóxicas, não biodegradáveis e perigosas para a saúde humana e os organismos marinhos. Portanto, os poluentes devem ser removidos das águas residuais para resolver os problemas biológicos, ecológicos e ambientais. Várias técnicas, incluindo troca iônica [5], adsorção [6, 7], precipitação química [8], oxidação avançada [9,10,11], biodegradação [12, 13] e fotocatálise [14,15,16] têm foi tentado a remoção de poluentes em águas residuais. O método de adsorção é de fácil manuseio, altamente eficiente, economicamente viável e ecologicamente correto [17,18,19], sendo, portanto, considerado uma rota competitiva para a remoção eficiente de poluentes de águas residuais.
O oxicloreto de bismuto (BiOCl), como fotocatalisador, tem chamado recentemente muita atenção [20,21,22,23,24,25]. No entanto, sua excelente capacidade de adsorção para corantes ou poluentes orgânicos em águas residuais alerta pouca atenção [26,27,28]. Como todos sabem, a capacidade de adsorção é fortemente influenciada pela morfologia, tamanho da partícula e composição de um adsorvente [29]. A morfologia representativa do BiOCl é uma microestrutura hierárquica tridimensional (3D) semelhante a uma flor. Esta estrutura porosa específica e grande área de superfície da morfologia semelhante a flor hierárquica 3D é amplamente benéfica para o processo de adsorção [28, 30, 31]. A modificação da superfície é uma técnica universal para melhorar a capacidade de adsorção de um adsorvente. Yu et al. [32] melhoraram as capacidades de adsorção de BiOCl em relação aos corantes vermelho congo (CR) e vermelho reativo 3 (X3B) por meio da fixação de CTAB na parte externa de BiOCl, que poderia atingir as capacidades máximas de adsorção de 901 e 699 mg / g para CR e X3B , respectivamente. Sohn [29] melhorou as capacidades de adsorção de BiOI para a remoção de corantes de laranja de metila (MO), rodamina B (RhB) e azul de metileno (MB) por meio de uma rota de carregamento de Ti. A capacidade de adsorção de BiOCl também pode ser aumentada pela introdução de iodo, que atingiu o valor máximo de adsorção em relação ao ácido hidroxifenilacético (p-HPA) quando a razão molar I / Cl foi de 0,5 e diminuiu com o aumento adicional da razão molar I / Cl [33 ]
Neste trabalho, sintetizamos com sucesso a microestrutura hierárquica 3D BiOCl por meio de um Fe 3+ -método modificado. Corantes catiônicos (RhB e MB) e corantes aniônicos (MO e ácido orgânico, AO) com baixa concentração de 0,01 ~ 0,04 mmol / L são escolhidos respectivamente para verificar as eficiências de adsorção de BiOCl e Fe 3 + -enxertado BiOCl (Fe / BiOCl) pela primeira vez, embora seus desempenhos fotocatalíticos tenham sido relatados [34]. Suas eficiências de adsorção de corantes mistos também foram estudadas. Além disso, a influência de vários parâmetros de reação, incluindo valor de pH, temperatura de reação e concentração inicial, nas capacidades de adsorção de BiOCl e Fe / BiOCl foram discutidas. Para entender completamente o processo de adsorção, a isoterma de adsorção e a característica cinética foram investigadas e uma relação entre a estrutura adsorvente e a capacidade de adsorção do corante foi proposta. Este trabalho não apenas fornece uma nova ideia para a construção de um adsorvente com capacidade de adsorção aprimorada, mas também é benéfico para melhor compreender a relação entre a estrutura do adsorvente e a capacidade de adsorção de corante.
Métodos
Síntese de BiOCl e Fe / BiOCl
Produtos químicos de grau analítico de Bi (NO 3 ) 3 · 5H 2 O, Fe (NÃO 3 ) 3 · 9H 2 O, KCl e glicerol foram adquiridos de Shanghai Chemical Industrial Co., todos os quais foram usados como materiais de partida sem purificação adicional.
Em um procedimento típico de BiOCl, 0,776 g Bi (NO 3 ) 3 · 5H 2 O foi dissolvido em 76 mL de glicerol com agitação magnética (solução A), e 0,12 g de KCl foi dissolvido em 4 mL de água desionizada (solução B). Subsequentemente, a solução de KCl obtida foi misturada com a solução A e transferida para uma autoclave de aço inoxidável forrada com Teflon. A autoclave foi aquecida a 110 ° C e mantida a esta temperatura durante 8 h. O precipitado resultante foi recolhido por centrifugação, lavado com etanol e água desionizada várias vezes e seco a 80 ° C. Finalmente, o pó foi calcinado a 400 ° C para obter o pó BiOCl puro. O processo de preparação do Fe / BiOCl foi o mesmo do BiOCl, exceto pela adição de várias quantidades de Fe (NO 3 ) 3 · 9H 2 O na solução A. Os produtos finais foram denotados como Fe / BiOCl ( x ), onde x representou a razão molar de Fe / Bi.
Caracterização
Os padrões de difração de pó de raios-X (XRD) foram registrados em um difratômetro de raios-X (Empypeanp Panalytical) com radiação Cu Kα ( λ =0,154 nm). As morfologias e estruturas detalhadas foram conduzidas por microscopia eletrônica de transmissão (TEM) e TEM de alta resolução (HRTEM) em um microscópio JEM-2010 operado a 200 kV. Imagens de microscopia eletrônica de varredura (SEM) foram registradas no aparelho Hitachi S-4800 com uma tensão de aceleração de 15 kV. As composições químicas e os estados de superfície das amostras foram analisados por espectroscopia de fotoelétrons de raios X (XPS), as quais foram realizadas em um espectrômetro de fotoelétrons Thermo Escalab 250Xi com um Al Kα monocromático ( hv =1486,6 eV). O N 2 As isotermas de adsorção-dessorção foram medidas a 77 K operadas em um Micrometrics ASAP 2020. Antes da medição, as amostras sintetizadas foram desgaseificadas em vácuo a 180 ° C por 8 h. As áreas de superfície específicas foram calculadas pelo método Brunauer-Emmett-Teller (BET); as distribuições de tamanho de poro das amostras foram derivadas dos ramos de dessorção das isotérmicas usando o modelo de Barrett-Joyner-Halenda (BJH). O potencial zeta das amostras foi medido usando DelsaTM Nano Zeta Potential para verificar a carga superficial em diferentes valores de pH.
Teste de capacidade de adsorção
Os experimentos de adsorção foram realizados no escuro e à temperatura ambiente. Corantes catiônicos de MB e RhB e corantes aniônicos de MO e AO foram selecionados como os corantes orgânicos típicos para verificar as capacidades de adsorção de BiOCl e Fe / BiOCl. Em um experimento de adsorção típico, 50 mg de amostra preparada foram respectivamente adicionados a 50 mL de várias soluções de corante com diferentes concentrações variando de 0,01 ~ 0,04 mmol / L sob agitação magnética. A cada intervalo de tempo determinado, 3 mL de suspensão foram retirados e centrifugados para remover o pó sólido. A concentração dos corantes restantes foi determinada usando um espectrofotômetro UV-vis (Hitachi U-3900).
A porcentagem de corante residual pode ser calculada usando a Eq. (1):
$$ \ mathrm {residual} \ \ mathrm {porcentagem} \ \ left (\% \ right) =\ frac {C _ {\ mathrm {t}}} {C_0} \ times 100 \% $$ (1)
A quantidade de moléculas de corante adsorvidas no tempo t foi calculado usando a Eq. (2):
$$ {q} _t =\ frac {\ left ({C} _0- {C} _t \ right) V} {m} $$ (2)
onde C 0 e C t (mg / L) são a concentração de moléculas de corante inicial e a qualquer momento t , respectivamente; q t é a quantidade de moléculas de corante adsorvidas por unidade de adsorvente no tempo t (mg / g); V é o volume da solução de corante ( L ); e m é o peso do adsorvente (mg).
Os efeitos dos parâmetros experimentais, incluindo tempo de adsorção, concentração inicial do corante, temperatura e valor de pH foram estudados para otimizar o processo de adsorção.
A reciclabilidade dos adsorventes BiOCl e Fe / BiOCl também foi realizada. Para a dessorção do corante, 50 mg de BiOCl e Fe / BiOCl foram adicionados a 50 mL de solução de etanol NaOH (0,01 M) e a seguir foi agitada por 60 min, respectivamente. Posteriormente, o adsorvente foi coletado, lavado abundantemente com água e seco. O produto obtido foi então usado para adsorção no próximo ciclo de adsorção.
Resultados e discussão
Caracterização do material
A Figura 1a mostra os padrões de XRD de BiOCl com diferentes razões molares Fe / Bi. Todos os picos de BiOCl puro (Fe / Bi =0) estão em boa concordância com o BiOCl tetragonal (JCPDS 06-0249) e nenhum outro pico de XRD é observado. Com um aumento da razão molar Fe / Bi, os picos de XRD se tornam mais fortes e nítidos. Percebe-se que não são observados novos picos na faixa de 2 θ =20 ~ 35 ° (Fig. 1b). Como é conhecido, Fe 3+ poderia facilmente hidrolisar para formar (hidr) óxidos que gradualmente se convertem em óxidos de ferro cristalinos [35, 36]. No entanto, nenhum pico de difração correspondente a óxidos de ferro é observado nos padrões de XRD de Fe / BiOCl ( x ), isto é, óxidos de ferro não se formaram em nossas amostras, embora as amostras tenham tido um tratamento térmico a 400 ° C por 3 h. Além disso, os picos característicos de Fe / BiOCl ( x ) não têm mudanças em comparação com aqueles de BiOCl puro, o que indica que Fe 3+ íons não são incorporados na rede cristalina do BiOCl [37, 38]. Assim, pode-se concluir que os ferros estão presentes principalmente como Fe altamente disperso 3+ formam ao invés de óxidos de ferro ou íons dopantes na superfície ou na rede cristalina de BiOCl, cujo resultado está de acordo com Cu / BiOCl [39] e Fe (III) -BiOCl [34].
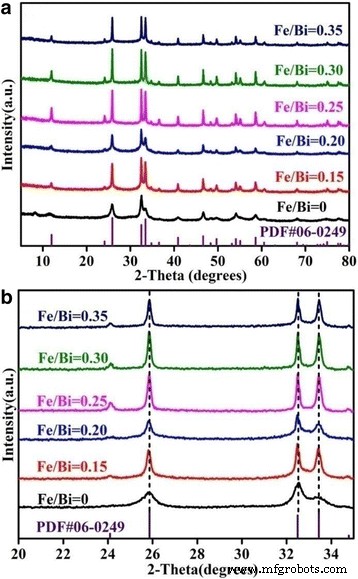
Padrões XRD largos ( a ) e padrões de XRD locais ( b ) de Fe / BiOCl ( x )
As imagens representativas de SEM de Fe / BiOCl ( x ) são mostrados na Fig. 2. Pode ser visto claramente na Fig. 2a que BiOCl exibe uma estrutura semelhante a uma microesfera 3D com um diâmetro médio de cerca de 1 ~ 2 μm. A imagem de SEM de alta ampliação (Fig. 2b) revela que as microesferas BiOCl são firmemente montadas por numerosas nanoplacas irregulares com uma largura de cerca de 70 nm e uma espessura de cerca de 20 nm. Depois de Fe 3+ enxertando, a morfologia do Fe / BiOCl permanece a estrutura esférica, mas exibe o diâmetro diminuído de cerca de 0,5 ~ 1 μm (Fig. 2c). A partir da imagem de SEM de alta ampliação de Fe / BiOCl (Fig. 2d), pode-se descobrir que as microesferas de Fe / BiOCl são compostas por muitas nanofolhas com uma espessura mais fina de cerca de 15 nm. Além disso, algumas novas nanofolhas quadradas também são observadas. Conforme relatado, a introdução de Fe 3+ íons poderiam induzir uma transformação morfológica em oxialetos de bismuto [11, 37, 40]. A existência de Fe 3+ em nossas amostras possivelmente desempenha um papel na indução de uma microestrutura hierárquica com nanofolhas mais finas.

Imagens SEM do BiOCl ( a , b ) e Fe / BiOCl (0,25) ( c , d )
A estrutura geométrica e morfologia das amostras foram investigadas por técnicas TEM e HRTEM. A imagem TEM típica (Fig. 3a) de uma estrutura individual revela ainda a morfologia esférica de BiOCl com um diâmetro de cerca de 1 μm, que é construída por nanoplacas exibindo bordas aproximadamente arredondadas com uma espessura de 20 nm. A Figura 3b mostra a imagem HRTEM das nanoplacas finas, onde as franjas de rede claras indicam a boa cristalinidade e a natureza de cristal único dessas subunidades em forma de placa. As franjas da rede com d espaçamento de 0,276 nm pertencem ao (110) plano cristalino do BiOCl. Outras franjas de treliça com d espaçamento de 0,344 nm corresponde aos (101) planos do BiOCl. Em comparação com BiOCl puro, a amostra de Fe / BiOCl é composta por micro-flores hierárquicas fracamente montadas por nanofolhas substanciais com uma pequena quantidade de estruturas quadradas, cujo resultado é consistente com o resultado SEM (Fig. 2c). As franjas da rede na Fig. 3d com d espaçamento de 0,276, 0,344 e 0,342 nm pertencem ao plano cristalino (110), (101) e (011) do BiOCl, respectivamente. Com base nos resultados de SEM e TEM, pode-se deduzir que Fe 3+ Os íons podem induzir o crescimento de nanofolhas quadradas regulares e conduzir as nanofolhas a formar micro-flores hierárquicas com estrutura porosa aberta, cuja transformação pode estar possivelmente relacionada ao apego orientado e ao amadurecimento de Ostwald [37].

Imagens TEM e HRTEM de BiOCl ( a , b ) e Fe / BiOCl (0,25) ( c , d )
Com base nos resultados de que nenhum deslocamento de pico aparente e nenhum novo pico de difração relacionado a espécies de Fe são observados em padrões de XRD, bem como o mesmo d espaçamentos de BiOCl e Fe / BiOCl, pode-se concluir que Fe 3+ íons não são detectados em nossas amostras de Fe / BiOCl. Para provar ainda mais a presença de Fe 3+ íons, o mapeamento elementar de Fe / BiOCl (0,25) foi realizado por SEM com um raio-X de energia dispersiva (EDX), cujo resultado é mostrado na Fig. 4. Como pode ser visto na Fig. 4, o elemento Fe é homogêneo distribuídas na superfície de micro-flores Fe / BiOCl, o que evidencia fortemente a existência de Fe 3+ íons.

Imagens SEM típicas ( a ) e o mapeamento elementar de Bi ( b ), Cl ( c ), todos os elementos ( d ), Fe ( e ), e O ( f ) de Fe / BiOCl (0,25)
A fim de determinar as composições químicas e especificar os estados químicos dos elementos de superfície em nossas amostras, a medição XPS foi realizada posteriormente (Fig. 5). O espectro de pesquisa da amostra Fe / BiOCl (0,25) se assemelha principalmente ao do BiOCl puro, que mostra a co-presença de elementos Bi, O, Cl e C, exceto por um pico fraco atribuído ao sinal de Fe na faixa de 700 ~ 750 eV. O pico C é do carbono adventício na superfície da amostra. Os espectros de alta resolução de Bi 4f (Fig. 5b) exibem dois picos intensos localizados em 164,8 e 159,5 eV, que são atribuídos a Bi 4f 5/2 e Bi 4f 7/2 , respectivamente. Conforme ilustrado nos espectros de nível de núcleo Cl 2p (Fig. 5c), existem dois picos claros localizados em 198,2 e 199,8 eV, que correspondem a Cl 2p 3/2 e Cl 2p 1/2 , respectivamente. As energias de ligação de 530,3 e 533,4 eV na Fig. 5d são atribuídas respectivamente ao oxigênio da rede em BiOCl ou Fe / BiOCl e aos grupos óxido-defeito e semelhante ao hidroxila [41]. Conforme representado na Fig. 5e, dois picos óbvios observados em 724,0 e 710,5 eV são atribuídos a Fe 2p 1/2 e Fe 2p 3/2 , respectivamente. A amplitude de energia entre os dois níveis é de cerca de 13 eV, que é um valor característico para Fe 3+ estado [11, 42]. Deve-se notar que não há mudanças críticas nas localizações dos picos observadas nos espectros Bi 4f, Cl 2p e O 1s após Fe 3+ modificação, indicando que o Fe 3+ íons foram apenas enxertados na superfície do BiOCl ou presentes como aglomerados amorfos semelhantes a FeO (OH) [43]. Particularmente, a técnica XPS também poderia ser adotada para detectar as composições químicas de elementos de superfície. Com base nos resultados do XPS, a razão molar Fe / Bi da amostra Fe / BiOCl (0,25) foi estimada em 0,27, o que está muito próximo do valor original arranjado.
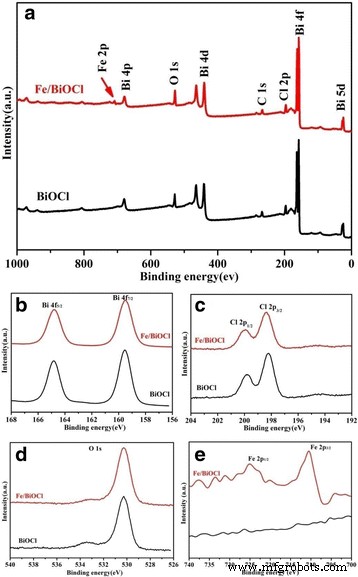
Os espectros de XPS de BiOCl e Fe / BiOCl (0,25). a Pesquisa, b Bi 4f, c Cl 2p, d O 1s e e Fe 2p
A área de superfície é um fator crucial para os adsorventes removerem corantes tóxicos, contaminantes orgânicos e íons metálicos [28, 33, 44]. Maior área de superfície específica ( S APOSTA ) e volume de poro ( V T ) de um adsorvente pode favorecer a capacidade de sorção [33]. Portanto, a área de superfície específica, bem como a distribuição do tamanho dos poros BJH foram medidos por N 2 Os experimentos de adsorção-dessorção e os resultados são mostrados na Fig. 6a e na Tabela 1. Ambos os N 2 As isotermas de adsorção-dessorção para as amostras BiOCl e Fe / BiOCl (0,25) são classificadas como tipo IV com loops de histerese H3, o que demonstra a existência de estrutura porosa formada entre cada nanoplacas ou nanofolhas intercruzadas [45, 46]. As curvas de distribuição de tamanho de poro BJH (inserção na Fig. 6a) confirmam ainda mais a presença de estruturas porosas em nossas amostras. Conforme listado na Tabela 1, o S APOSTA e V T os valores de Fe / BiOCl (0,25) são maiores do que aqueles de BiOCl, o que poderia ser atribuído ao menor tamanho de partícula e microestruturas abertas após Fe 3+ modificação.
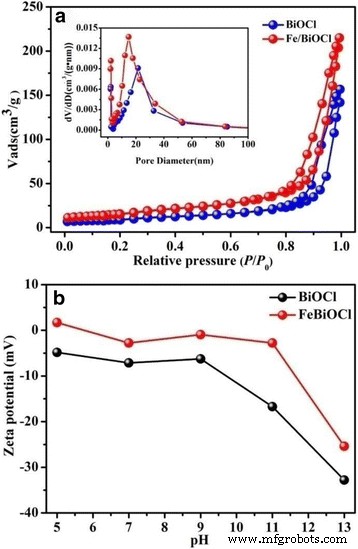
N 2 isotermas de adsorção-dessorção, bem como curvas de distribuição de tamanho de poro (inserir) ( a ) e potenciais zeta ( b ) de BiOCl e Fe / BiOCl (0,25)
O potencial Zeta é amplamente utilizado para quantificação da magnitude da carga superficial das partículas dispersas em solução [18], que é outro fator chave para um adsorvente. A Fig. 6b mostra o potencial zeta de BiOCl e Fe / BiOCl (0,25) medido em vários valores de pH. Conforme mostrado na Fig. 6b, a superfície do BiOCl é carregada negativamente entre o valor de pH de 5 ~ 13. Depois de Fe 3+ modificação, a carga é melhorada positivamente, mas ainda abaixo de 0 mV entre os valores de pH medidos. A melhoria positiva para a carga superficial é possivelmente atribuída à neutralização de carga via adsorção específica de Fe 3+ íons na superfície de BiOCl ou a formação de grupos hidroxila (Fe-OH) que são protonados para formar Fe-OH 2 + [35].
Capacidade de adsorção de BiOCl e Fe / BiOCl
No seguinte experimento de adsorção, Fe / BiOCl (0,25) foi selecionado como a amostra representativa para verificar o desempenho de adsorção de Fe / BiOCl ( x )
O corante catiônico RhB e o corante aniônico MO são escolhidos como os corantes orgânicos típicos para testar as capacidades de adsorção de BiOCl e Fe / BiOCl. A Figura 7 mostra as capacidades de adsorção de BiOCl e Fe / BiOCl em função da concentração inicial de RhB e MO com um aumento do tempo na faixa de 0,01 ~ 0,04 mmol / L. Como mostrado na Fig. 7, as capacidades de adsorção de BiOCl e Fe / BiOCl são dependentes do tempo em 20 min e diminuem com um aumento da concentração inicial de RhB e MO. A maior eficiência de adsorção em concentrações mais baixas está possivelmente relacionada ao fato de que um número máximo de moléculas de corante são propensas a adsorver em adsorventes preparados [47]. A Figura 7a, b revela que tanto BiOCl quanto Fe / BiOCl apresentam excelente eficiência de adsorção em relação ao corante catiônico RhB e podem atingir um máximo em 5 e 20 min para BiOCl e Fe / BiOCl, respectivamente. No entanto, BiOCl mostra desempenho de adsorção pobre em relação ao corante aniônico MO devido à repulsão eletrostática crescente, que é apenas cerca de 30% da eficiência de adsorção em 20 min. Depois de Fe 3+ modificação, a capacidade de adsorção é aumentada, que atinge cerca de 60% em 20 min. A capacidade de adsorção aumentada para MO aniônico pode estar relacionada à estrutura porosa mais aberta e área de superfície específica mais alta de Fe / BiOCl. Assim, pode-se deduzir que BiOCl e Fe / BiOCl são notáveis por remover o RhB, mas não são adsorventes adequados para MO.
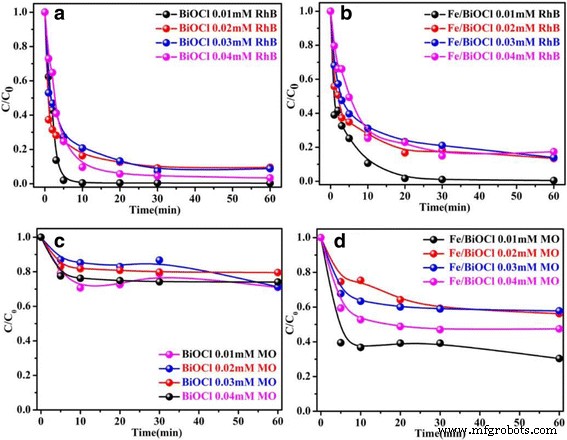
Efeito da concentração inicial nas capacidades de adsorção de BiOCl e Fe / BiOCl para RhB ( a , b ) e MO ( c , d ) (pH =7, temperatura =25 ° C)
O efeito da temperatura (25 ~ 85 ° C) nas capacidades de adsorção de BiOCl e Fe / BiOCl para RhB e MO também foi investigado. Os resultados mostrados na Fig. 8 demonstram que não há uma conexão próxima entre as capacidades de adsorção de BiOCl, bem como Fe / BiOCl e temperatura para remoção de RhB; entretanto, as capacidades de adsorção de BiOCl e Fe / BiOCl são altamente dependentes da temperatura em direção ao MO, e a baixa temperatura é favorável para este processo de adsorção. Além disso, as capacidades de adsorção de BiOCl e Fe / BiOCl para RhB são ainda maiores do que os valores para MO, cujo resultado é consistente com a Fig. 7. Com base nos resultados da Fig. 7, a atração eletrostática entre as moléculas de corante e adsorventes é principalmente responsável pela grande capacidade de adsorção do BiOCl. Depois de Fe 3+ modificação, a superfície de BiOCl é mais carregada positivamente (Fig. 6b), cujo resultado é análogo ao de Fe 3+ -enxerto de clinoptilolita [35]. Este fenômeno é desvantajoso para a remoção dos corantes catiônicos das soluções. No entanto, as capacidades de adsorção de Fe / BiOCl para RhB quase permanecem consistentes com os valores de BiOCl na faixa de temperatura de 25 ~ 85 ° C. Como é conhecido, uma área de superfície específica mais elevada pode fornecer locais mais ativos para a adsorção de moléculas de corante [33, 35, 48]. A área de superfície específica de Fe / BiOCl (58,96 m 2 / g) é maior do que BiOCl (35,05 m 2 / g); assim, a área de superfície específica também desempenha um papel importante no processo de adsorção de moléculas de corante em Fe / BiOCl.
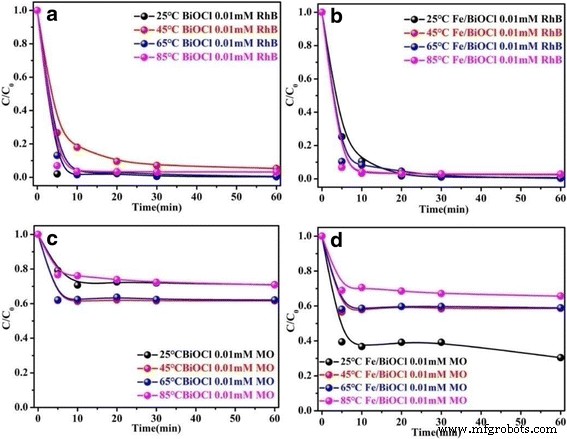
Efeito da temperatura nas capacidades de adsorção de BiOCl e Fe / BiOCl para RhB ( a , b ) e MO ( c , d ) (pH =7, concentração inicial =0,01 mmol / L)
O valor do pH da solução tem um papel vital no controle das interações entre o adsorvente e as moléculas do corante, pois tanto a carga superficial do adsorvente quanto o grau de ionização das moléculas do corante são altamente afetados pelo pH da solução [7]. O efeito do valor de pH na faixa de 5 ~ 13 ajustado por 0,1 M HCl ou 0,1 M NaOH nas capacidades de adsorção também foi estudado e os resultados são mostrados na Fig. 9. As capacidades de adsorção de BiOCl e Fe / BiOCl para RhB e MO são fortemente dependentes do pH, que apresentam baixo desempenho de adsorção na solução alcalina. A Figura 9a, b mostra que a taxa inicial de absorção da molécula de corante aumentou acentuadamente para 99,7% em 3 min em BiOCl e 93,0% em 10 min em Fe / BiOCl e então nivelou com o prolongamento do tempo no valor de pH de 5. Como conhecido, haveria uma competição de adsorção entre H + e moléculas RhB catiônicas na solução ácida [47, 49]. No entanto, as capacidades de adsorção de BiOCl e Fe / BiOCl em direção a RhB não apresentam diminuição em comparação com os valores em pH =7, o que indica que não há competição de adsorção entre H + e moléculas RhB catiônicas. É geralmente aceito que a solução alcalina é benéfica para o aumento das capacidades de adsorção de BiOCl e Fe / BiOCl para corantes catiônicos, porque BiOCl e Fe / BiOCl são carregados negativamente (Fig. 6b) e não há competição de adsorção entre OH - e moléculas de corante. Infelizmente, as capacidades de adsorção de BiOCl e Fe / BiOCl para RhB diminuíram drasticamente em pH =13, o que é possivelmente atribuído à destruição estrutural de BiOCl porque BiOCl é instável na solução alcalina forte [50]. O comportamento de adsorção de MO em BiOCl e Fe / BiOCl assemelha-se ao de RhB, ou seja, as capacidades de adsorção em solução ácida são maiores do que os valores na solução alcalina. A diferença é que as capacidades de adsorção de BiOCl e Fe / BiOCl para MO diminuem drasticamente em pH =11, fenômeno esse que pode estar relacionado à fraca competição de adsorção entre OH - e moléculas de MO aniônicas [35, 51].
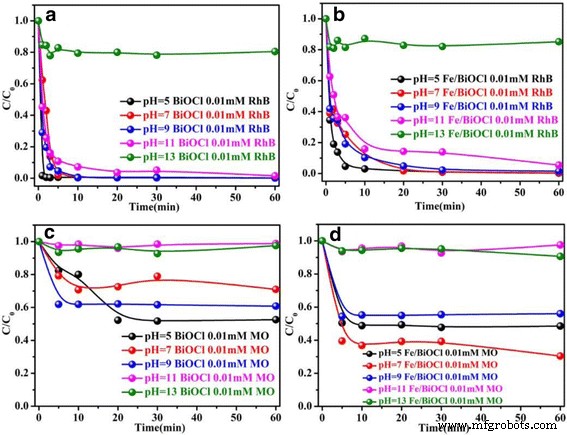
Efeito do valor de pH nas capacidades de adsorção de BiOCl e Fe / BiOCl para RhB ( a , b ) e MO ( c , d ) (temperatura =25 ° C, concentração inicial =0,01 mmol / L)
Com base nos experimentos de adsorção acima, as capacidades máximas de adsorção de BiOCl e Fe / BiOCl para RhB são otimizadas na condição de concentração inicial =0,01 mmol / L, valor de pH =5,0 e temperatura =25 ° C.
Mecanismo de Adsorção
Com base no potencial zeta e nos resultados de adsorção acima, podemos inferir que a forte atração eletrostática desempenha um papel importante no processo de adsorção. Para confirmar esta dedução, outros dois corantes orgânicos, incluindo azul de metileno catiônico (MB) e laranja de ácido aniônico (AO), são escolhidos para investigar melhor os desempenhos de adsorção de BiOCl e Fe / BiOCl. Arquivo adicional 1:A Figura S1 mostra as eficiências de adsorção de MB e AO em BiOCl e Fe / BiOCl. Conforme exibido no arquivo adicional 1:Figura S1, BiOCl e Fe / BiOCl exibem excelentes eficiências de adsorção em relação ao MB catiônico, mas desempenho decepcionante em relação ao AO aniônico, o que resulta na suposição de que a forte atração eletrostática é principalmente responsável pelos desempenhos de adsorção de BiOCl e Fe / BiOCl.
Além da forte atração eletrostática, a alta área de superfície específica e a estrutura porosa aberta também contribuem para os desempenhos de adsorção de adsorventes preparados. De um modo geral, o Fe 3+ o enxerto torna a superfície do BiOCl mais carregada positivamente (Fig. 6b) do que o BiOCl original, o que induziria a diminuição da capacidade de adsorção de Fe / BiOCl para as moléculas de corante catiônico. No entanto, a capacidade de adsorção do Fe / BiOCl mantém quase o mesmo valor do BiOCl. Além disso, Fe / BiOCl mostra maior capacidade de adsorção para moléculas de corante aniônico do que BiOCl nu, embora ambos sejam carregados negativamente. Deve-se notar que o Fe / BiOCl tem uma estrutura porosa mais aberta e maior área de superfície específica (resultados TEM e BET) do que o BiOCl original, ambos favoráveis para aumentar a capacidade de adsorção. Assim, pode-se deduzir que três parâmetros, incluindo atração eletrostática, maior área superficial específica e estrutura porosa mais aberta são responsáveis pela capacidade de adsorção de Fe / BiOCl.
Em uma conclusão, o mecanismo de adsorção de BiOCl e Fe / BiOCl para corantes orgânicos poderia ser resumido da seguinte forma:(1) Para o adsorvente BiOCl, a forte atração eletrostática é a principal razão para a capacidade de adsorção para moléculas de corante catiônico, mas estrutura porosa e a alta área de superfície específica é principalmente responsável pela capacidade de adsorção em direção às moléculas de corante aniônico; (2) Para o adsorvente Fe / BiOCl, três aspectos contendo atração eletrostática, estrutura porosa mais aberta e maior área de superfície específica são responsáveis pela capacidade de adsorção para moléculas de corante catiônico, mas os dois últimos aspectos são as principais razões para a capacidade de adsorção em direção às moléculas de corante aniônico.
Adsorção de corantes mistos em BiOCl e Fe / BiOCl
O efluente de corante industrial real é geralmente composto de mais de um tipo de corante. Portanto, uma série de soluções de corantes mistos é preparada para examinar o desempenho de adsorção de adsorventes como preparados. A Figura 10 exibe os desempenhos de adsorção seletiva de BiOCl e Fe / BiOCl para soluções de corante misto, e as capacidades de adsorção seletiva de moléculas de corante em função do tempo para BiOCl e Fe / BiOCl (0,25) são mostradas no arquivo adicional 1:Figuras S2 e S3, respectivamente. Os resultados revelam que BiOCl mostra desempenho de adsorção seletiva mais excelente do que Fe / BiOCl para moléculas de corante catiônico nas soluções de corante misto. No entanto, as capacidades de adsorção de várias moléculas de corante são geralmente menores do que as dos sistemas de corante único correspondentes, o que é possivelmente resultado da adsorção competitiva de moléculas de corante na superfície dos adsorventes [7].
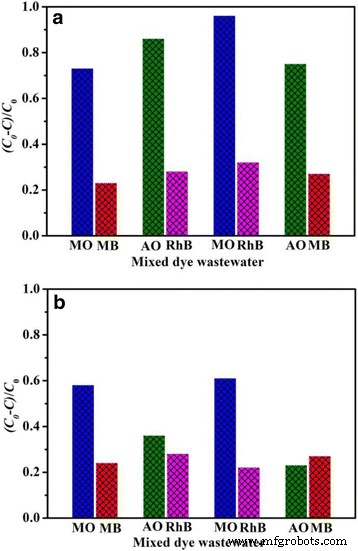
Capacidades de adsorção de MO, MB, RhB e AO em soluções de corantes mistos em BiOCl ( a ) e Fe / BiOCl ( b ) Condição de adsorção 50 mg de adsorvente, 25 mL de corante único em solução de corante misto, temperatura ambiente. All the concentration of dye solutions is 0.01 mmol/L
Adsorption Isotherms
Adsorption isotherm is often adopted to determine the equilibrium relationship between the adsorbent and the dye molecules as well as the equilibrium concentration of the dye molecules [52]. Langmuir isotherm and Freundlich isotherm are the most frequently used isotherms; the former model is based on the assumption that the maximum adsorption capacity keeps a correspondence with a saturated monolayer of solute molecules on the adsorbent surface, and the latter model describes a kind of multilayer adsorption with the solutes from a liquid to a solid surface and provides a relationship between the adsorbed dye amounts and the dye concentration at equilibrium [48, 49, 52]. The linear form of the Langmuir equation can be described as follows:
$$ \frac{C_e}{q_e}=\frac{1}{Q_0b}+\frac{C_e}{Q_0} $$ (3)
where C e (mg/L) is the equilibrium concentration of the dye molecules, q e (mg/g) is the amount of adsorbed dyes per unit mass of adsorbent at equilibrium, and Q 0 e b are the Langmuir constants which are related to adsorption capacity and rate of the adsorption, respectively.
The Freundlich isotherm, an empirical equation, can be described as follows:
$$ \ln {q}_e=\frac{1}{n_F}\ln {C}_e+\ln {K}_f $$ (4)
where q e (mg/g) is the amount of adsorbed dyes per unit mass of adsorbent at equilibrium, C e (mg/L) is the equilibrium concentration of dye molecules, and K f (L/mg) and n F are Freundlich constants which are associated with the adsorption capacity at unit concentration and adsorption intensity of the adsorbent, respectively.
The plots of the experimental data on the basis of Langmuir and Freundlich models are shown in Fig. 11 and Additional file 1:Figure S4, respectively. It is obviously observed in Fig. 11 and Additional file 1:Figure S4 that the Langmuir isotherm model displays a better fit to the experimental data for both BiOCl and Fe/BiOCl than the Freundlich isotherm model, which indicates the monolayer coverage of the surface of BiOCl and Fe/BiOCl by RhB molecules.
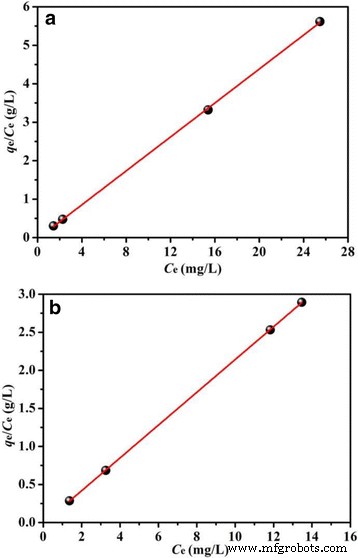
Langmuir isotherm for adsorption RhB on BiOCl (a ) and Fe/BiOCl (b )
Adsorption Kinetics
To further investigate the adsorption rate and the possible mechanism, kinetics of RhB adsorption on BiOCl and Fe/BiOCl at different temperatures were studied using the pseudo-first order and the pseudo-second order [53, 54], respectively.
The pseudo-first order can be described as Eq. (5):
$$ \ln \left({q}_e-{q}_t\right)=\ln {q}_e-{k}_1t $$ (5)
The pseudo-second-order can be described as Eq. (6):
$$ \frac{t}{q_t}=\frac{1}{k_2{q}_e^2}+\frac{t}{q_e} $$ (6)
where q t (mg/g) and q e (mg/g) are the amount of dye molecules adsorbed at t time and at equilibrium, respectively. k 1 (min − 1 ) and k 2 (g/(mg min)) represent the rate constant of the pseudo-first-order model and the pseudo-second-order model, respectively.
The plots of the experimental data simulated on the basis of the pseudo-first-order and the pseudo-second-order are shown in Additional file 1:Figure S5 and Fig. 12, respectively. As shown in Additional file 1:Figure S5 and Fig. 12, the experimental data shows a better fit to the pseudo-second-order model than the pseudo-first-order model. The values of kinetic parameters q e and k 2 and the corresponding correlation coefficients (R 2 ) are listed in Additional file 1:Table S1. All the q e values are very close to the theoretical value for complete adsorption capacity for RhB (4.79 mg/g), which indicates the forceful adsorption efficiency of BiOCl and Fe/BiOCl. The low q e value is possibly resulted by the low concentration of as-prepared dye solutions.
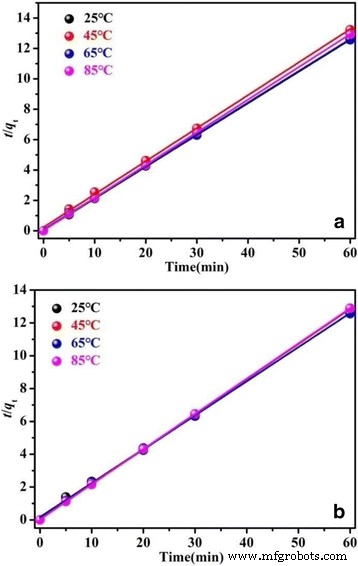
Pseudo-second-order kinetics for adsorption RhB on BiOCl (a ) and Fe/BiOCl (b )
Adsorption Cycles and Adsorbent Regeneration
For potential applications in pollutant treatment, the recycled utilization of an adsorbent plays a significant role. Thus, the adsorption cycle tests of BiOCl and Fe/BiOCl toward RhB were conducted and the results are shown in Fig. 13. As displayed in Fig. 13, the adsorption efficiency of BiOCl maintained more than 80% after three adsorption cycles. The adsorbent Fe/BiOCl also presented excellent adsorption efficiency, i.e., about 50% after five adsorption cycles, although which was slightly lower than that of BiOCl.
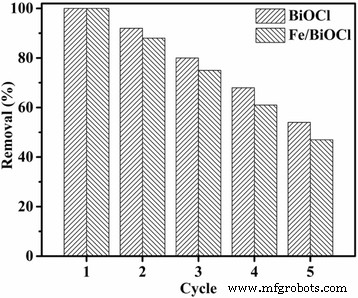
The adsorption cycle tests of BiOCl and Fe/BiOCl
It is generally accepted that BiOCl is recognized as an excellent photocatalyst toward organic dye photodegradation [22,23,24]. Thus, this photocatalytic performance could be applied to regenerate the adsorbents. Using RhB as reaction model, the regeneration of BiOCl and Fe/BiOCl was investigated and the detailed description was displayed in Additional file 1. Additional file 1:Figure S6 (a) showed the FT-IR spectra of RhB, BiOCl, and Fe/BiOCl and the corresponding counterparts after adsorption and photocatalytic process. A series of bands at 1000–1800 cm − 1 are attributed to RhB dye molecules [55], and the peak at 522 cm − 1 is attributed to the Bi–O stretching vibration [56]. After adsorption of RhB dye molecules onto BiOCl and Fe/BiOCl, many peaks belonging to RhB were observed and Bi–O stretching vibration did not changed, which confirmed the electrostatic interaction between adsorbents and RhB molecules as well as the high stability of adsorbents. In addition, the photocatalytic activities of BiOCl and Fe/BiOCl after adsorption were measured under visible light illuminations. After 60 min irradiation, the residual samples were collected and washed with water. It is noticeable that the characteristic peaks of functional groups for RhB molecules became very weak in samples BiOCl and Fe/BiOCl, forcefully demonstrating the regeneration and superior photocatalytic activities of absorbents. Additional file 1:Figure S6 (b) shows the intuitive photographs of as-prepared BiOCl and Fe/BiOCl and the corresponding samples after adsorption and photodegradation. The pristine BiOCl and Fe/BiOCl displayed white and light brown colors, which turned to nearly RhB color after adsorption and then approximately faded into the original color of samples after photodegradation. The color variation of the adsorbents verifies the adsorption and photodegradation of RhB over BiOCl and Fe/BiOCl, further confirming that BiOCl and Fe/BiOCl are excellent adsorbents and could be easily regenerated by a photocatalytic route.
Conclusões
In summary, two adsorbents including BiOCl and Fe/BiOCl were prepared for the removal of cationic and anionic dyes with low concentration from the solutions. After grafting Fe 3+ on the surface of BiOCl, the adsorbent showed more open porous structure and higher specific surface area. Both BiOCl and Fe/BiOCl are more favorable for removing the cationic dye molecules from the solution, whereas Fe/BiOCl displays higher adsorption capacity toward anionic dye molecules than BiOCl. Furthermore, BiOCl exhibited higher selective adsorption efficiency toward cationic dye molecules than Fe/BiOCl in mixed dye solutions. The prominent adsorption efficiency is probably to provide a potential application for as-prepared adsorbents in actual industrial wastewater.
Abreviações
- AO:
-
Acid orange
- BET:
-
Brunauer-Emmett-Teller
- BiOCl:
-
Bismuth oxychloride
- BJH:
-
Barrett-Joyner-Halenda
- Fe/BiOCl:
-
Fe 3+ -grafted BiOCl
- HRTEM:
-
High-resolution TEM
- MB:
-
Methylene blue
- MO:
-
Methyl orange
- RhB:
-
Rhodamine B
- S APOSTA :
-
Specific surface area
- SEM:
-
Microscopia eletrônica de varredura
- TEM:
-
Microscopia eletrônica de transmissão
- V T :
-
Pore volume
- XPS:
-
X-Ray photoelectron spectroscopy
- XRD:
-
X-ray powder diffraction
Nanomateriais
- Remoção adsortiva de íons de cobre (II) de solução aquosa usando um nanoadsorvente de magnetita de resíduos de escala de moinho:Síntese, caracterização, adsorção e modelagem cinética Estud…
- Preparação de nanopartículas de mPEG-ICA carregadas com ICA e sua aplicação no tratamento de dano celular H9c2 induzido por LPS
- Síntese biogênica, caracterização e avaliação do potencial antibacteriano de nanopartículas de óxido de cobre contra Escherichia coli
- Síntese de pontos quânticos do tipo II / tipo I suprimida por reabsorção / CdS / ZnS Core / Shell Quantum Dots e sua aplicação para ensaio de imunossorvente
- Síntese de nanocristais de ZnO e aplicação em células solares de polímero invertido
- Preparação de nanoesferas poliméricas impressas com íons de paládio (II) e sua remoção de paládio (II) da solução aquosa
- Síntese de pontos quânticos de sulfeto de antimônio solúvel em água e suas propriedades fotoelétricas
- Síntese de um vaso de nanoplacas Cu2ZnSnSe4 e sua atividade fotocatalítica orientada por luz visível
- Síntese fácil e ecológica de nanofios de Co3O4 e sua aplicação promissora com grafeno em baterias de íon-lítio
- Síntese e caracterização de nanoestruturas de cobre puro usando a arquitetura inerente da madeira como modelo natural



